原子结构
图片预览







文档简介
课件21张PPT。认识原子核1、原子如何构成?2、原子核与整个原子的体积的相对大小如何?3、质子、中子、电子的电性、电量如何?4、原子核所带的电荷数决定于什么物理量?5、为何整个原子显电中性?6、什么是质量数?7、元素、核素、同位素? 元素原子结构的特殊性
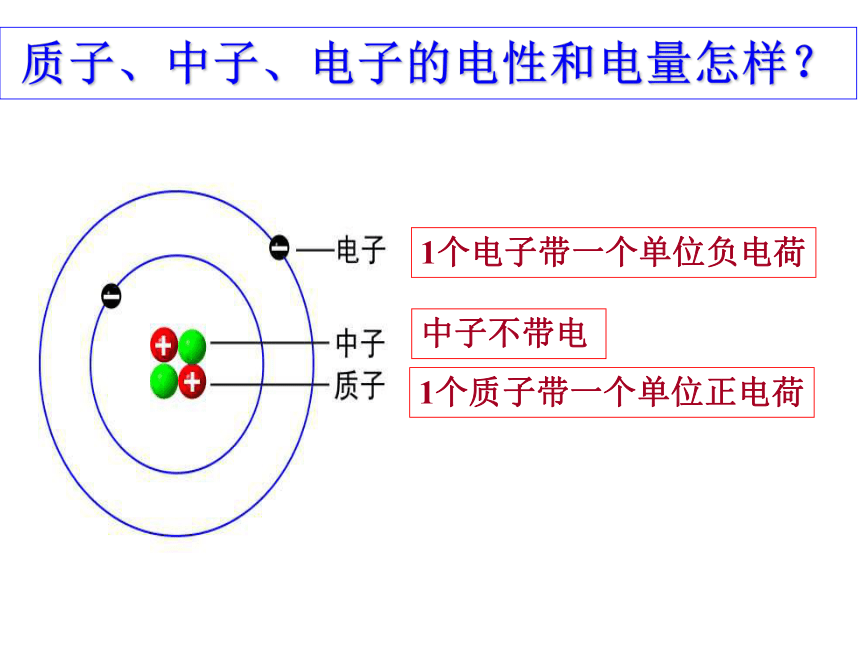
H 原子核中无中子。1、原子{原子核核外电子{质子中子2、原子及原子核大厦与乒乓球原子的体积主要由核外电子的运动空间决定质子、中子、电子的电性和电量怎样?1个质子带一个单位正电荷1个电子带一个单位负电荷中子不带电 阅读表1-7,质子、中子、电子的电性和电量怎样?
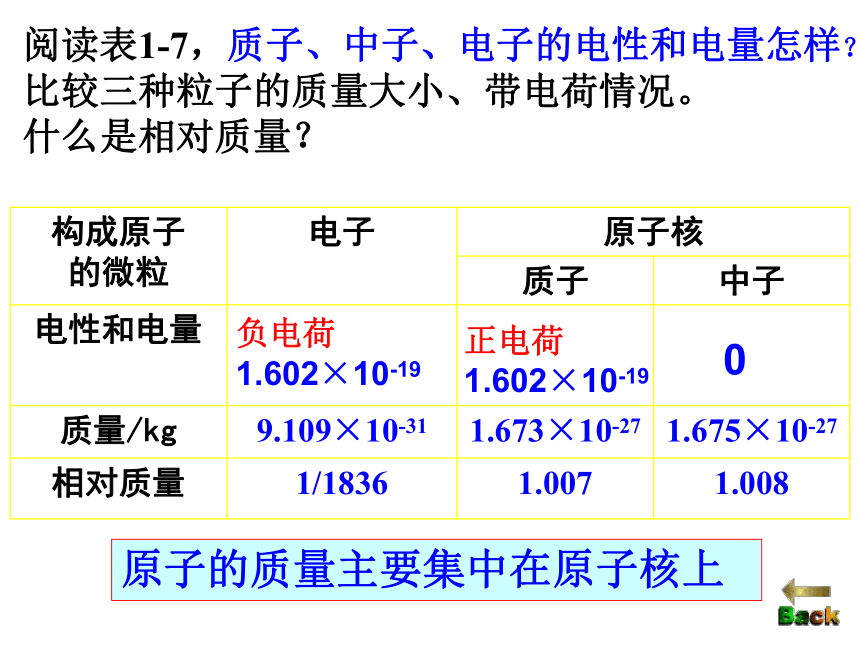
比较三种粒子的质量大小、带电荷情况。
什么是相对质量?负电荷1.602×10-19正电荷
1.602×10-190原子的质量主要集中在原子核上原子质量:
即原子的真实质量也称原子的绝对质量。单位 kg
粒子相对质量:注:①单位1(一般不写出)
②粒子:可以原子、质子、中子、
电子等微观粒子
③质子、中子的相对质量约为1
电性关系:
原子: 核电荷数(Z)=核内质子数=核外电子数
阳离子:核电荷数(Z)=核内质子数>核外电子数
核电荷数(Z)=核外电子数+电荷数
阴离子:核电荷数(Z)=核内质子数<核外电子数
核电荷数(Z)=核外电子数—电荷数原子核内所有的质子和中子的相对质量取近似整数值加起来所得数值,叫做质量数。 质量数(A)=质子数(Z)+ 中子数(N) 质量数原子组成的表示方法:质量数— 质子数—
(核电荷数) —元素符号 919 11
231327——元素符号质量数 —— 核电荷数 ——
(核内质子数)含义:代表一个质量数为A、质子数为Z的原子。
质量数化合价离子电荷质子数O8162-2- 2原子个数实例理解元素:具有相同质子数的同一类原子的总称。 同位素:
质子数相同而中子数不同的核素互称为同位素。核素:具有一定质子数和一定中子数的一种原子。HDT同位素的特点:
①天然存在的元素,各同位素在自然界的含量占该元素总量的百分比(称为“丰度”,即原子百分比)基本上是固定的。②同种元素,可以有若干种不同的核素.
(元素:112种,同位素:1800种)③同位素是同一元素的不同核素之间的互相称谓,不指具体的原子。
同一种元素的不同同位素原子其质量数不同,核外电子层结构相同,其原子、单质及其构成的化合物化学性质几乎相同,只是某些物理性质略有差异。同位素构成的化合物是不同的化合物,H2O、D2O、T2O的物理性质不同,化学性质几乎相同。
A= A1×a1%+A2×a2%+A3×a3%+……
A:元素的相对原子质量
A1 、A2、 A3、……同位素的相对原子质量
a1%、a2%、a3%、 ……同位素在自然界的含量占该元素总量的百分比(称为“丰度”,即原子百分比)或者是同位素的物质的量分数
元素的相对原子质量是怎样得到的?据报道,上海某医院正在研究用放射性的一
种碘 治疗肿瘤。该碘原子的核内的中子数与核外电子数之差是A、72 B、19 C、53 D、125B某二价阴离子,核外有18个电子,质量数为32,则其中子数为:A、12 B、14 C、16 D、18CA、核外有13个电子
B、核内有6个质子,核外有7个电子
C、质量数为13,质子数为6,核外有7个电子
D、质量数为13,质子数为6,核内有7个中子
(00全国高考题)D⒈原子的构成是本节重点,掌握的关系式:
小结的含义:代表一个质量数为A、
质子数为Z的原子。
中各个字母的含义:
A:质量数
Z:质子数
e:原子个数
c:电荷数
d: 化合价
2、电性关系:
原子:核电荷数(Z)=核内质子数=核外电子数
阳离子:核电荷数(Z)=核内质子数>核外电子数
核电荷数(Z)=核外电子数+电荷数
阴离子:核电荷数(Z)=核内质子数<核外电子数
核电荷数(Z)=核外电子数—电荷数
3、质量关系:质量数(A)=质子数(Z)+中子数( N)
4、元素、核素、同位素和Na+具有相同质子数和电子数的微粒是:
A、NH4+ B、F - C、H2O D、NH3AB
H 原子核中无中子。1、原子{原子核核外电子{质子中子2、原子及原子核大厦与乒乓球原子的体积主要由核外电子的运动空间决定质子、中子、电子的电性和电量怎样?1个质子带一个单位正电荷1个电子带一个单位负电荷中子不带电 阅读表1-7,质子、中子、电子的电性和电量怎样?
比较三种粒子的质量大小、带电荷情况。
什么是相对质量?负电荷1.602×10-19正电荷
1.602×10-190原子的质量主要集中在原子核上原子质量:
即原子的真实质量也称原子的绝对质量。单位 kg
粒子相对质量:注:①单位1(一般不写出)
②粒子:可以原子、质子、中子、
电子等微观粒子
③质子、中子的相对质量约为1
电性关系:
原子: 核电荷数(Z)=核内质子数=核外电子数
阳离子:核电荷数(Z)=核内质子数>核外电子数
核电荷数(Z)=核外电子数+电荷数
阴离子:核电荷数(Z)=核内质子数<核外电子数
核电荷数(Z)=核外电子数—电荷数原子核内所有的质子和中子的相对质量取近似整数值加起来所得数值,叫做质量数。 质量数(A)=质子数(Z)+ 中子数(N) 质量数原子组成的表示方法:质量数— 质子数—
(核电荷数) —元素符号 919 11
231327——元素符号质量数 —— 核电荷数 ——
(核内质子数)含义:代表一个质量数为A、质子数为Z的原子。
质量数化合价离子电荷质子数O8162-2- 2原子个数实例理解元素:具有相同质子数的同一类原子的总称。 同位素:
质子数相同而中子数不同的核素互称为同位素。核素:具有一定质子数和一定中子数的一种原子。HDT同位素的特点:
①天然存在的元素,各同位素在自然界的含量占该元素总量的百分比(称为“丰度”,即原子百分比)基本上是固定的。②同种元素,可以有若干种不同的核素.
(元素:112种,同位素:1800种)③同位素是同一元素的不同核素之间的互相称谓,不指具体的原子。
同一种元素的不同同位素原子其质量数不同,核外电子层结构相同,其原子、单质及其构成的化合物化学性质几乎相同,只是某些物理性质略有差异。同位素构成的化合物是不同的化合物,H2O、D2O、T2O的物理性质不同,化学性质几乎相同。
A= A1×a1%+A2×a2%+A3×a3%+……
A:元素的相对原子质量
A1 、A2、 A3、……同位素的相对原子质量
a1%、a2%、a3%、 ……同位素在自然界的含量占该元素总量的百分比(称为“丰度”,即原子百分比)或者是同位素的物质的量分数
元素的相对原子质量是怎样得到的?据报道,上海某医院正在研究用放射性的一
种碘 治疗肿瘤。该碘原子的核内的中子数与核外电子数之差是A、72 B、19 C、53 D、125B某二价阴离子,核外有18个电子,质量数为32,则其中子数为:A、12 B、14 C、16 D、18CA、核外有13个电子
B、核内有6个质子,核外有7个电子
C、质量数为13,质子数为6,核外有7个电子
D、质量数为13,质子数为6,核内有7个中子
(00全国高考题)D⒈原子的构成是本节重点,掌握的关系式:
小结的含义:代表一个质量数为A、
质子数为Z的原子。
中各个字母的含义:
A:质量数
Z:质子数
e:原子个数
c:电荷数
d: 化合价
2、电性关系:
原子:核电荷数(Z)=核内质子数=核外电子数
阳离子:核电荷数(Z)=核内质子数>核外电子数
核电荷数(Z)=核外电子数+电荷数
阴离子:核电荷数(Z)=核内质子数<核外电子数
核电荷数(Z)=核外电子数—电荷数
3、质量关系:质量数(A)=质子数(Z)+中子数( N)
4、元素、核素、同位素和Na+具有相同质子数和电子数的微粒是:
A、NH4+ B、F - C、H2O D、NH3AB
