第二单元 铁、铜的获取及应用第二课时
图片预览


文档简介
课件11张PPT。铁、铜及其化合物的应用从矿物到基础材料第二单元(第二课时)本节内容:一、单质的物理性质二、单质化学性质与的鉴别三、Fe2+Fe3+与的相互转化四、五、铁及铜的化合物的应用一、单质的物理性质1、铁是可以被磁铁吸引的银白色金属
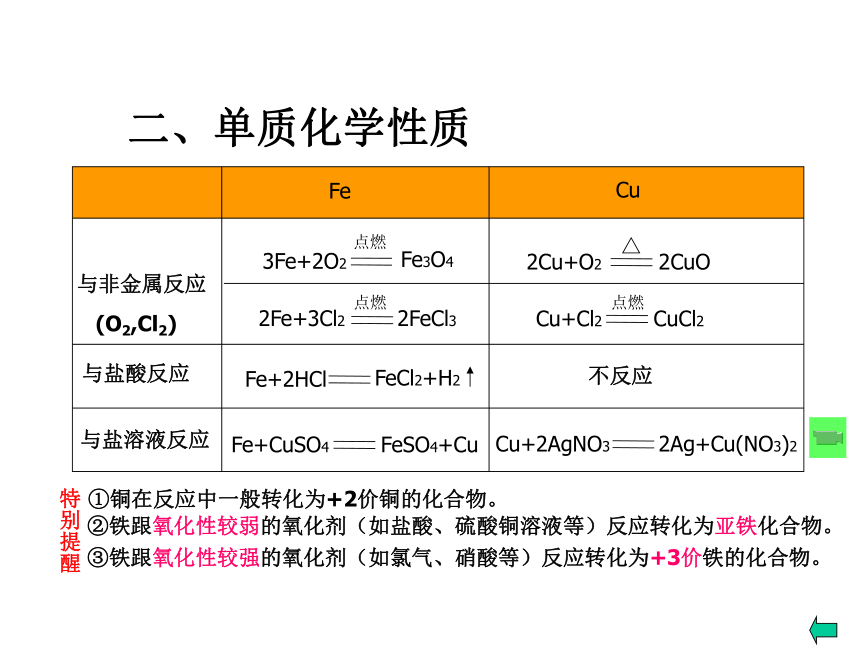
铜是紫红色的金属。2、铁和铜都有良好的导电性和导热性。3、铁和铜的密度较大,熔沸点较高。4.具有良好的延展性;二、单质化学性质不反应与非金属反应
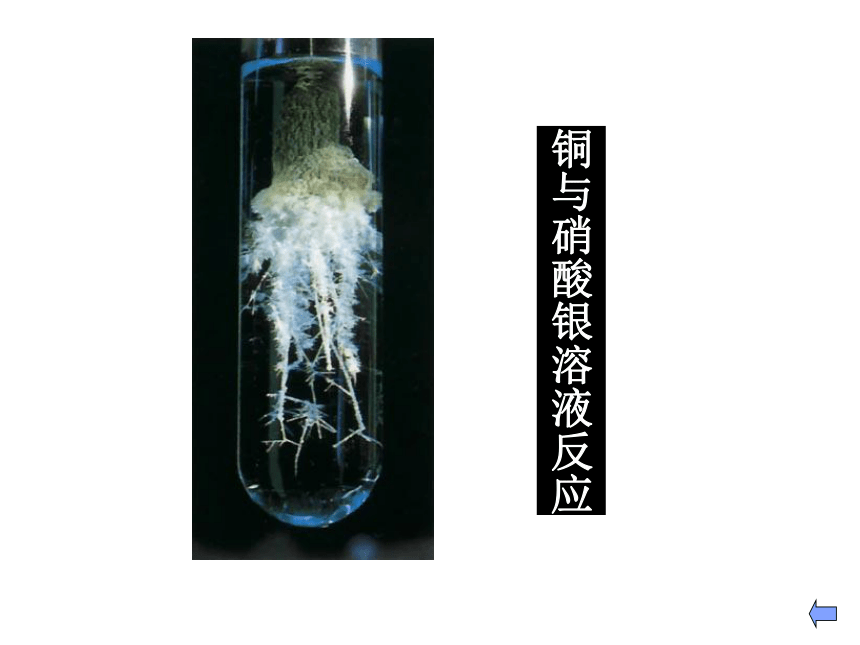
(O2,Cl2)与盐酸反应与盐溶液反应①铜在反应中一般转化为+2价铜的化合物。特别提醒②铁跟氧化性较弱的氧化剂(如盐酸、硫酸铜溶液等)反应转化为亚铁化合物。③铁跟氧化性较强的氧化剂(如氯气、硝酸等)反应转化为+3价铁的化合物。铜与硝酸银溶液反应Fe3+ + 3SCN - = Fe(SCN)3可溶血红色注意: Fe3+ 遇SCN - 显血红色
Fe2+ 遇SCN –不变色用途:用KSCN溶液检验溶液中是否含有Fe3+ 观察溶液颜色与KSCN反应与NaOH反应浅绿色棕黄色无明显现象溶液变为血红色白色沉淀迅速变灰
绿色最后呈红褐色立即产生红
褐色沉淀小结:氧化性较强的氧化剂如Cl2、硝酸等化合价 , 升高需加入氧化剂。还原剂。降低Fe氧化性较强的氧化剂如Cl2、硝酸等Zn 、Al、 Mg等等Zn、Al、Mg
结论KSCN一、无明显变化二、加入KSCN
溶液后溶液呈
血红色结论(一)溶液变成血红色(二)加铁粉后
溶液由黄色变成
浅绿色加KSCN
溶液后无明显变化五、铁及铜的化合物的应用1、铁的化合物①Fe2O3作颜料②氯化铁、硫酸亚铁可作净水剂③作磁性材料④维持生命的微量元素2、铜的化合物:铜盐可杀菌,CuSO4溶液杀灭寄生虫,治疗皮肤病。
铜是紫红色的金属。2、铁和铜都有良好的导电性和导热性。3、铁和铜的密度较大,熔沸点较高。4.具有良好的延展性;二、单质化学性质不反应与非金属反应
(O2,Cl2)与盐酸反应与盐溶液反应①铜在反应中一般转化为+2价铜的化合物。特别提醒②铁跟氧化性较弱的氧化剂(如盐酸、硫酸铜溶液等)反应转化为亚铁化合物。③铁跟氧化性较强的氧化剂(如氯气、硝酸等)反应转化为+3价铁的化合物。铜与硝酸银溶液反应Fe3+ + 3SCN - = Fe(SCN)3可溶血红色注意: Fe3+ 遇SCN - 显血红色
Fe2+ 遇SCN –不变色用途:用KSCN溶液检验溶液中是否含有Fe3+ 观察溶液颜色与KSCN反应与NaOH反应浅绿色棕黄色无明显现象溶液变为血红色白色沉淀迅速变灰
绿色最后呈红褐色立即产生红
褐色沉淀小结:氧化性较强的氧化剂如Cl2、硝酸等化合价 , 升高需加入氧化剂。还原剂。降低Fe氧化性较强的氧化剂如Cl2、硝酸等Zn 、Al、 Mg等等Zn、Al、Mg
结论KSCN一、无明显变化二、加入KSCN
溶液后溶液呈
血红色结论(一)溶液变成血红色(二)加铁粉后
溶液由黄色变成
浅绿色加KSCN
溶液后无明显变化五、铁及铜的化合物的应用1、铁的化合物①Fe2O3作颜料②氯化铁、硫酸亚铁可作净水剂③作磁性材料④维持生命的微量元素2、铜的化合物:铜盐可杀菌,CuSO4溶液杀灭寄生虫,治疗皮肤病。
