扬州市弘扬中学2007-2008学年度上学期期中考试高一化学试题(江苏省扬州市)
文档属性
| 名称 | 扬州市弘扬中学2007-2008学年度上学期期中考试高一化学试题(江苏省扬州市) |  | |
| 格式 | zip | ||
| 文件大小 | 29.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2007-11-24 16:19:00 | ||
图片预览



文档简介
扬州市弘扬中学2007-2008学年度上学期期中考试试题
高 一 化 学 命题人:
考生须知:
1.本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,满分100分,考试时间90分钟。
2.所有答案必须写在答题卷上,写在试卷上无效。
3.考试结束,上交答题卷。
可能用到的相对原子质量:H:1 C:12 N:14 O:16 Na:23 Mg:24 Al:27 Si:28 S: 32 Cl:35.5 K:39 Ca:40 Cu:64 Ba:137
第Ⅰ卷(选择题 共60分)
一、选择题(本题包括10小题,每小题3分,共30分,每小题只有一个选项符合题意)
1.九月二十六日,“中国扬州世界运河名城博览会暨运河名城市长论坛”在扬州开幕。开幕式上宣读了来自联合国副秘书长安娜女士的贺信,并且举行了中国大运河申遗机构揭牌仪式。这意味着扬州从24个中国大运河沿线城市中脱颖而出,成为了大运河申遗的牵头城市。以下措施不利于大运河申遗工作的是: ( )
A:在运河边新建一批小化工厂和小造纸厂,促进个体经济的发展;
B:打造“运河十里外滩景观带”,美化运河;
C:启动船舶垃圾和油废水回收站点的建设;
D:城市建设中,科学规划、预留空间,统筹广陵新城、物流集聚区、码头、港口等的开发建设;
2.我国的“嫦娥一号”探月卫星已发射成功,“嫦娥”探月工程取得重大进展。据科学家预测,月球的土壤中吸附着数百万吨的32He,每百吨32He核聚变所释放出的能量相当于目前人类一年消耗的能量。在地球上,氦元素主要以42He的形式存在。下列说法正确的是:( )
A.42He原子核内含有4个质子
B.32He和42He互为同位素
C.32He原子核内含有3个中子
D.42He的最外层电子数为4
3.提出近代原子学说的科学家是 ( )
A.道尔顿 B.汤姆生 C.卢瑟福 D.波尔
4.0.5mol Na2SO4中所含的Na+离子数为 ( )
A.3.01×1023 B.6.02×1023 C.0.5 D.1
5.每次实验焰色反应后都要用试剂清洗铂丝,这种清洗试剂是( )
A.Na2CO3溶液 B.NaOH溶液 C.硫酸 D.盐酸
6.下列物质中属于盐的是 ( )
A.CaO B.Ca(OH)2 C.CaCO3 D.CH4
7.下列物质中,属于纯净物的是 ( )
A.液氯 B.氯水 C.稀盐酸 D.漂白粉
8.容量瓶上标有的是 ( )
①温度 ②浓度 ③容量 ④质量 ⑤刻度线 ⑥酸式或碱式
A.①③⑤ B.③⑤⑥ C.①⑤⑥ D.②③⑤
9.下列物质中,不能使有色布条褪色的是 ( )
A.干燥Cl2 B.氯水
C.NaClO溶液 D.84消毒液
10、下列化学反应中,属于氧化还原反应的是 ( )
A.Na2CO3+CaCl2===CaCO3↓+2NaCl B.Fe+CuSO4===Cu+FeSO4
C.2NaHCO3Na2CO3+CO2↑+H2O
D.CaO+H2O===Ca(OH)2
二、选择题(本题包括10小题,每小题3分,共30分,每小题有一个或两个选项符合题意。若正确答案包括一个选项,多选时,该题得 0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且正确的给3分,但只要选错一个,该小题就为0分)
11.关于氯气的叙述中,下列正确的是 ( )
A.氯气是一种黄绿色、有毒的气体
B.氯气的密度比空气大
C.氯气不能溶解于水,所以可用排水法收集氯气
D.氯气、氯水、液氯是同一种物质,只是状态不同,都属于纯净物;
12.下列分离混合物的操作中,必须加热的是 ( )
A. 过滤 B.萃取 C.渗析 D.蒸馏
13.下列各组仪器:①漏斗;②容量瓶;③滴定管;④分液漏斗;⑤天平;⑥量筒;⑦胶头滴管;⑧蒸馏烧瓶。常用于物质分离的是 ( )
A.①③⑦ B.②⑥⑦
C.①④⑧ D.④⑥⑧
14.下列各组混合物可用分液漏斗分离的一组是 ( )
A.水和酒精 B.水和四氯化碳 C.Na2CO3溶液和泥沙 D.汽油和水
15.下列说法不正确的是: ( )
A、摩尔是物质的量的单位
B、1molCl原子的质量是35.5g
C、摩尔质量就是分子量
D、氨气的摩尔质量是17g
16.用NA表示阿伏加德罗常数的值,下列叙述正确的是 ( )
A.含有NA个氦原子的氦气在标准状况下的体积约为22.4L
B. 64g SO2中含有的分子数为NA
C.在常温常压下,11.2L Cl2含有的分子数为0.5NA
D.标准状况下,11.2LH2O 含有的分子数为0.5NA
17.“纳米材料”是当今材料科学研究的前沿,1纳米(nm)=10-9m,其研究成果广泛应用于催化及军事科学中,“纳米材料”是指研究、开发出的直径从几纳米至几十纳米的材料,如将“纳米材料”分散到液体分散剂中,所得混合物可能具有的性质是 ( )
A.有丁达尔效应 B.不能全部透过半透膜
C.不能透过滤纸 D.所得分散系不稳定
18.单晶硅是制作电子集成电路的基础材料。科学家预计,到2011年一个电脑芯片上将会集成10亿个晶体管,其功能远比我们想象的要大的多,这对硅的纯度要求很高。用化学方法可制得高纯度硅,其化学方程式为 :
①SiO2 + 2C Si + 2CO
②Si + 2Cl2SiCl4 ③SiCl4 + 2H2Si + 4HCl,
其中,反应①和③属于 ( )
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
19.为了除去KCl固体中少量MgSO4和CaCl2杂质,须进行下列六项操作,
①加水溶解;②加热蒸发得到晶体;③加入过量BaCl2溶液;④加入过量盐酸;⑤加入过量K2CO3; ⑥过滤。正确的次序是 ( )
A.①⑤③⑥④② B.①⑤③④⑥②
C.①③④⑥⑤② D.①③⑤⑥④②
20.绿色植物是空气天然的“净化器”,研究发现,1公顷柳杉每月可以吸收160kg SO2,则1公顷柳杉每月吸收的SO2的物质的量为( )
A.164kg B.2.5mol C.2500mol D.2500g/mol
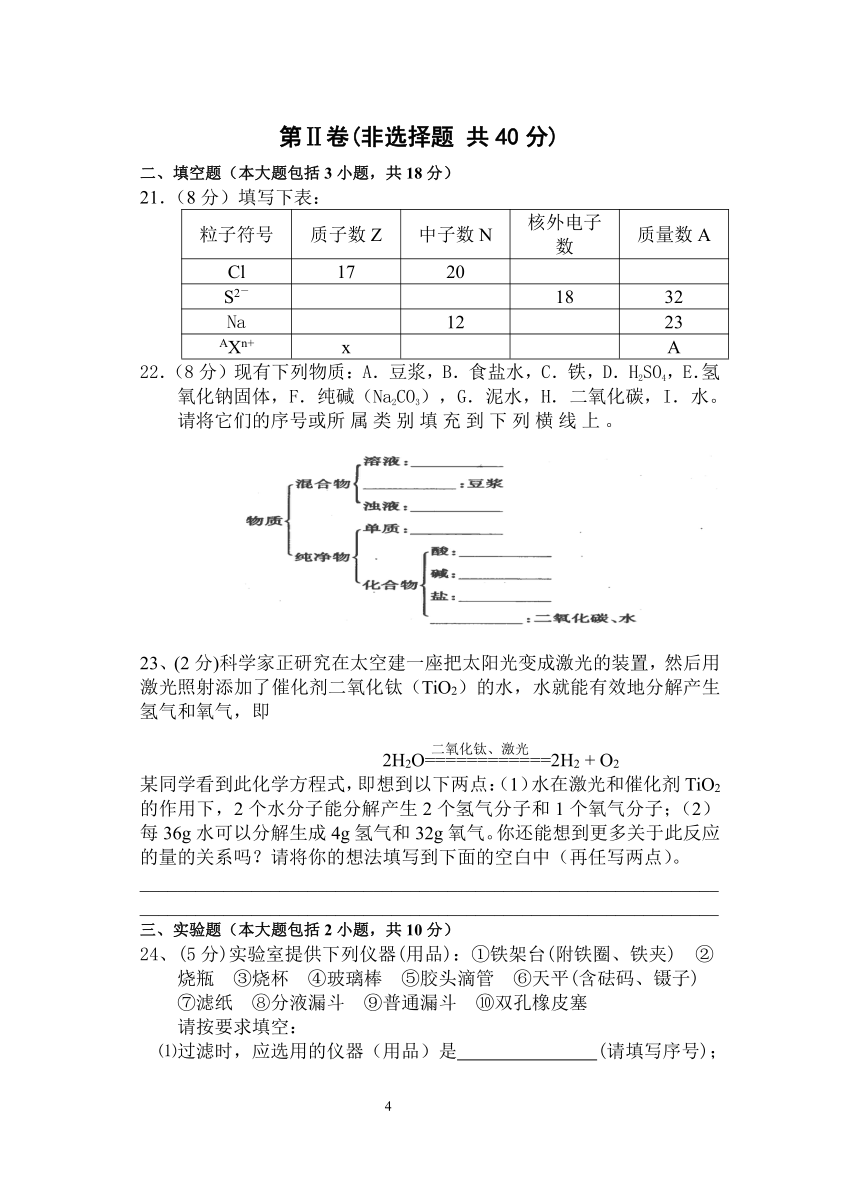
第Ⅱ卷(非选择题 共40分)
二、填空题(本大题包括3小题,共18分)
21.(8分)填写下表:
粒子符号 质子数Z 中子数N 核外电子数 质量数A
Cl 17 20
S2- 18 32
Na 12 23
AXn+ x A
22.(8分)现有下列物质:A.豆浆,B.食盐水,C.铁,D.H2SO4,E.氢氧化钠固体,F.纯碱(Na2CO3),G.泥水,H.二氧化碳,I.水。请将它们的序号或所属类别填充到下列横线上。
23、(2分)科学家正研究在太空建一座把太阳光变成激光的装置,然后用激光照射添加了催化剂二氧化钛(TiO2)的水,水就能有效地分解产生氢气和氧气,即
2H2O============2H2 + O2
某同学看到此化学方程式,即想到以下两点:(1)水在激光和催化剂TiO2的作用下,2个水分子能分解产生2个氢气分子和1个氧气分子;(2)每36g水可以分解生成4g氢气和32g氧气。你还能想到更多关于此反应的量的关系吗?请将你的想法填写到下面的空白中(再任写两点)。
______________________________________________________________
______________________________________________________________
三、实验题(本大题包括2小题,共10分)
24、(5分)实验室提供下列仪器(用品):①铁架台(附铁圈、铁夹) ②烧瓶 ③烧杯 ④玻璃棒 ⑤胶头滴管 ⑥天平(含砝码、镊子) ⑦滤纸 ⑧分液漏斗 ⑨普通漏斗 ⑩双孔橡皮塞
请按要求填空:
⑴过滤时,应选用的仪器(用品)是 (请填写序号);
⑵萃取并分液时,应选用的仪器是 (请填写序号);
⑶欲配制500mL0.100mol/L的Na2CO3溶液,除上述提供的仪器外还缺少的仪器是 。人们常将配制过程简述为以下各步骤:A.冷却 B.称量 C.洗涤 D.定容 E.溶解 F.摇匀 G.转移。其中正确的操作顺序应是(填各步骤序号) 。
25.(5分)有一固体粉末,其中可能含有Na2CO3、NaCl、Na2SO4、CuCl2、Ba(NO3)2、K2CO3、K2SO4中的一种或几种,现按下列步骤进行实验。
(1)将该粉末溶于水得无色溶液和白色沉淀。
(2)在滤出的沉淀中加入稀硝酸,有部分沉淀溶解,同时产生无色气体。
(3)取滤液做焰色反应,可证明滤液中含Na+,不含K+。
由上述现象推断:
(1)该混合物中一定含有 ;一定不含有 ,可能含有 。
(2)如要检验其是否存在,将如何操作 。
四、实验探究题(本题包括1小题,共6分)
26.(6分)化学课上,张老师展示两瓶无标签的溶液,说:“它们分别是稀盐酸和氢氧化钠溶液。请同学们设计不同的区别方案,然后动手实验,再加以小结。”几分钟后,“我们”设计了多种方案。
⑴“我”设计出的两种不同的区别方法是(只要写出试剂): 、 。
⑵交流实验方案时,筱宇同学设计的“用二氧化碳气体做试剂”引起了一场争论。
①正方观点:可以区别;反方观点:无法区别。
“我”赞同 (填“正方”或“反方”)的观点,其理由是 。
②验证氢氧化钠与二氧化碳是否发生了反应,从生成物的角度去探究,可以这样验证(简要写出方法、现象、结论)
。
五、计算题(6分)
27、工业上通过电解饱和的食盐水来制取氯气。现取500ml含NaCl为11.7g的饱和食盐水进行电解,
2NaCl + 2H2O == 2NaOH + H2↑ +Cl2↑
在标准状况下制得Cl2多少升?
所得NaOH的物质的量浓度为多少?(电解前后溶液体积保持不变)
扬州市弘扬中学2007-2008学年度上学期期中考试试题
高 一 化 学 答 题 纸
第Ⅰ卷(选择题 共60分)
一、二、选择题
题号 1 2 3 4 5 6 7 8 9 10
答案
题号 11 12 13 14 15 16 17 18 19 20
答案
第Ⅱ卷(非选择题 共40分)
三、填空题(本大题包括3小题,共18分)
21.(8分)填写下表:
粒子符号 质子数Z 中子数N 核外电子数 质量数A
Cl 17 20
S2- 18 32
Na 12
AXn+ x A
22.(8分)
23、(2分)
_____________________________________________________________
_____________________________________________________________
四、实验题(本题包括2小题,共20分)
24、(5分) ⑴ (请填写序号);
⑵ (请填写序号);
⑶ ; (2分)。
25.(5分)(1)该混合物中一定含有 ;一定不含有 ,可能含有 。
(2)(2分)如要检验其是否存在,将如何操作
。
五、实验探究题(本题包括1小题,共6分)
26.(6分)⑴ 、 。
⑵ ①“我”赞同 (填“正方”或“反方”)的观点,
其理由是 。
②(2分)
。
六、计算题(6分)
27、
参考答案:
二、选择题
题号 1 2 3 4 5 6 7 8 9 10
答案 A B A B D C A A A B
题号 11 12 13 14 15 16 17 18 19 20
答案 AB D C BD CD AB AB C D C
21.【说明】在原子中有下列关系:质子数+中子数=质量数,核外电子数=核内质子数
粒子符号 质子数Z 中子数N 核外电子数 质量数A
Cl 17 37
S2- 16 16
Na 11 11 23
AXn+ A—x x—n
22、B、胶体、G、C、D、E、F、氧化物
23、(1)1mol 水可以分解生成1mol氢气和0.5mol氧气
(2)标准状况下,1mol水可以分解生成22.4L氢气和11.2L氧气
24.⑴①③④⑦⑨ ⑵①③⑧ ⑶500mol的容量瓶 BEAGC(F)DF
25.(1)Na2CO3、Na2SO4、Ba(NO3)2 ;CuCl2、K2CO3、K2SO4;NaCl
(2)取少量所得滤液于试管,向其中加入几滴AgNO3溶液,再加几滴稀HNO3,产生白色不溶于稀HNO3的沉淀,证明原混合物中有NaCl,否则原混合物中无NaCl。
26.⑴紫色石蕊试液(或无色酚酞试液或pH试纸)、锌(或铁等活泼金属)、氧化铜(或氧化铁等不溶性碱性氧化物)、二氧化碳(或二氧化硫等酸性氧化物)、氢氧化铜(或氢氧化镁等不溶性碱)、碳酸钙(或碳酸钠等碳酸盐)、硫酸铜(或氯化铜等及硫酸铁或氯化铁)等
⑵①正方(或反方) 用软塑料瓶收集两瓶二氧化碳气体,分别加入等量稀盐酸和氢氧化钠溶液,立即盖紧瓶塞,软塑料瓶变瘪明显的是氢氧化钠溶液(反方:二氧化碳与氢氧化钠反应无明显现象)(或其他合理答案)
②向生成物中滴加稀盐酸等酸(或氢氧化钙、氢氧化钡等碱,或氯化钙、氯化钡等盐),若有气泡产生(或对应有沉淀产生),则说明氢氧化钠与二氧化碳发生了反应
27.(1):2.24L
(2):0.4mol/L
二氧化钛、激光
通电
1
高 一 化 学 命题人:
考生须知:
1.本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,满分100分,考试时间90分钟。
2.所有答案必须写在答题卷上,写在试卷上无效。
3.考试结束,上交答题卷。
可能用到的相对原子质量:H:1 C:12 N:14 O:16 Na:23 Mg:24 Al:27 Si:28 S: 32 Cl:35.5 K:39 Ca:40 Cu:64 Ba:137
第Ⅰ卷(选择题 共60分)
一、选择题(本题包括10小题,每小题3分,共30分,每小题只有一个选项符合题意)
1.九月二十六日,“中国扬州世界运河名城博览会暨运河名城市长论坛”在扬州开幕。开幕式上宣读了来自联合国副秘书长安娜女士的贺信,并且举行了中国大运河申遗机构揭牌仪式。这意味着扬州从24个中国大运河沿线城市中脱颖而出,成为了大运河申遗的牵头城市。以下措施不利于大运河申遗工作的是: ( )
A:在运河边新建一批小化工厂和小造纸厂,促进个体经济的发展;
B:打造“运河十里外滩景观带”,美化运河;
C:启动船舶垃圾和油废水回收站点的建设;
D:城市建设中,科学规划、预留空间,统筹广陵新城、物流集聚区、码头、港口等的开发建设;
2.我国的“嫦娥一号”探月卫星已发射成功,“嫦娥”探月工程取得重大进展。据科学家预测,月球的土壤中吸附着数百万吨的32He,每百吨32He核聚变所释放出的能量相当于目前人类一年消耗的能量。在地球上,氦元素主要以42He的形式存在。下列说法正确的是:( )
A.42He原子核内含有4个质子
B.32He和42He互为同位素
C.32He原子核内含有3个中子
D.42He的最外层电子数为4
3.提出近代原子学说的科学家是 ( )
A.道尔顿 B.汤姆生 C.卢瑟福 D.波尔
4.0.5mol Na2SO4中所含的Na+离子数为 ( )
A.3.01×1023 B.6.02×1023 C.0.5 D.1
5.每次实验焰色反应后都要用试剂清洗铂丝,这种清洗试剂是( )
A.Na2CO3溶液 B.NaOH溶液 C.硫酸 D.盐酸
6.下列物质中属于盐的是 ( )
A.CaO B.Ca(OH)2 C.CaCO3 D.CH4
7.下列物质中,属于纯净物的是 ( )
A.液氯 B.氯水 C.稀盐酸 D.漂白粉
8.容量瓶上标有的是 ( )
①温度 ②浓度 ③容量 ④质量 ⑤刻度线 ⑥酸式或碱式
A.①③⑤ B.③⑤⑥ C.①⑤⑥ D.②③⑤
9.下列物质中,不能使有色布条褪色的是 ( )
A.干燥Cl2 B.氯水
C.NaClO溶液 D.84消毒液
10、下列化学反应中,属于氧化还原反应的是 ( )
A.Na2CO3+CaCl2===CaCO3↓+2NaCl B.Fe+CuSO4===Cu+FeSO4
C.2NaHCO3Na2CO3+CO2↑+H2O
D.CaO+H2O===Ca(OH)2
二、选择题(本题包括10小题,每小题3分,共30分,每小题有一个或两个选项符合题意。若正确答案包括一个选项,多选时,该题得 0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且正确的给3分,但只要选错一个,该小题就为0分)
11.关于氯气的叙述中,下列正确的是 ( )
A.氯气是一种黄绿色、有毒的气体
B.氯气的密度比空气大
C.氯气不能溶解于水,所以可用排水法收集氯气
D.氯气、氯水、液氯是同一种物质,只是状态不同,都属于纯净物;
12.下列分离混合物的操作中,必须加热的是 ( )
A. 过滤 B.萃取 C.渗析 D.蒸馏
13.下列各组仪器:①漏斗;②容量瓶;③滴定管;④分液漏斗;⑤天平;⑥量筒;⑦胶头滴管;⑧蒸馏烧瓶。常用于物质分离的是 ( )
A.①③⑦ B.②⑥⑦
C.①④⑧ D.④⑥⑧
14.下列各组混合物可用分液漏斗分离的一组是 ( )
A.水和酒精 B.水和四氯化碳 C.Na2CO3溶液和泥沙 D.汽油和水
15.下列说法不正确的是: ( )
A、摩尔是物质的量的单位
B、1molCl原子的质量是35.5g
C、摩尔质量就是分子量
D、氨气的摩尔质量是17g
16.用NA表示阿伏加德罗常数的值,下列叙述正确的是 ( )
A.含有NA个氦原子的氦气在标准状况下的体积约为22.4L
B. 64g SO2中含有的分子数为NA
C.在常温常压下,11.2L Cl2含有的分子数为0.5NA
D.标准状况下,11.2LH2O 含有的分子数为0.5NA
17.“纳米材料”是当今材料科学研究的前沿,1纳米(nm)=10-9m,其研究成果广泛应用于催化及军事科学中,“纳米材料”是指研究、开发出的直径从几纳米至几十纳米的材料,如将“纳米材料”分散到液体分散剂中,所得混合物可能具有的性质是 ( )
A.有丁达尔效应 B.不能全部透过半透膜
C.不能透过滤纸 D.所得分散系不稳定
18.单晶硅是制作电子集成电路的基础材料。科学家预计,到2011年一个电脑芯片上将会集成10亿个晶体管,其功能远比我们想象的要大的多,这对硅的纯度要求很高。用化学方法可制得高纯度硅,其化学方程式为 :
①SiO2 + 2C Si + 2CO
②Si + 2Cl2SiCl4 ③SiCl4 + 2H2Si + 4HCl,
其中,反应①和③属于 ( )
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
19.为了除去KCl固体中少量MgSO4和CaCl2杂质,须进行下列六项操作,
①加水溶解;②加热蒸发得到晶体;③加入过量BaCl2溶液;④加入过量盐酸;⑤加入过量K2CO3; ⑥过滤。正确的次序是 ( )
A.①⑤③⑥④② B.①⑤③④⑥②
C.①③④⑥⑤② D.①③⑤⑥④②
20.绿色植物是空气天然的“净化器”,研究发现,1公顷柳杉每月可以吸收160kg SO2,则1公顷柳杉每月吸收的SO2的物质的量为( )
A.164kg B.2.5mol C.2500mol D.2500g/mol
第Ⅱ卷(非选择题 共40分)
二、填空题(本大题包括3小题,共18分)
21.(8分)填写下表:
粒子符号 质子数Z 中子数N 核外电子数 质量数A
Cl 17 20
S2- 18 32
Na 12 23
AXn+ x A
22.(8分)现有下列物质:A.豆浆,B.食盐水,C.铁,D.H2SO4,E.氢氧化钠固体,F.纯碱(Na2CO3),G.泥水,H.二氧化碳,I.水。请将它们的序号或所属类别填充到下列横线上。
23、(2分)科学家正研究在太空建一座把太阳光变成激光的装置,然后用激光照射添加了催化剂二氧化钛(TiO2)的水,水就能有效地分解产生氢气和氧气,即
2H2O============2H2 + O2
某同学看到此化学方程式,即想到以下两点:(1)水在激光和催化剂TiO2的作用下,2个水分子能分解产生2个氢气分子和1个氧气分子;(2)每36g水可以分解生成4g氢气和32g氧气。你还能想到更多关于此反应的量的关系吗?请将你的想法填写到下面的空白中(再任写两点)。
______________________________________________________________
______________________________________________________________
三、实验题(本大题包括2小题,共10分)
24、(5分)实验室提供下列仪器(用品):①铁架台(附铁圈、铁夹) ②烧瓶 ③烧杯 ④玻璃棒 ⑤胶头滴管 ⑥天平(含砝码、镊子) ⑦滤纸 ⑧分液漏斗 ⑨普通漏斗 ⑩双孔橡皮塞
请按要求填空:
⑴过滤时,应选用的仪器(用品)是 (请填写序号);
⑵萃取并分液时,应选用的仪器是 (请填写序号);
⑶欲配制500mL0.100mol/L的Na2CO3溶液,除上述提供的仪器外还缺少的仪器是 。人们常将配制过程简述为以下各步骤:A.冷却 B.称量 C.洗涤 D.定容 E.溶解 F.摇匀 G.转移。其中正确的操作顺序应是(填各步骤序号) 。
25.(5分)有一固体粉末,其中可能含有Na2CO3、NaCl、Na2SO4、CuCl2、Ba(NO3)2、K2CO3、K2SO4中的一种或几种,现按下列步骤进行实验。
(1)将该粉末溶于水得无色溶液和白色沉淀。
(2)在滤出的沉淀中加入稀硝酸,有部分沉淀溶解,同时产生无色气体。
(3)取滤液做焰色反应,可证明滤液中含Na+,不含K+。
由上述现象推断:
(1)该混合物中一定含有 ;一定不含有 ,可能含有 。
(2)如要检验其是否存在,将如何操作 。
四、实验探究题(本题包括1小题,共6分)
26.(6分)化学课上,张老师展示两瓶无标签的溶液,说:“它们分别是稀盐酸和氢氧化钠溶液。请同学们设计不同的区别方案,然后动手实验,再加以小结。”几分钟后,“我们”设计了多种方案。
⑴“我”设计出的两种不同的区别方法是(只要写出试剂): 、 。
⑵交流实验方案时,筱宇同学设计的“用二氧化碳气体做试剂”引起了一场争论。
①正方观点:可以区别;反方观点:无法区别。
“我”赞同 (填“正方”或“反方”)的观点,其理由是 。
②验证氢氧化钠与二氧化碳是否发生了反应,从生成物的角度去探究,可以这样验证(简要写出方法、现象、结论)
。
五、计算题(6分)
27、工业上通过电解饱和的食盐水来制取氯气。现取500ml含NaCl为11.7g的饱和食盐水进行电解,
2NaCl + 2H2O == 2NaOH + H2↑ +Cl2↑
在标准状况下制得Cl2多少升?
所得NaOH的物质的量浓度为多少?(电解前后溶液体积保持不变)
扬州市弘扬中学2007-2008学年度上学期期中考试试题
高 一 化 学 答 题 纸
第Ⅰ卷(选择题 共60分)
一、二、选择题
题号 1 2 3 4 5 6 7 8 9 10
答案
题号 11 12 13 14 15 16 17 18 19 20
答案
第Ⅱ卷(非选择题 共40分)
三、填空题(本大题包括3小题,共18分)
21.(8分)填写下表:
粒子符号 质子数Z 中子数N 核外电子数 质量数A
Cl 17 20
S2- 18 32
Na 12
AXn+ x A
22.(8分)
23、(2分)
_____________________________________________________________
_____________________________________________________________
四、实验题(本题包括2小题,共20分)
24、(5分) ⑴ (请填写序号);
⑵ (请填写序号);
⑶ ; (2分)。
25.(5分)(1)该混合物中一定含有 ;一定不含有 ,可能含有 。
(2)(2分)如要检验其是否存在,将如何操作
。
五、实验探究题(本题包括1小题,共6分)
26.(6分)⑴ 、 。
⑵ ①“我”赞同 (填“正方”或“反方”)的观点,
其理由是 。
②(2分)
。
六、计算题(6分)
27、
参考答案:
二、选择题
题号 1 2 3 4 5 6 7 8 9 10
答案 A B A B D C A A A B
题号 11 12 13 14 15 16 17 18 19 20
答案 AB D C BD CD AB AB C D C
21.【说明】在原子中有下列关系:质子数+中子数=质量数,核外电子数=核内质子数
粒子符号 质子数Z 中子数N 核外电子数 质量数A
Cl 17 37
S2- 16 16
Na 11 11 23
AXn+ A—x x—n
22、B、胶体、G、C、D、E、F、氧化物
23、(1)1mol 水可以分解生成1mol氢气和0.5mol氧气
(2)标准状况下,1mol水可以分解生成22.4L氢气和11.2L氧气
24.⑴①③④⑦⑨ ⑵①③⑧ ⑶500mol的容量瓶 BEAGC(F)DF
25.(1)Na2CO3、Na2SO4、Ba(NO3)2 ;CuCl2、K2CO3、K2SO4;NaCl
(2)取少量所得滤液于试管,向其中加入几滴AgNO3溶液,再加几滴稀HNO3,产生白色不溶于稀HNO3的沉淀,证明原混合物中有NaCl,否则原混合物中无NaCl。
26.⑴紫色石蕊试液(或无色酚酞试液或pH试纸)、锌(或铁等活泼金属)、氧化铜(或氧化铁等不溶性碱性氧化物)、二氧化碳(或二氧化硫等酸性氧化物)、氢氧化铜(或氢氧化镁等不溶性碱)、碳酸钙(或碳酸钠等碳酸盐)、硫酸铜(或氯化铜等及硫酸铁或氯化铁)等
⑵①正方(或反方) 用软塑料瓶收集两瓶二氧化碳气体,分别加入等量稀盐酸和氢氧化钠溶液,立即盖紧瓶塞,软塑料瓶变瘪明显的是氢氧化钠溶液(反方:二氧化碳与氢氧化钠反应无明显现象)(或其他合理答案)
②向生成物中滴加稀盐酸等酸(或氢氧化钙、氢氧化钡等碱,或氯化钙、氯化钡等盐),若有气泡产生(或对应有沉淀产生),则说明氢氧化钠与二氧化碳发生了反应
27.(1):2.24L
(2):0.4mol/L
二氧化钛、激光
通电
1
