化学反应的快慢
图片预览






文档简介
课件17张PPT。一次性饭盒的降解过程
海南乐东县冲坡中学 杨君兰化学反应的快慢一、化学反应速率——描述化学反应的快慢 1.概 念:单位时间内反应物或生成物浓度
的变化量来表示的物理量。
2.定义式:v = △ c/ △t
3.单位mol /(L · min)或 mol /(L · s)练 习1.对于反应Fe+2HCl=FeCl2+H2,2s内FeCl2的
物质的量浓度由2mol/L变为4mol/L,试用
FeCl2的物质的量浓度的变化来描述此反应的
快慢。
解:
v = △ c/ △t =( 4mol/L-2mol/L)/2s
= 2 mol /(L · s)2. 反应H2+Cl2=2HCl,在2L的容器内发生,
3秒内H2的物质的量由5mol变为2mol,试用
H2的物质的量浓度变化来描述此反应的快慢。
解:
△ c =( 5mol - 2mol)/2L=1.5mol/L
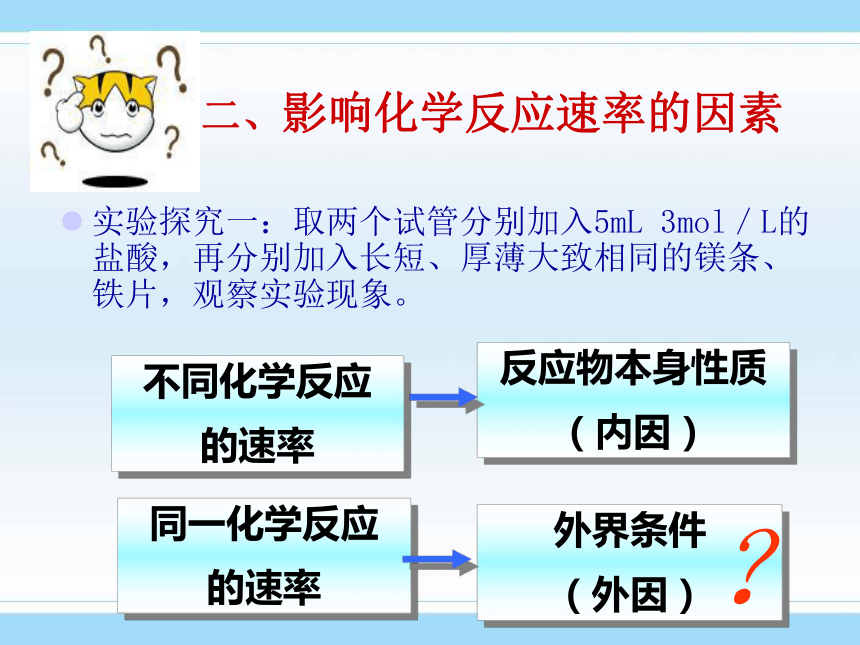
v = △ c/ △t=1.5mol/L/2s =2 mol /(L · s)不同化学反应
的速率反应物本身性质
(内因)同一化学反应
的速率外界条件
(外因)?二、影响化学反应速率的因素实验探究一:取两个试管分别加入5mL 3mol/L的盐酸,再分别加入长短、厚薄大致相同的镁条、铁片,观察实验现象。影响化学反应速率的因素(外因)(1)硫在纯氧气中和在空气中燃烧的剧烈程度不一样,说明什么?
(2)肉类食品易变质,放在冰箱中保鲜,可以减缓变质速度,这又说明什么?
(3)实验室制氧气时,加入催化剂目的是什么?
(4)小木屑一大木块燃烧的剧烈程度不一样,说明什么? 影响化学反应速率的外界因素浓度
催化剂颗粒大小温度哦,我知道啦!探究反应物的浓度、接触面积、反应的温度、催化剂对反应速率的影响。
药品:过氧化氢溶液(3%);二氧化锰固体;盐酸(0.5mol/L、3 mol/L);碳酸钙(块状、粉末);表面积大致相同的铁片、镁条;0.1 mol/L的硫代硫酸钠和0.1 mol/L的硫酸;热水;冷水。
仪器:试管、药匙、镊子、胶头滴管、试管夹、烧杯、酒精灯。影响化学反应速率的因素(外因)实验探究二:取a、b两支试管,分别加入5mL 0.5mol/L盐酸和5mL 3mol/L盐酸 ,再各加入表面积大致相同的铁片 ,观察实验现象。
实验探究三:取a、b两支试管,分别加入5mL 0.1mol/L硫代硫酸钠和0.1mol/L的硫酸溶液(1:1)的混和液,一支插入冷水另一支插入热水中,观察实验现象。
实验探究四:取a、b两支试管,在试管a内加入2g块状碳酸钙 ,在试管 b 中加入2g碳酸钙粉末 ,然后分别加入0.5mol/L盐酸 10mL,观察实验现象。
实验探究五:取两个试管,各加入3mL3%的过氧化氢溶液,在其中一个试管中加入少量的二氧化锰粉末,观察实验现象。 《影响化学反应速率的外因》 实验探究影响化学反应速率的外界因素当其它条件不变时得出结论:
浓
度温
度
催化剂增大反应物浓度增大减小反应物浓度 减小升高反应温度增大降低反应温度减小固体颗 粒大小增大固体颗粒减小固体颗粒加入催化剂减小 增大增大/减小总结本节课的主要知识点,联系实际谈谈控制反应速率在
生活生产中的意义。
1、化学反应快慢的表示方法——化学反应速率
v=△c/△t mol /(L · min)或 mol /(L · s)
2、影响化学反应速率的因素
①内因:反应的物质的性质(决定性因素)
②外因:反应物的颗粒大小、浓度、温度,催化剂
以及超声波、压强(针对气体的反应)等。
?应用:
1、一定条件下,在
CaCO3(块状)+2HCl=CaCl2+H2O+CO2?
反应中,为了加快反应的速率,下列方法可行的是:
A、增加盐酸的浓度 B、加水
C、增加同浓度盐酸的量 D、降低反应温度
【讨论】结合本节课的知识讨论采用哪些方法可以增大Fe与盐酸反应的化学反应速率?
作业:课后练习 1 谢谢!
海南乐东县冲坡中学 杨君兰化学反应的快慢一、化学反应速率——描述化学反应的快慢 1.概 念:单位时间内反应物或生成物浓度
的变化量来表示的物理量。
2.定义式:v = △ c/ △t
3.单位mol /(L · min)或 mol /(L · s)练 习1.对于反应Fe+2HCl=FeCl2+H2,2s内FeCl2的
物质的量浓度由2mol/L变为4mol/L,试用
FeCl2的物质的量浓度的变化来描述此反应的
快慢。
解:
v = △ c/ △t =( 4mol/L-2mol/L)/2s
= 2 mol /(L · s)2. 反应H2+Cl2=2HCl,在2L的容器内发生,
3秒内H2的物质的量由5mol变为2mol,试用
H2的物质的量浓度变化来描述此反应的快慢。
解:
△ c =( 5mol - 2mol)/2L=1.5mol/L
v = △ c/ △t=1.5mol/L/2s =2 mol /(L · s)不同化学反应
的速率反应物本身性质
(内因)同一化学反应
的速率外界条件
(外因)?二、影响化学反应速率的因素实验探究一:取两个试管分别加入5mL 3mol/L的盐酸,再分别加入长短、厚薄大致相同的镁条、铁片,观察实验现象。影响化学反应速率的因素(外因)(1)硫在纯氧气中和在空气中燃烧的剧烈程度不一样,说明什么?
(2)肉类食品易变质,放在冰箱中保鲜,可以减缓变质速度,这又说明什么?
(3)实验室制氧气时,加入催化剂目的是什么?
(4)小木屑一大木块燃烧的剧烈程度不一样,说明什么? 影响化学反应速率的外界因素浓度
催化剂颗粒大小温度哦,我知道啦!探究反应物的浓度、接触面积、反应的温度、催化剂对反应速率的影响。
药品:过氧化氢溶液(3%);二氧化锰固体;盐酸(0.5mol/L、3 mol/L);碳酸钙(块状、粉末);表面积大致相同的铁片、镁条;0.1 mol/L的硫代硫酸钠和0.1 mol/L的硫酸;热水;冷水。
仪器:试管、药匙、镊子、胶头滴管、试管夹、烧杯、酒精灯。影响化学反应速率的因素(外因)实验探究二:取a、b两支试管,分别加入5mL 0.5mol/L盐酸和5mL 3mol/L盐酸 ,再各加入表面积大致相同的铁片 ,观察实验现象。
实验探究三:取a、b两支试管,分别加入5mL 0.1mol/L硫代硫酸钠和0.1mol/L的硫酸溶液(1:1)的混和液,一支插入冷水另一支插入热水中,观察实验现象。
实验探究四:取a、b两支试管,在试管a内加入2g块状碳酸钙 ,在试管 b 中加入2g碳酸钙粉末 ,然后分别加入0.5mol/L盐酸 10mL,观察实验现象。
实验探究五:取两个试管,各加入3mL3%的过氧化氢溶液,在其中一个试管中加入少量的二氧化锰粉末,观察实验现象。 《影响化学反应速率的外因》 实验探究影响化学反应速率的外界因素当其它条件不变时得出结论:
浓
度温
度
催化剂增大反应物浓度增大减小反应物浓度 减小升高反应温度增大降低反应温度减小固体颗 粒大小增大固体颗粒减小固体颗粒加入催化剂减小 增大增大/减小总结本节课的主要知识点,联系实际谈谈控制反应速率在
生活生产中的意义。
1、化学反应快慢的表示方法——化学反应速率
v=△c/△t mol /(L · min)或 mol /(L · s)
2、影响化学反应速率的因素
①内因:反应的物质的性质(决定性因素)
②外因:反应物的颗粒大小、浓度、温度,催化剂
以及超声波、压强(针对气体的反应)等。
?应用:
1、一定条件下,在
CaCO3(块状)+2HCl=CaCl2+H2O+CO2?
反应中,为了加快反应的速率,下列方法可行的是:
A、增加盐酸的浓度 B、加水
C、增加同浓度盐酸的量 D、降低反应温度
【讨论】结合本节课的知识讨论采用哪些方法可以增大Fe与盐酸反应的化学反应速率?
作业:课后练习 1 谢谢!
