金属的化学性质
图片预览








文档简介
课件29张PPT。第一节 金属的化学性质海南二中 米珊珊第一课时马踏飞燕(东汉)司母毋方鼎(商朝) 18开黄金和铱合金做的钢笔尖精致的金属饰品钠+11 2 8 1想一想:举例说明金属具有哪些性质?物理性质:
化学性质: 点燃
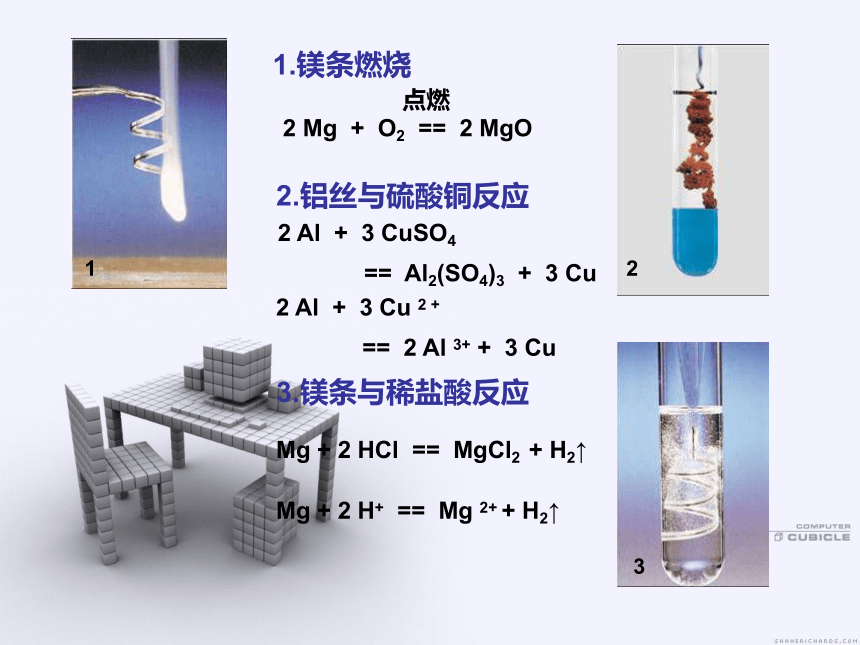
2 Mg + O2 == 2 MgO1.镁条燃烧2.铝丝与硫酸铜反应2 Al + 3 CuSO4
== Al2(SO4)3 + 3 Cu 2 Al + 3 Cu 2 +
== 2 Al 3+ + 3 Cu 1233.镁条与稀盐酸反应Mg + 2 HCl == MgCl2 + H2↑Mg + 2 H+ == Mg 2+ + H2↑[ 学生活动a ]金属钠保存在哪里?
用什么工具可以取用、切割金属钠?
钠被切开后切面什么颜色?
在空气中放置切开的钠,切面的颜色会怎样变化?请注意观察,并做好记录 结合你刚才看到的现象, 能否总结出钠的相关的物理性质?钠的密度比煤油大
有银白色金属光泽
质软,可以用小刀切割想一想:举例说明金属具有哪些性质?物理性质:
化学性质: 常温①钠与O2的反应 4 Na + O2 = 2 Na2O一、钠的化学性质1、钠与非金属的反应白色固体[ 学生活动b ]将钠在蒸发皿中加热,观察现象
钠的形状是否有变化?
火焰是什么颜色?
生成物是什么颜色? 现象:钠受热融化成闪亮小球,有白烟,火焰呈黄色,生成一种淡黄色粉末。?①钠与O2的反应 2 Na + O2 = Na2O2
淡黄色固体-1一、钠的化学性质1、钠与非金属的反应常温①钠与O2的反应 4 Na + O2 = 2 Na2O
白色固体一、钠的化学性质1、钠与非金属的反应?2 Na + O2 = Na2O2
淡黄色固体条件不同,产物不同一、钠的化学性质②钠与其他非金属的反应1、钠与非金属的反应2 Na + S = Na2S
(研磨易爆炸)
点燃
2 Na + Cl2 = 2 NaCl
(产生大量白烟)探究实验——当钠遇到水[ 实验步骤 ] 1、用镊子取一小块钠置于滤纸上,吸干表面的煤油,用小刀切绿豆大的一粒,其余放回原瓶。
2、在烧杯中加一半水,滴入1~2滴酚酞试剂,并将切下的钠粒投入烧杯中,盖上玻片,观察实验现象。钠浮在水面上;钠的密度比水小钠熔成光亮小球,有时可能有火花;钠具有银白色金属光泽,熔点较低,且反应放热钠在水面四处游动,发出嘶嘶的响声;加有酚酞的溶液变成红色。生成碱性物质使酚酞变红?[ 学生活动c ] 讨论并解释现象生成气体推动小球游动,反应剧烈且放热 从元素守恒分析 从化合价变化分析 从现象分析讨论钠与水反应的产物一、钠的化学性质
2、钠与水的反应[ 学生活动c ][ 学生活动d ] 讨论钠与水反应的产物从现象分析: 滴有酚酞试剂的溶液变红,说明有碱性物质生成[ 学生活动d ] 讨论钠与水反应的产物从元素守恒角度分析: 碱性物质中含有的阳离子由钠变价得到,因此碱性物质是NaOH2 Na + 2 H2O = 2 NaOH +
还原剂 氧化剂+10+102 e-H2↑[ 学生活动d ]
讨论钠与水反应的产物从化合价变化角度分析:钠与水反应的离子方程式:
2 Na + 2 H2O
= 2 Na+ + 2 OH- + H2 ↑怎样收集并验纯钠与水反应产生的氢气? 学 生 探 究 思考与探究:将金属钠投入到水和煤油的分层混合液中,有什么实验现象?[ 学生活动e ][ 实验结论 ]1、钠的物理性质:
2、钠与水反应:
3、钠的取用:
4、钠的保存:
5、钠的灭火:银白色金属,密度小、质地软、熔点低,延展性,良好的导电、导热性。2 Na + 2 H2O = 2 NaOH + H2↑
现象:浮、熔、游、响、红。用镊子夹取,用完的钠放回原瓶。煤油或石蜡油中。不能用水,只能用干沙盖灭。小 结一、钠的物理性质
二、钠的化学性质
1、与非金属反应:
①与氧气反应:
②与硫、氯气反应:
2、与水反应:练 习 :1、下列说法错误的是 ( )
A、钠在常温下就容易被氧化
B、钠受热后能够着火燃烧
C、钠在空气中缓慢氧化能自燃
D、钠的燃烧火焰呈黄色
2、钠与水反应时的现象与钠的下列性质无关的是 ( )
A、钠的熔点低
B、钠的密度小
C、钠的硬度小
D、有强还原性CC练 习:3、将一小块金属钠投入到足量的CuSO4溶液中,现象是 ( )
A、置换出红色的铜
B、产生气体,置换出红色的铜
C、生成蓝色沉淀
D、产生气体,生成蓝色沉淀D作业:
1、参照钠的性质预习铁、铝的有关知识。
2、写一篇关于金属的小论文,并与同学交流。谢谢指导
化学性质: 点燃
2 Mg + O2 == 2 MgO1.镁条燃烧2.铝丝与硫酸铜反应2 Al + 3 CuSO4
== Al2(SO4)3 + 3 Cu 2 Al + 3 Cu 2 +
== 2 Al 3+ + 3 Cu 1233.镁条与稀盐酸反应Mg + 2 HCl == MgCl2 + H2↑Mg + 2 H+ == Mg 2+ + H2↑[ 学生活动a ]金属钠保存在哪里?
用什么工具可以取用、切割金属钠?
钠被切开后切面什么颜色?
在空气中放置切开的钠,切面的颜色会怎样变化?请注意观察,并做好记录 结合你刚才看到的现象, 能否总结出钠的相关的物理性质?钠的密度比煤油大
有银白色金属光泽
质软,可以用小刀切割想一想:举例说明金属具有哪些性质?物理性质:
化学性质: 常温①钠与O2的反应 4 Na + O2 = 2 Na2O一、钠的化学性质1、钠与非金属的反应白色固体[ 学生活动b ]将钠在蒸发皿中加热,观察现象
钠的形状是否有变化?
火焰是什么颜色?
生成物是什么颜色? 现象:钠受热融化成闪亮小球,有白烟,火焰呈黄色,生成一种淡黄色粉末。?①钠与O2的反应 2 Na + O2 = Na2O2
淡黄色固体-1一、钠的化学性质1、钠与非金属的反应常温①钠与O2的反应 4 Na + O2 = 2 Na2O
白色固体一、钠的化学性质1、钠与非金属的反应?2 Na + O2 = Na2O2
淡黄色固体条件不同,产物不同一、钠的化学性质②钠与其他非金属的反应1、钠与非金属的反应2 Na + S = Na2S
(研磨易爆炸)
点燃
2 Na + Cl2 = 2 NaCl
(产生大量白烟)探究实验——当钠遇到水[ 实验步骤 ] 1、用镊子取一小块钠置于滤纸上,吸干表面的煤油,用小刀切绿豆大的一粒,其余放回原瓶。
2、在烧杯中加一半水,滴入1~2滴酚酞试剂,并将切下的钠粒投入烧杯中,盖上玻片,观察实验现象。钠浮在水面上;钠的密度比水小钠熔成光亮小球,有时可能有火花;钠具有银白色金属光泽,熔点较低,且反应放热钠在水面四处游动,发出嘶嘶的响声;加有酚酞的溶液变成红色。生成碱性物质使酚酞变红?[ 学生活动c ] 讨论并解释现象生成气体推动小球游动,反应剧烈且放热 从元素守恒分析 从化合价变化分析 从现象分析讨论钠与水反应的产物一、钠的化学性质
2、钠与水的反应[ 学生活动c ][ 学生活动d ] 讨论钠与水反应的产物从现象分析: 滴有酚酞试剂的溶液变红,说明有碱性物质生成[ 学生活动d ] 讨论钠与水反应的产物从元素守恒角度分析: 碱性物质中含有的阳离子由钠变价得到,因此碱性物质是NaOH2 Na + 2 H2O = 2 NaOH +
还原剂 氧化剂+10+102 e-H2↑[ 学生活动d ]
讨论钠与水反应的产物从化合价变化角度分析:钠与水反应的离子方程式:
2 Na + 2 H2O
= 2 Na+ + 2 OH- + H2 ↑怎样收集并验纯钠与水反应产生的氢气? 学 生 探 究 思考与探究:将金属钠投入到水和煤油的分层混合液中,有什么实验现象?[ 学生活动e ][ 实验结论 ]1、钠的物理性质:
2、钠与水反应:
3、钠的取用:
4、钠的保存:
5、钠的灭火:银白色金属,密度小、质地软、熔点低,延展性,良好的导电、导热性。2 Na + 2 H2O = 2 NaOH + H2↑
现象:浮、熔、游、响、红。用镊子夹取,用完的钠放回原瓶。煤油或石蜡油中。不能用水,只能用干沙盖灭。小 结一、钠的物理性质
二、钠的化学性质
1、与非金属反应:
①与氧气反应:
②与硫、氯气反应:
2、与水反应:练 习 :1、下列说法错误的是 ( )
A、钠在常温下就容易被氧化
B、钠受热后能够着火燃烧
C、钠在空气中缓慢氧化能自燃
D、钠的燃烧火焰呈黄色
2、钠与水反应时的现象与钠的下列性质无关的是 ( )
A、钠的熔点低
B、钠的密度小
C、钠的硬度小
D、有强还原性CC练 习:3、将一小块金属钠投入到足量的CuSO4溶液中,现象是 ( )
A、置换出红色的铜
B、产生气体,置换出红色的铜
C、生成蓝色沉淀
D、产生气体,生成蓝色沉淀D作业:
1、参照钠的性质预习铁、铝的有关知识。
2、写一篇关于金属的小论文,并与同学交流。谢谢指导
