2000-2007高考化学分类汇编 氮族元素(湖北省武汉市)
文档属性
| 名称 | 2000-2007高考化学分类汇编 氮族元素(湖北省武汉市) |  | |
| 格式 | zip | ||
| 文件大小 | 524.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2007-11-29 18:19:00 | ||
图片预览


文档简介
2000—2007高考试题分类汇编
二、氮族元素
一、选择题:
( B )1. (00全国2)久置于空气中的下列物质,因被氧化而呈黄色的是
A.浓硝酸 B.氧化亚铁溶液 C. 溴苯 D.溴化银
( A )2. (00全国3)下列广告用语在科学性上没有错误的是
A.这种饮料中不含任何化学物质 B.这种蒸馏水绝对纯净,其中不含任何离子
C.这种口服液含丰富的氮、磷、锌等微量元素 D.没有水就没有生命
(AB)3.(00全国7)下列块状金属在常温时能全部溶于足量浓HNO3的是
A.Ag B.Cu C.A1 D.Fe
( A )4.(05上海3)据报道,科学家已成功合成了少量N4,有关N4的说法正确的是
A.N4是N2的同素异形体 B.N4是N2的同分异构体
C.相同质量的N4和N2所含原子个数比为1:2 D.N4的摩尔质量是56g
( C )5.(00全国15)1999年曾报导合成和分离了含高能量的正离子N5+ 的化合物N5AsF6,下列叙述错误的是
A.N5+共有34个核外电子 B.N5+中氮氮原子间以共用电子对结合
C.化合物N5AsF6中As化合价为+1 D.化合物N5AsF6中F化合价为-1
( C )6.(00全国,18)下列关于实验现象的描述不正确的是
A.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡
B.用锌片做阳极,铁片做做阴极,电解氯化锌溶液,铁片表面出现一层锌
C.把铜片插入三氯化铁溶液中,在铜片表面出现一层铁
D.把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快
( C )7.(01上海,3)下列物质不属于“城市空气质量日报”报道的是
A.二氧化硫 B.氮氧化物 C.二氧化碳 D.悬浮颗粒
( B )8.(01上海15)下列实验中用错试剂的是
A.用稀盐酸清洗做焰色反应的镍铬丝 B.用酒精萃取碘水中的碘
C.用稀硝酸洗去残留在试管壁上的铜 D.用碱石灰吸收氨气中的水蒸气
( C )9.(01广东1)下列说法,违反科学原理的是
A.碘化银可用于人工降雨 B.闪电时空气中的N2可变为氮的化合物
C.添加少量某物质可将水变成燃料油 D.在一定温度、压强下石墨可变成金刚石
( C )10.(02广东1)目前我国许多城市和地区定期公布空气质量报告,在空气质量报告中,一般不涉及
A.SO2 B.NO2 C.CO2 D.可吸入颗粒物
(BC)11.(02上海22)0.03mol铜完全溶于硝酸,产生氮的氧化物NO、NO2、N2O4混合气体共0.05mol。该混合气体的平均相对分子质量可能是
A.30 B.46 C.50 D.66
( B )12.(03广东5)同温同压下,在3支相同体积的试管中分别充有等体积混合的2种气体,它们是①NO和NO2,②NO2和O2,③NH3和N2。现将3支试管均倒置于水槽中,充分反应后,试管中剩余气体的体积分别为V1、V2、V3,则下列关系正确的是
A.V1>V2>V3 B.V1>V3>V2 C.V2>V3>V1 D.V3>V1>V2
( B )13.(03广东12)对某酸性溶液(可能含有Br-,SO42-,H2SO3,NH4+)分别进行如下实验:①加热时放出的气体可以使品红溶液褪色;②加碱调至碱性后,加热时放出的气体可以使润湿的红色石蕊试纸变蓝;③加入氯水时,溶液略显黄色,再加入BaCl2溶液时,产生的白色沉淀不溶于稀硝酸。对于下列物质不能确认其在溶液中是否存在的是
A.Br- B.SO42- C.H2SO3 D.NH4+
( D )14.(03上海15)在NH3、HNO3、H2SO4的工业生产中,具有的共同点是
A.使用吸收塔设备 B.使用尾气吸收装置 C.使用H2作原料 D.使用催化剂
—1—
二、填空题:
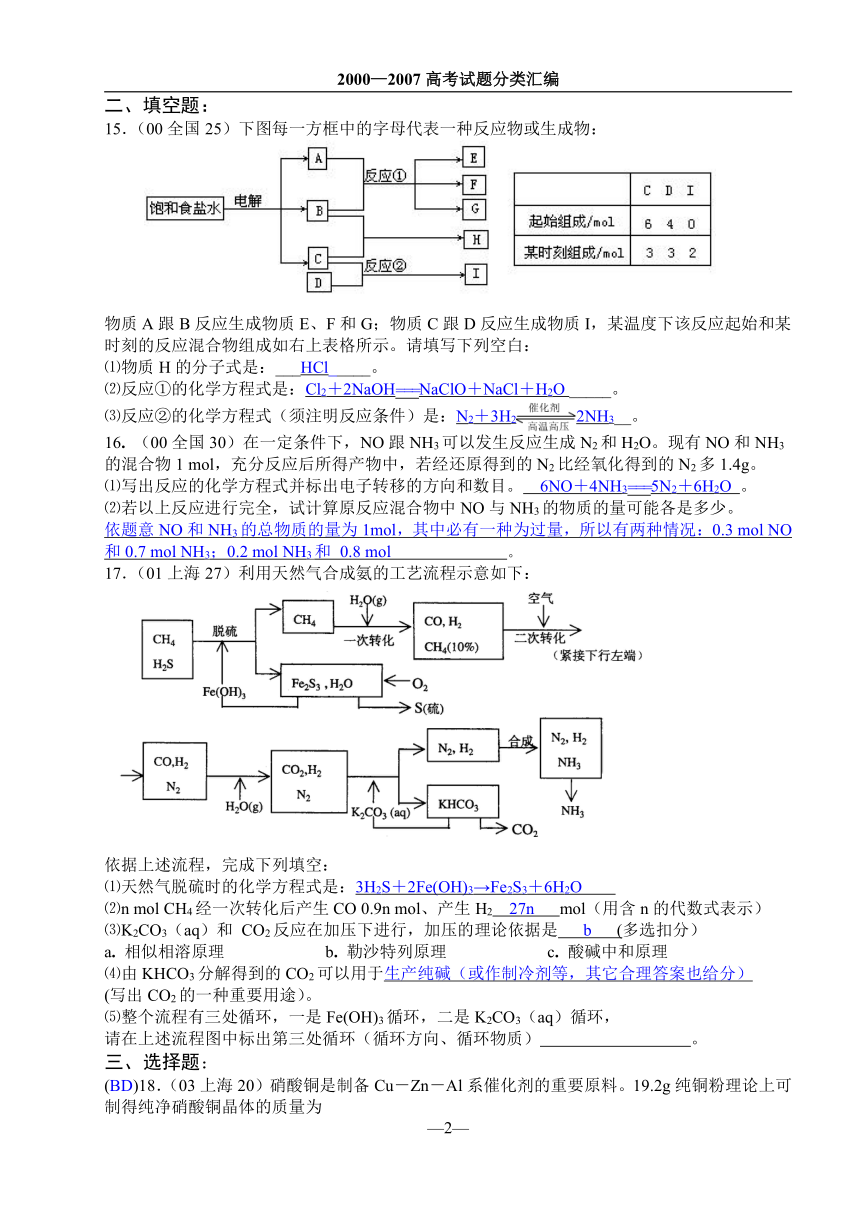
15.(00全国25)下图每一方框中的字母代表一种反应物或生成物:
物质A跟B反应生成物质E、F和G;物质C跟D反应生成物质I,某温度下该反应起始和某时刻的反应混合物组成如右上表格所示。请填写下列空白:
⑴物质H的分子式是:___HCl_____。
⑵反应①的化学方程式是:Cl2+2NaOH===NaClO+NaCl+H2O _____。
⑶反应②的化学方程式(须注明反应条件)是:N2+3H22NH3__。
16. (00全国30)在一定条件下,NO跟NH3可以发生反应生成N2和H2O。现有NO和NH3的混合物1 mol,充分反应后所得产物中,若经还原得到的N2比经氧化得到的N2多1.4g。
⑴写出反应的化学方程式并标出电子转移的方向和数目。 6NO+4NH3===5N2+6H2O 。
⑵若以上反应进行完全,试计算原反应混合物中NO与NH3的物质的量可能各是多少。
依题意NO和NH3的总物质的量为1mol,其中必有一种为过量,所以有两种情况:0.3 mol NO和0.7 mol NH3;0.2 mol NH3和 0.8 mol 。
17.(01上海27)利用天然气合成氨的工艺流程示意如下:
依据上述流程,完成下列填空:
⑴天然气脱硫时的化学方程式是:3H2S+2Fe(OH)3→Fe2S3+6H2O
⑵n mol CH4经一次转化后产生CO 0.9n mol、产生H2 27n mol(用含n的代数式表示)
⑶K2CO3(aq)和 CO2反应在加压下进行,加压的理论依据是 b (多选扣分)
a. 相似相溶原理 b. 勒沙特列原理 c. 酸碱中和原理
⑷由KHCO3分解得到的CO2可以用于生产纯碱(或作制冷剂等,其它合理答案也给分)
(写出CO2的一种重要用途)。
⑸整个流程有三处循环,一是Fe(OH)3循环,二是K2CO3(aq)循环,
请在上述流程图中标出第三处循环(循环方向、循环物质) 。
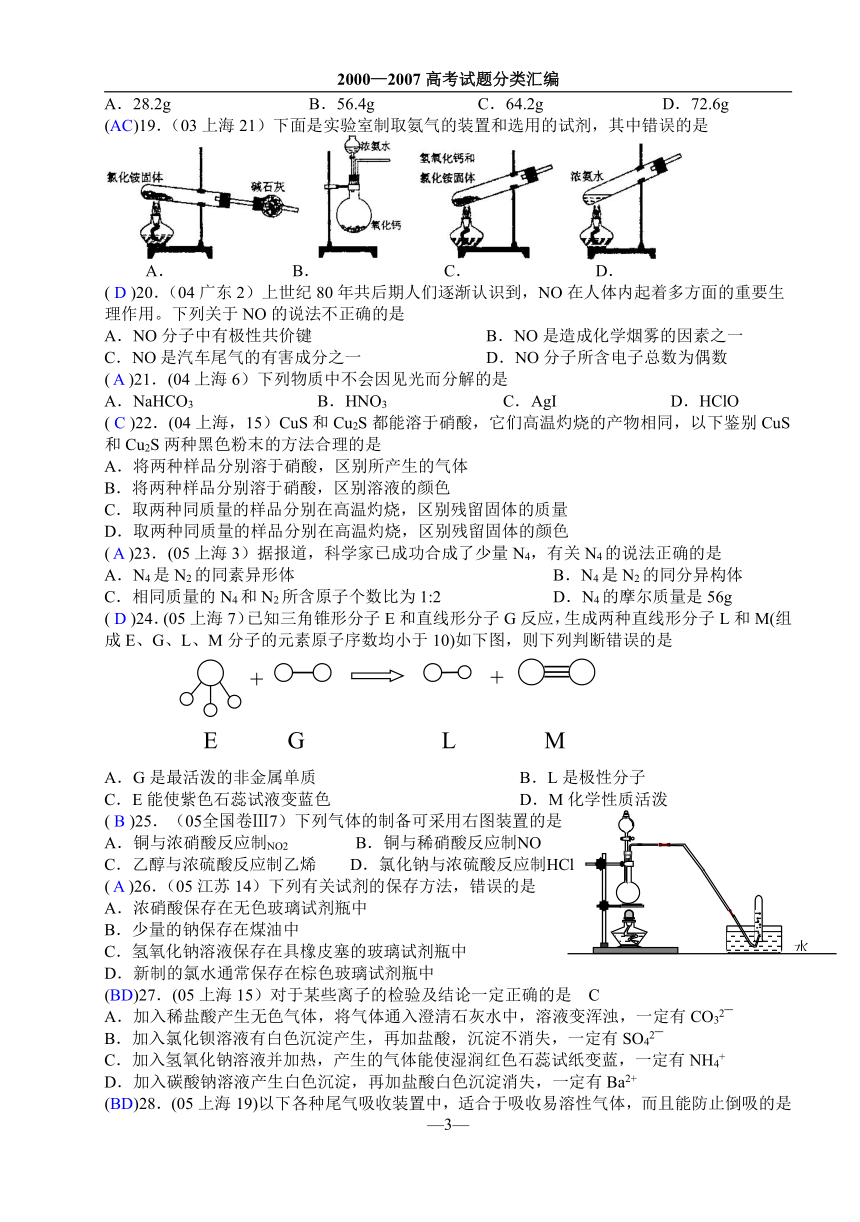
三、选择题:
(BD)18.(03上海20)硝酸铜是制备Cu-Zn-Al系催化剂的重要原料。19.2g纯铜粉理论上可制得纯净硝酸铜晶体的质量为
—2—
A.28.2g B.56.4g C.64.2g D.72.6g
(AC)19.(03上海21)下面是实验室制取氨气的装置和选用的试剂,其中错误的是
A. B. C. D.
( D )20.(04广东2)上世纪80年共后期人们逐渐认识到,NO在人体内起着多方面的重要生理作用。下列关于NO的说法不正确的是
A.NO分子中有极性共价键 B.NO是造成化学烟雾的因素之一
C.NO是汽车尾气的有害成分之一 D.NO分子所含电子总数为偶数
( A )21.(04上海6)下列物质中不会因见光而分解的是
A.NaHCO3 B.HNO3 C.AgI D.HClO
( C )22.(04上海,15)CuS和Cu2S都能溶于硝酸,它们高温灼烧的产物相同,以下鉴别CuS和Cu2S两种黑色粉末的方法合理的是
A.将两种样品分别溶于硝酸,区别所产生的气体
B.将两种样品分别溶于硝酸,区别溶液的颜色
C.取两种同质量的样品分别在高温灼烧,区别残留固体的质量
D.取两种同质量的样品分别在高温灼烧,区别残留固体的颜色
( A )23.(05上海3)据报道,科学家已成功合成了少量N4,有关N4的说法正确的是
A.N4是N2的同素异形体 B.N4是N2的同分异构体
C.相同质量的N4和N2所含原子个数比为1:2 D.N4的摩尔质量是56g
( D )24.(05上海7)已知三角锥形分子E和直线形分子G反应,生成两种直线形分子L和M(组成E、G、L、M分子的元素原子序数均小于10)如下图,则下列判断错误的是
A.G是最活泼的非金属单质 B.L是极性分子
C.E能使紫色石蕊试液变蓝色 D.M化学性质活泼
( B )25.(05全国卷Ⅲ7)下列气体的制备可采用右图装置的是
A.铜与浓硝酸反应制NO2 B.铜与稀硝酸反应制NO
C.乙醇与浓硫酸反应制乙烯 D.氯化钠与浓硫酸反应制HCl
( A )26.(05江苏14)下列有关试剂的保存方法,错误的是
A.浓硝酸保存在无色玻璃试剂瓶中
B.少量的钠保存在煤油中
C.氢氧化钠溶液保存在具橡皮塞的玻璃试剂瓶中
D.新制的氯水通常保存在棕色玻璃试剂瓶中
(BD)27.(05上海15)对于某些离子的检验及结论一定正确的是 C
A.加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32
B.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42
C.加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+
D.加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+
(BD)28.(05上海19)以下各种尾气吸收装置中,适合于吸收易溶性气体,而且能防止倒吸的是
—3—
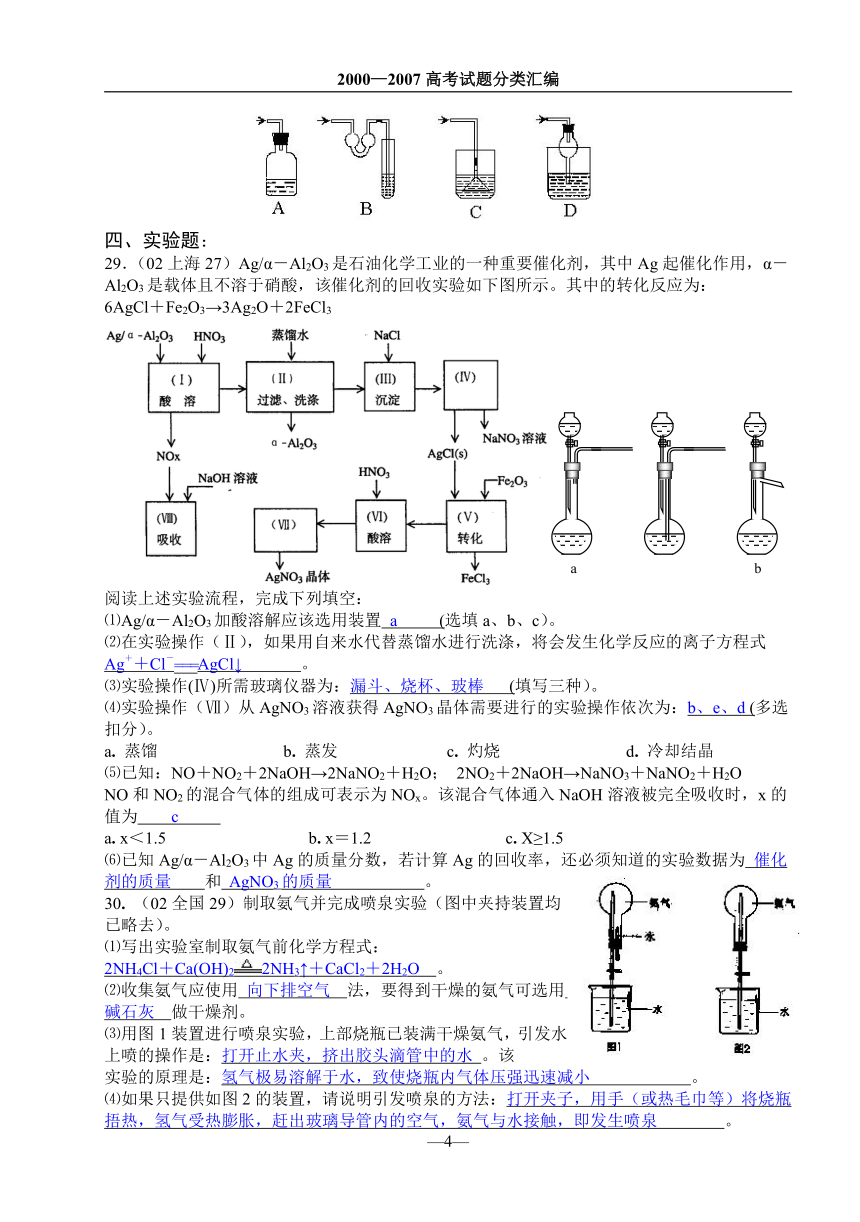
四、实验题:
29.(02上海27)Ag/α-Al2O3是石油化学工业的一种重要催化剂,其中Ag起催化作用,α-Al2O3是载体且不溶于硝酸,该催化剂的回收实验如下图所示。其中的转化反应为:
6AgCl+Fe2O3→3Ag2O+2FeCl3
阅读上述实验流程,完成下列填空:
⑴Ag/α-Al2O3加酸溶解应该选用装置 a (选填a、b、c)。
⑵在实验操作(Ⅱ),如果用自来水代替蒸馏水进行洗涤,将会发生化学反应的离子方程式
Ag++Cl-===AgCl↓ 。
⑶实验操作(Ⅳ)所需玻璃仪器为:漏斗、烧杯、玻棒 (填写三种)。
⑷实验操作(Ⅶ)从AgNO3溶液获得AgNO3晶体需要进行的实验操作依次为:b、e、d (多选扣分)。
a. 蒸馏 b. 蒸发 c. 灼烧 d. 冷却结晶
⑸已知:NO+NO2+2NaOH→2NaNO2+H2O; 2NO2+2NaOH→NaNO3+NaNO2+H2O
NO和NO2的混合气体的组成可表示为NOx。该混合气体通入NaOH溶液被完全吸收时,x的值为 c
a. x<1.5 b. x=1.2 c. X≥1.5
⑹已知Ag/α-Al2O3中Ag的质量分数,若计算Ag的回收率,还必须知道的实验数据为 催化剂的质量 和 AgNO3的质量 。
30. (02全国29)制取氨气并完成喷泉实验(图中夹持装置均已略去)。
⑴写出实验室制取氨气前化学方程式:
2NH4Cl+Ca(OH)22NH3↑+CaCl2+2H2O 。
⑵收集氨气应使用 向下排空气 法,要得到干燥的氨气可选用 碱石灰 做干燥剂。
⑶用图1装置进行喷泉实验,上部烧瓶已装满干燥氨气,引发水上喷的操作是:打开止水夹,挤出胶头滴管中的水 。该
实验的原理是:氢气极易溶解于水,致使烧瓶内气体压强迅速减小 。
⑷如果只提供如图2的装置,请说明引发喷泉的方法:打开夹子,用手(或热毛巾等)将烧瓶捂热,氢气受热膨胀,赶出玻璃导管内的空气,氨气与水接触,即发生喷泉 。
—4—
31.(04广东19)用仪器A、B和胶管组成装置收集NO气体(①仪器A已经气密性检查;②除水外不能选用其他试剂)。
在A中加满水,盖紧瓶塞,用胶管连接b和c接口,由a导入NO气体,水通过b和c排入B中 。
五、选择题:
( C )32.(05全国卷Ⅱ13)等质量的CuO和MgO粉末分别溶于相同体积的硝酸中,得到的Cu(NO3)2和Mg(NO3)2溶液的浓度分别为amol·L-1和bmol· L-1。则a与b的关系为
A.a=b B.a=2b C.2a=b D.a=5b
( A )33.(05江苏17)Cu2S与一定浓度的HNO3反应,生成Cu(NO3)2、CuSO4、NO2、NO和H2O,当NO2和NO的物质的量之比为1∶1时,实际参加反应的Cu2S与HNO3的物质的量之比为
A.1∶7 B.1∶9 C.1∶5 D.2∶9
( A )34.(02全国13)化合价为n的某元素的硝酸盐的式量为x,其氢氧化物的式量为y,则n的值是
A.(x-y)/45 B.(y-x)/45 C.(x-y)/79 D.(y-x)/79
( D )35.(07年上海卷,10)将空气中氮气转化为氮的化合物的过程称为固氮。下面能实现人工固氮的是
A.闪电 B.电解饱和食盐水车间 C.根瘤 D.合成氨车间
( C )36.(07年江苏3)三聚氰酸[C3N3(OH)3]可用于消除汽车尾气中的NO2。其反应原理为:
C3N3(OH)33HNCO;8HNCO+6NO27N2+8CO2+4H2O 下列说法正确的是A.C3N3(OH)3与HNCO为同一物质 B.HNCO是一种很强的氧化剂
C.1 mol NO2在反应中转移的电子为4 mol D.反应中NO2是还原剂
(AD)37.(07年江苏16)某合金(仅含铜、铁)中铜和铁的物质的量之和为y mol,其中Cu的物质的量分数为a,将其全部投入50 mL b mol·L-1的硝酸溶液中,加热使其充分反应(假设NO是唯一的还原产物)。下列说法正确的是
A.若金属有剩余,在溶液中再滴入硫酸后,金属又开始溶解
B.若金属全部溶解,则溶液中一定含有Fe3+
C.若金属全部溶解,且产生336 mL气体(标准状况),则b = 0.3
D.当溶液中金属离子只有Fe3+、Cu2+时,则a与b的关系为:b≥80y(1-a/3)
( A )38.(07年四川10)足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与1.68 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5 mol/L NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是
A.60 mL B.45 mL C.30 mL D.15 mL
六、推断题:
39.(04江苏19)请按要求填空:
⑴用已准确称量的1.06gNa2CO3固体配制0.100mol·L-1Na2CO3溶液100mL,所需要的仪器为:100mL容量瓶 烧杯 量筒 玻璃棒 胶头滴管 。
⑵除去NaNO3固体中混有的少量KNO3,所进行的实验操作依次为:溶解 、蒸发、结晶、过滤 。
⑶除去KCl溶液中的SO42-离子,依次加入的溶液为(填溶质的化学式):aCl2[或Ba(OH)2]、K2CO3、HCl 。
40.(02广东19)如右图所示已知:
①甲、乙、丙、丁均为前三周期元素的单质。
②在一定条件下甲与丙和甲与丁都按物质的量之比l:3反应,分别生成X和Y,在产物中元素甲呈负价。
—5—
③在一定条件下乙与丙和乙与丁都按物质的量之比1:2反应,分别生成Z和W,在产物中元素乙呈负价。 请填空:
⑴甲是__氮 ,乙是__ 氧 __。
⑵甲与丙反应生成X的化学方程式是:N2+3H22NH3 。
⑶乙与丁反应生成W的化学方程式是:O2+2Mg2MgO_。
41.(04江苏,21)下图中,A是一种无色液体,G是极易溶于水的碱性气体,Y是胃酸的主要成分,K是不溶于稀硝酸的白色沉淀,反应⑤是工业制X的主要反应之一。
请按要求填空:
⑴写出下列物质的化学式:A:H2O ,
E:N2 ;F:Ag ,Y:HCl 。
⑵反应⑤的化学方程式为:
4NH3+5O2 4NO+6H2O 。
⑶1molB通过反应②得到1molF,B中F的质量分数为72%,则B的化学式为: AgN3 。
42.(04北京,28)资料显示:“氨气可在纯氧中安静燃烧……”。某校化学小组学生设计如下装置(图中铁夹等夹持装置已略去)进行氨气与氧气在不同条件下反应的实验。
⑴用装置A制取纯净、干燥的氨气,大试管内碳酸盐的化学式是: (NH4)2CO3[或NH4HCO 3];碱石灰的作用是:吸收水和二氧化碳 。
⑵将产生的氨气与过量的氧气通到装置B(催化剂为铂石棉)中,用酒精喷灯加热:
① 氨催化氧化的化学方程式是:4NH3+5O24NO+6H2O ;试管内气体变为红棕色,该反应的化学方程式是:2NO+O2===2NO2 ;
② 停止反应后,立即关闭B中两个活塞。一段时间后,将试管浸入冰水中,试管内气体颜色变浅,请结合化学方程式说明原因:2NO 2(g) N2O4(g)+热量,降低温度使平衡正向移动,部分红棕色NO2转化为无色N2O4 。
⑶将过量的氧气与A产生的氨气分别从a、b两管进气口通入到装置C中,并在b管上端点燃氨气:
① 两气体通入的先后顺序是先通入O2,后通入NH3 。其理由是:若先通氨气,氨在空气中不能点燃,逸出造成污染 。
② 氨气燃烧的化学方程式是:4NH3+3O22N2+6H2O 。
43.(04北京29)有三种不同质量比的氧化铜与炭粉的混合物样品①、②、③。甲、乙、丙三同学各取一种样品,加强热充分反应,测定各样品中氧化铜的量。
⑴甲取样品①强热,叵所得固体为金属铜,将其置于足量的稀硝酸中微热,产生1.12 L气体标准状况,则样品①中氧化铜的质量为:6.0 g.;
⑵乙取样品② a g强热,生成的气体不能使澄清的石灰水变浑浊。再将反应后的固体与足量的稀硝酸微热,充分反应后,有b g固体剩余,该剩余固体的化学式为 C 。样品②中氧化铜质量为 [20(a-b)]/23 g(以含a、b的代数式表示)
⑶丙称量样品③强热后剩余的固体,质量比原样品减小了c g,若该固体为金属铜,则样品③中氧化铜物质的量(n)的取值范围为 c/28mol≤n≤ c/22 mol 。
—6—
44.(04天津28)I. 合成氨工业对化学的国防工业具有重要意义。写出氨的两种重要用途:制化肥、制硝酸 。
II. 实验室制备氨气,下列方法中适宜选用的是 ②④ 。
① 固态氯化铵加热分解 ② 固体氢氧化钠中滴加浓氨水
③ 氯化铵溶液与氢氧化钠溶液共热 ④ 固态氯化铵与氢氧化钙混合加热
III. 为了在实验室利用工业原料制备少量氨气,有人设计了如下装置(图中夹持装置均已略去)。
[实验操作]
① 检查实验装置的气密性后,关闭弹簧夹a、b、c、d、e。在A中加入锌粒,向长颈漏斗注入一定量稀硫酸。打开弹簧夹c、d、e,则A中有氢气发生。在F出口处收集氢气并检验其纯度。
② 关闭弹簧夹c,取下截去底部的细口瓶C,打开弹簧夹a,将氢气经导管B验纯后点燃,然后立即罩上无底细口瓶C,塞紧瓶塞,如图所示。氢气继续在瓶内燃烧,几分钟后火焰熄灭。
③ 用酒精灯加热反应管E,继续通氢气,待无底细口瓶C内水位下降到液面保持不变时,打开弹簧夹b,无底细口瓶C内气体经D进入反应管E,片刻后F中的溶液变红。
回答下列问题:
⑴检验氢气纯度的目的是:排除空气,保证安全 。
⑵C瓶内水位下降到液面保持不变时,A装置内发生的现象是 锌粒与酸脱离 ,防止了实验装置中压强过大。此时再打开弹簧夹b的原因是:尽量增大氢气的浓度以提高氮气的转化率 ,C瓶内气体的成份是:N2;H2 。
⑶在步骤③中,先加热铁触媒的原因是:铁触媒在较高温度时活性增大,加快氨合成的反应速率 。反应管E中发生反应的化学方程式是:N2+3H22NH3 。
45.(04天津29)将32.64 g铜与140 mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2 L。请回答:
⑴NO的体积为 5.8 L,NO2的体积为 5.4 L。
⑵待产生的气体全部释放后,向溶液加入V mL a mol / L的NaOH溶液,恰好使溶液中的Cu2+ 全部转化成沉淀,则原硝酸溶液的浓度为: (aV×10-3+0.5)/0.14 mol / L。
⑶欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要30%的双氧水57.8 g。
46.(05全国卷I26)已知A、B、C、D为气体,E、F为固体,G是氯化钙,它们之间的转换关系如右图所示:
⑴ D的化学式(分子式)是:NH3 ,
E的化学式(分子式)是:NH4Cl 。
⑵ A和B反应生成C的化学方程式是:
H2+Cl22HCl ___ _。
⑶ E和F反应生成D、H和G的化学方程式是:Ca(OH)2+2NH4ClCaCl2+2NH3↑+2H2O_。
—7—
47.(05江苏29)某同学拟用氯化钙固体、碳酸钠溶液和稀硝酸等试剂,先制得碳酸钙,最终制得纯净的硝酸钙晶体。
⑴写出制取过程中反应的离子方程式:
Ca2++CO32-=CaCO3↓ 、 CaCO3+2H+==Ca2++CO2↑+H2O 。
⑵请帮助该同学完成下列实验操作步骤(不要求回答使用的仪器)
①用蒸馏水完全溶解CaCl2后,加入碳酸钠溶液 。
②将反应后的混合物过滤,并用适量蒸馏水洗涤沉淀至无Cl-。
③加入 稀硝酸 ,使沉淀完全溶解。
④蒸发 结晶 ,得到纯净的硝酸钙晶体。
48.(05天津29)磷在氧气中燃烧,可能生成两种固态氧化物。3.1g的单质磷(P)在3.2g的氧气中燃烧,至反应物耗尽,并放出X KJ热量。
⑴ 通过计算确定反应产物的组成(用化学式表示)是P2O3 P2O5 _,其相应的质量(g)为m(P2O3) =2.75g m(P2O5)=3.55g 。
⑵ 已知单质磷的燃烧热为Y KJ/mol,则1mol P与O2反应生成固态P2O5 的反应热△H ===
-(20X-Y) KJ/mol 。
⑶ 写出1mol P与O2反应生成固态P2O3 的热化学反应方程式:
P(s) + 3/4O2(g) == 1/2 P2O3(s);△H = -(20X-Y) KJ/mol__。
49.(06江苏21)稀薄燃烧是指汽油在较大空/燃比(空气与燃油气的体积比)条件下的燃烧。随着全球能源危机的加剧,稀薄燃烧技术的
研究受到了人们的重视,但稀薄燃烧时,常
用的汽车尾气净化装置不能有效地将NOx转
化为N2。不同空/燃比时汽车尾气中主要污染
物的含量变化如右图所示。
⑴稀薄燃烧技术除能节约能源外,还具有的
优点是:减少CO和碳氢化合物的污染;
(填一项)。排放到大气中的NOx会导致酸雨、
光化学烟雾或破坏臭氧层 等环境问题(填一项)。
⑵某校化学研究性学习小组的同学在技术人员的指导下,
按下列流程探究不同催化剂对NH3还原NO反应的催化性能。若控制其他实验条件相同,在催化反应器中装载不同的催化剂,将经催化反应后的混合气体通入滴有酚酞的稀硫酸溶液(溶液的体积、浓度均相同)。为比较不同催化剂的催化性能,需要测量并记录的数据是:溶液显色所需要的时间 。
⑶若某一催化剂能同时催化NH3等还原性气体与NOx的反应。将该催化剂分别用于催化还原等物质的量NOx的两种气体:①纯NO气体,②汽车尾气。消耗NH3的物质的量较多的可能是 A (填字母),原因是汽车尾气中含有一定量的CO和碳氢化合物,少消耗NH3 或B 汽车尾气中含有一定量的 NO2,多消耗NH3或C 汽车尾气中同时含有CO、碳氢化合物等还原性气体和NO2等氧化性气体,二者相对含量的不同可导致消耗NH3的增多或减少 。
A.① B.② C.都有可能
50.(07年江苏20)(10分)图中各物质均由常见元素(原子序数≤20)组成。已知A、B、K为单质,且在常温下A和K为气体,B为固体。D为常见的无色液体。I是一种常用的化肥,在其水溶液中滴加AgNO3溶液有不溶于稀HNO3的白色沉淀产生。J是一种实验室常用的干燥剂。它们的相互转化关系如图所示(图中反应条件未列出)。请回答下列问题:
⑴I的化学式为_NH4Cl __;J的电子式为______ 。
⑵反应①的化学方程式为:Ca3N2+6H2O = 3Ca(OH)2+2NH3↑ _。
—8—
⑶F的水溶液与氯气反应的离子方程式为:2OH-+Cl2 = Cl-+ClO-+H2O _。
51.(A) (07年上海26)实验室模拟合成氨和氨催化氧化的流程如下:
已知实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气。
⑴从图中选择制取气体的合适装置:氮气 a 、氢气 b 。
⑵氮气和氢气通过甲装置,甲装置的作用除了将气体混合外,还有干燥气体 、 控制氢气和氮气的流速(合理即给分) 。
⑶氨合成器出来经冷却的气体连续通入乙装置的水中吸收氨,不会 (“会”或“不会”)发生倒吸,原因是:因为混合气体中含有大量难溶于水的氮、氢两种气体 。
⑷用乙装置吸收一段时间氨后,再通入空气,同时将经加热的铂丝插入乙装置的锥形瓶内,能使铂丝保持红热的原因是:说明氨的氧化反应是一个放热反应 ,锥形瓶中还可观察到的现象是:有红棕色气体产生(合理即给分 。
⑸写出乙装置中氨氧化的化学方程式:_4NH3十5O24NO+6H2O __。
⑹反应结束后锥形瓶内的溶液中含有H+、OH-、NH4+ 、 NO3- 离子。
52.(07年四川27)(15分)下图是无机物A~M在一定条件下的转化关系(部分产物及反应条件未列出)。其中,I是由第三周期元素组成的单质中熔点最高的金属,K是一种红棕色气体。
请填写下列空白:
⑴在周期表中,组成单质G的元素位于第_四(或4)___周期第_Ⅷ__族。
⑵在反应⑦中氧化剂与还原剂的物质的量之比为_1:2______。
⑶在反应②、③、⑥、⑨中,既属于化合反应又能属于非氧化还原反应的是__③___(填写序号)。
⑷反应④的离子方程式是:3Fe2++NO3- +4H+ = 3Fe3++NO↑+2H2O___。
—9—
⑸将化合物D与KNO3、KOH共融,可制得一种“绿色”环保高效净水剂K2FeO4(高铁酸钾),同时还生成KNO2和H2O。该反应的化学方程式是:
Fe2O3+3KNO3+4KOH2K2FeO4+3KNO2+2H2O 。
53.(07年重庆27)(16分)某兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化。
方案 反应物
甲 Cu、浓HNO3
乙 Cu、稀HNO3
丙 Cu、O2、稀HNO3
(1)实验前,关闭活塞b,试管d中加水至浸没长导管口,塞紧试管c和d的胶塞,加热c,其目的是:检查装置气密性 。
⑵在d中加适量NaOH溶液,c中放一小块铜片,由分液漏斗a向c中加入2 mL浓硝酸,c中反应的化学方程式是Cu+4HNO3(浓) = Cu(NO3)2+2NO2↑+2H2O _。再由a向c中加2 mL蒸馏水,c中的实验现象是:反应变缓,气体颜色变淡 。
⑶上表是制取硝酸铜的三种方案,能体现绿色化学理念的最佳方案是 丙 ,理由是耗酸量最少,无污染 。
⑷该小组还用上述装置进行实验证明氧化性KMnO4>Cl2>Br2,操作步骤为_向d中加入KBr溶液,c中加入固体KMnO4,由a向c中加入浓盐酸_,实验现象为_c中有黄绿色气体产生,d中溶液变为黄棕色 ;但此实验的不足之处是没有处理尾气 。
54. (03北京春季理综26)为了检验Pb(NO3)2热分解的产物,有人用示意图中的装置进行实验。(图中铁架台、铁夹和加热设备均略去)实验时在试管中放入研细的Pb(NO3)2晶体;实验结束后,试管中得到黄色粉末(PbO),U型管下部有少量液体X,集气瓶中收集到无色气体Y。(如图) 回答下面问题:
⑴在装置中试管和U型管上的橡皮塞最好用锡箔包住,用橡皮管连接的两玻璃管口要相互紧靠,原因是:NO2气体会损坏橡胶 。
⑵液体X可能是N2O4(答液态的NO2同样给分) ;气体Y可能是 O2 。
⑶导管口不再有气泡冒出时,停止反应,这时在操作上应注意先把导气管移出水面,然后熄灭火焰 ,理由是:防止水槽中的水反吸到U型管中 。
⑷用简单的实验证实⑵中的判断:
①对X的判断:在通风橱中取下U型管放置,观察到U型管中液体迅速消失,管中充满红棕色气体,证明X是液态N2O4。(其他合理答案同样给分)。
②对Y的判断(要求:怎样从水槽中取出集气瓶、实验方法、现象、结论):在水槽,用玻璃片盖住集气瓶口,按住玻璃片,小心把集气瓶移出水面,正放在桌上,用带火星的木条插入瓶口,木条迅速燃烧,证明Y是O2 。
—10—
E
+
+
G
L
M
水
a b c
C
A
B
空/燃比
A:NOx
B:CO
C:碳氢化合物
13 14 15 16 17 18
污染物的含量
NO、NH3
混合气体
催化反应器
检测
尾气处理
a
b
c
N2
H2
原料气
浓硫酸
甲
铂
乙
a
b
c
d
PAGE
二、氮族元素
一、选择题:
( B )1. (00全国2)久置于空气中的下列物质,因被氧化而呈黄色的是
A.浓硝酸 B.氧化亚铁溶液 C. 溴苯 D.溴化银
( A )2. (00全国3)下列广告用语在科学性上没有错误的是
A.这种饮料中不含任何化学物质 B.这种蒸馏水绝对纯净,其中不含任何离子
C.这种口服液含丰富的氮、磷、锌等微量元素 D.没有水就没有生命
(AB)3.(00全国7)下列块状金属在常温时能全部溶于足量浓HNO3的是
A.Ag B.Cu C.A1 D.Fe
( A )4.(05上海3)据报道,科学家已成功合成了少量N4,有关N4的说法正确的是
A.N4是N2的同素异形体 B.N4是N2的同分异构体
C.相同质量的N4和N2所含原子个数比为1:2 D.N4的摩尔质量是56g
( C )5.(00全国15)1999年曾报导合成和分离了含高能量的正离子N5+ 的化合物N5AsF6,下列叙述错误的是
A.N5+共有34个核外电子 B.N5+中氮氮原子间以共用电子对结合
C.化合物N5AsF6中As化合价为+1 D.化合物N5AsF6中F化合价为-1
( C )6.(00全国,18)下列关于实验现象的描述不正确的是
A.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡
B.用锌片做阳极,铁片做做阴极,电解氯化锌溶液,铁片表面出现一层锌
C.把铜片插入三氯化铁溶液中,在铜片表面出现一层铁
D.把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快
( C )7.(01上海,3)下列物质不属于“城市空气质量日报”报道的是
A.二氧化硫 B.氮氧化物 C.二氧化碳 D.悬浮颗粒
( B )8.(01上海15)下列实验中用错试剂的是
A.用稀盐酸清洗做焰色反应的镍铬丝 B.用酒精萃取碘水中的碘
C.用稀硝酸洗去残留在试管壁上的铜 D.用碱石灰吸收氨气中的水蒸气
( C )9.(01广东1)下列说法,违反科学原理的是
A.碘化银可用于人工降雨 B.闪电时空气中的N2可变为氮的化合物
C.添加少量某物质可将水变成燃料油 D.在一定温度、压强下石墨可变成金刚石
( C )10.(02广东1)目前我国许多城市和地区定期公布空气质量报告,在空气质量报告中,一般不涉及
A.SO2 B.NO2 C.CO2 D.可吸入颗粒物
(BC)11.(02上海22)0.03mol铜完全溶于硝酸,产生氮的氧化物NO、NO2、N2O4混合气体共0.05mol。该混合气体的平均相对分子质量可能是
A.30 B.46 C.50 D.66
( B )12.(03广东5)同温同压下,在3支相同体积的试管中分别充有等体积混合的2种气体,它们是①NO和NO2,②NO2和O2,③NH3和N2。现将3支试管均倒置于水槽中,充分反应后,试管中剩余气体的体积分别为V1、V2、V3,则下列关系正确的是
A.V1>V2>V3 B.V1>V3>V2 C.V2>V3>V1 D.V3>V1>V2
( B )13.(03广东12)对某酸性溶液(可能含有Br-,SO42-,H2SO3,NH4+)分别进行如下实验:①加热时放出的气体可以使品红溶液褪色;②加碱调至碱性后,加热时放出的气体可以使润湿的红色石蕊试纸变蓝;③加入氯水时,溶液略显黄色,再加入BaCl2溶液时,产生的白色沉淀不溶于稀硝酸。对于下列物质不能确认其在溶液中是否存在的是
A.Br- B.SO42- C.H2SO3 D.NH4+
( D )14.(03上海15)在NH3、HNO3、H2SO4的工业生产中,具有的共同点是
A.使用吸收塔设备 B.使用尾气吸收装置 C.使用H2作原料 D.使用催化剂
—1—
二、填空题:
15.(00全国25)下图每一方框中的字母代表一种反应物或生成物:
物质A跟B反应生成物质E、F和G;物质C跟D反应生成物质I,某温度下该反应起始和某时刻的反应混合物组成如右上表格所示。请填写下列空白:
⑴物质H的分子式是:___HCl_____。
⑵反应①的化学方程式是:Cl2+2NaOH===NaClO+NaCl+H2O _____。
⑶反应②的化学方程式(须注明反应条件)是:N2+3H22NH3__。
16. (00全国30)在一定条件下,NO跟NH3可以发生反应生成N2和H2O。现有NO和NH3的混合物1 mol,充分反应后所得产物中,若经还原得到的N2比经氧化得到的N2多1.4g。
⑴写出反应的化学方程式并标出电子转移的方向和数目。 6NO+4NH3===5N2+6H2O 。
⑵若以上反应进行完全,试计算原反应混合物中NO与NH3的物质的量可能各是多少。
依题意NO和NH3的总物质的量为1mol,其中必有一种为过量,所以有两种情况:0.3 mol NO和0.7 mol NH3;0.2 mol NH3和 0.8 mol 。
17.(01上海27)利用天然气合成氨的工艺流程示意如下:
依据上述流程,完成下列填空:
⑴天然气脱硫时的化学方程式是:3H2S+2Fe(OH)3→Fe2S3+6H2O
⑵n mol CH4经一次转化后产生CO 0.9n mol、产生H2 27n mol(用含n的代数式表示)
⑶K2CO3(aq)和 CO2反应在加压下进行,加压的理论依据是 b (多选扣分)
a. 相似相溶原理 b. 勒沙特列原理 c. 酸碱中和原理
⑷由KHCO3分解得到的CO2可以用于生产纯碱(或作制冷剂等,其它合理答案也给分)
(写出CO2的一种重要用途)。
⑸整个流程有三处循环,一是Fe(OH)3循环,二是K2CO3(aq)循环,
请在上述流程图中标出第三处循环(循环方向、循环物质) 。
三、选择题:
(BD)18.(03上海20)硝酸铜是制备Cu-Zn-Al系催化剂的重要原料。19.2g纯铜粉理论上可制得纯净硝酸铜晶体的质量为
—2—
A.28.2g B.56.4g C.64.2g D.72.6g
(AC)19.(03上海21)下面是实验室制取氨气的装置和选用的试剂,其中错误的是
A. B. C. D.
( D )20.(04广东2)上世纪80年共后期人们逐渐认识到,NO在人体内起着多方面的重要生理作用。下列关于NO的说法不正确的是
A.NO分子中有极性共价键 B.NO是造成化学烟雾的因素之一
C.NO是汽车尾气的有害成分之一 D.NO分子所含电子总数为偶数
( A )21.(04上海6)下列物质中不会因见光而分解的是
A.NaHCO3 B.HNO3 C.AgI D.HClO
( C )22.(04上海,15)CuS和Cu2S都能溶于硝酸,它们高温灼烧的产物相同,以下鉴别CuS和Cu2S两种黑色粉末的方法合理的是
A.将两种样品分别溶于硝酸,区别所产生的气体
B.将两种样品分别溶于硝酸,区别溶液的颜色
C.取两种同质量的样品分别在高温灼烧,区别残留固体的质量
D.取两种同质量的样品分别在高温灼烧,区别残留固体的颜色
( A )23.(05上海3)据报道,科学家已成功合成了少量N4,有关N4的说法正确的是
A.N4是N2的同素异形体 B.N4是N2的同分异构体
C.相同质量的N4和N2所含原子个数比为1:2 D.N4的摩尔质量是56g
( D )24.(05上海7)已知三角锥形分子E和直线形分子G反应,生成两种直线形分子L和M(组成E、G、L、M分子的元素原子序数均小于10)如下图,则下列判断错误的是
A.G是最活泼的非金属单质 B.L是极性分子
C.E能使紫色石蕊试液变蓝色 D.M化学性质活泼
( B )25.(05全国卷Ⅲ7)下列气体的制备可采用右图装置的是
A.铜与浓硝酸反应制NO2 B.铜与稀硝酸反应制NO
C.乙醇与浓硫酸反应制乙烯 D.氯化钠与浓硫酸反应制HCl
( A )26.(05江苏14)下列有关试剂的保存方法,错误的是
A.浓硝酸保存在无色玻璃试剂瓶中
B.少量的钠保存在煤油中
C.氢氧化钠溶液保存在具橡皮塞的玻璃试剂瓶中
D.新制的氯水通常保存在棕色玻璃试剂瓶中
(BD)27.(05上海15)对于某些离子的检验及结论一定正确的是 C
A.加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32
B.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42
C.加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+
D.加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+
(BD)28.(05上海19)以下各种尾气吸收装置中,适合于吸收易溶性气体,而且能防止倒吸的是
—3—
四、实验题:
29.(02上海27)Ag/α-Al2O3是石油化学工业的一种重要催化剂,其中Ag起催化作用,α-Al2O3是载体且不溶于硝酸,该催化剂的回收实验如下图所示。其中的转化反应为:
6AgCl+Fe2O3→3Ag2O+2FeCl3
阅读上述实验流程,完成下列填空:
⑴Ag/α-Al2O3加酸溶解应该选用装置 a (选填a、b、c)。
⑵在实验操作(Ⅱ),如果用自来水代替蒸馏水进行洗涤,将会发生化学反应的离子方程式
Ag++Cl-===AgCl↓ 。
⑶实验操作(Ⅳ)所需玻璃仪器为:漏斗、烧杯、玻棒 (填写三种)。
⑷实验操作(Ⅶ)从AgNO3溶液获得AgNO3晶体需要进行的实验操作依次为:b、e、d (多选扣分)。
a. 蒸馏 b. 蒸发 c. 灼烧 d. 冷却结晶
⑸已知:NO+NO2+2NaOH→2NaNO2+H2O; 2NO2+2NaOH→NaNO3+NaNO2+H2O
NO和NO2的混合气体的组成可表示为NOx。该混合气体通入NaOH溶液被完全吸收时,x的值为 c
a. x<1.5 b. x=1.2 c. X≥1.5
⑹已知Ag/α-Al2O3中Ag的质量分数,若计算Ag的回收率,还必须知道的实验数据为 催化剂的质量 和 AgNO3的质量 。
30. (02全国29)制取氨气并完成喷泉实验(图中夹持装置均已略去)。
⑴写出实验室制取氨气前化学方程式:
2NH4Cl+Ca(OH)22NH3↑+CaCl2+2H2O 。
⑵收集氨气应使用 向下排空气 法,要得到干燥的氨气可选用 碱石灰 做干燥剂。
⑶用图1装置进行喷泉实验,上部烧瓶已装满干燥氨气,引发水上喷的操作是:打开止水夹,挤出胶头滴管中的水 。该
实验的原理是:氢气极易溶解于水,致使烧瓶内气体压强迅速减小 。
⑷如果只提供如图2的装置,请说明引发喷泉的方法:打开夹子,用手(或热毛巾等)将烧瓶捂热,氢气受热膨胀,赶出玻璃导管内的空气,氨气与水接触,即发生喷泉 。
—4—
31.(04广东19)用仪器A、B和胶管组成装置收集NO气体(①仪器A已经气密性检查;②除水外不能选用其他试剂)。
在A中加满水,盖紧瓶塞,用胶管连接b和c接口,由a导入NO气体,水通过b和c排入B中 。
五、选择题:
( C )32.(05全国卷Ⅱ13)等质量的CuO和MgO粉末分别溶于相同体积的硝酸中,得到的Cu(NO3)2和Mg(NO3)2溶液的浓度分别为amol·L-1和bmol· L-1。则a与b的关系为
A.a=b B.a=2b C.2a=b D.a=5b
( A )33.(05江苏17)Cu2S与一定浓度的HNO3反应,生成Cu(NO3)2、CuSO4、NO2、NO和H2O,当NO2和NO的物质的量之比为1∶1时,实际参加反应的Cu2S与HNO3的物质的量之比为
A.1∶7 B.1∶9 C.1∶5 D.2∶9
( A )34.(02全国13)化合价为n的某元素的硝酸盐的式量为x,其氢氧化物的式量为y,则n的值是
A.(x-y)/45 B.(y-x)/45 C.(x-y)/79 D.(y-x)/79
( D )35.(07年上海卷,10)将空气中氮气转化为氮的化合物的过程称为固氮。下面能实现人工固氮的是
A.闪电 B.电解饱和食盐水车间 C.根瘤 D.合成氨车间
( C )36.(07年江苏3)三聚氰酸[C3N3(OH)3]可用于消除汽车尾气中的NO2。其反应原理为:
C3N3(OH)33HNCO;8HNCO+6NO27N2+8CO2+4H2O 下列说法正确的是A.C3N3(OH)3与HNCO为同一物质 B.HNCO是一种很强的氧化剂
C.1 mol NO2在反应中转移的电子为4 mol D.反应中NO2是还原剂
(AD)37.(07年江苏16)某合金(仅含铜、铁)中铜和铁的物质的量之和为y mol,其中Cu的物质的量分数为a,将其全部投入50 mL b mol·L-1的硝酸溶液中,加热使其充分反应(假设NO是唯一的还原产物)。下列说法正确的是
A.若金属有剩余,在溶液中再滴入硫酸后,金属又开始溶解
B.若金属全部溶解,则溶液中一定含有Fe3+
C.若金属全部溶解,且产生336 mL气体(标准状况),则b = 0.3
D.当溶液中金属离子只有Fe3+、Cu2+时,则a与b的关系为:b≥80y(1-a/3)
( A )38.(07年四川10)足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与1.68 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5 mol/L NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是
A.60 mL B.45 mL C.30 mL D.15 mL
六、推断题:
39.(04江苏19)请按要求填空:
⑴用已准确称量的1.06gNa2CO3固体配制0.100mol·L-1Na2CO3溶液100mL,所需要的仪器为:100mL容量瓶 烧杯 量筒 玻璃棒 胶头滴管 。
⑵除去NaNO3固体中混有的少量KNO3,所进行的实验操作依次为:溶解 、蒸发、结晶、过滤 。
⑶除去KCl溶液中的SO42-离子,依次加入的溶液为(填溶质的化学式):aCl2[或Ba(OH)2]、K2CO3、HCl 。
40.(02广东19)如右图所示已知:
①甲、乙、丙、丁均为前三周期元素的单质。
②在一定条件下甲与丙和甲与丁都按物质的量之比l:3反应,分别生成X和Y,在产物中元素甲呈负价。
—5—
③在一定条件下乙与丙和乙与丁都按物质的量之比1:2反应,分别生成Z和W,在产物中元素乙呈负价。 请填空:
⑴甲是__氮 ,乙是__ 氧 __。
⑵甲与丙反应生成X的化学方程式是:N2+3H22NH3 。
⑶乙与丁反应生成W的化学方程式是:O2+2Mg2MgO_。
41.(04江苏,21)下图中,A是一种无色液体,G是极易溶于水的碱性气体,Y是胃酸的主要成分,K是不溶于稀硝酸的白色沉淀,反应⑤是工业制X的主要反应之一。
请按要求填空:
⑴写出下列物质的化学式:A:H2O ,
E:N2 ;F:Ag ,Y:HCl 。
⑵反应⑤的化学方程式为:
4NH3+5O2 4NO+6H2O 。
⑶1molB通过反应②得到1molF,B中F的质量分数为72%,则B的化学式为: AgN3 。
42.(04北京,28)资料显示:“氨气可在纯氧中安静燃烧……”。某校化学小组学生设计如下装置(图中铁夹等夹持装置已略去)进行氨气与氧气在不同条件下反应的实验。
⑴用装置A制取纯净、干燥的氨气,大试管内碳酸盐的化学式是: (NH4)2CO3[或NH4HCO 3];碱石灰的作用是:吸收水和二氧化碳 。
⑵将产生的氨气与过量的氧气通到装置B(催化剂为铂石棉)中,用酒精喷灯加热:
① 氨催化氧化的化学方程式是:4NH3+5O24NO+6H2O ;试管内气体变为红棕色,该反应的化学方程式是:2NO+O2===2NO2 ;
② 停止反应后,立即关闭B中两个活塞。一段时间后,将试管浸入冰水中,试管内气体颜色变浅,请结合化学方程式说明原因:2NO 2(g) N2O4(g)+热量,降低温度使平衡正向移动,部分红棕色NO2转化为无色N2O4 。
⑶将过量的氧气与A产生的氨气分别从a、b两管进气口通入到装置C中,并在b管上端点燃氨气:
① 两气体通入的先后顺序是先通入O2,后通入NH3 。其理由是:若先通氨气,氨在空气中不能点燃,逸出造成污染 。
② 氨气燃烧的化学方程式是:4NH3+3O22N2+6H2O 。
43.(04北京29)有三种不同质量比的氧化铜与炭粉的混合物样品①、②、③。甲、乙、丙三同学各取一种样品,加强热充分反应,测定各样品中氧化铜的量。
⑴甲取样品①强热,叵所得固体为金属铜,将其置于足量的稀硝酸中微热,产生1.12 L气体标准状况,则样品①中氧化铜的质量为:6.0 g.;
⑵乙取样品② a g强热,生成的气体不能使澄清的石灰水变浑浊。再将反应后的固体与足量的稀硝酸微热,充分反应后,有b g固体剩余,该剩余固体的化学式为 C 。样品②中氧化铜质量为 [20(a-b)]/23 g(以含a、b的代数式表示)
⑶丙称量样品③强热后剩余的固体,质量比原样品减小了c g,若该固体为金属铜,则样品③中氧化铜物质的量(n)的取值范围为 c/28mol≤n≤ c/22 mol 。
—6—
44.(04天津28)I. 合成氨工业对化学的国防工业具有重要意义。写出氨的两种重要用途:制化肥、制硝酸 。
II. 实验室制备氨气,下列方法中适宜选用的是 ②④ 。
① 固态氯化铵加热分解 ② 固体氢氧化钠中滴加浓氨水
③ 氯化铵溶液与氢氧化钠溶液共热 ④ 固态氯化铵与氢氧化钙混合加热
III. 为了在实验室利用工业原料制备少量氨气,有人设计了如下装置(图中夹持装置均已略去)。
[实验操作]
① 检查实验装置的气密性后,关闭弹簧夹a、b、c、d、e。在A中加入锌粒,向长颈漏斗注入一定量稀硫酸。打开弹簧夹c、d、e,则A中有氢气发生。在F出口处收集氢气并检验其纯度。
② 关闭弹簧夹c,取下截去底部的细口瓶C,打开弹簧夹a,将氢气经导管B验纯后点燃,然后立即罩上无底细口瓶C,塞紧瓶塞,如图所示。氢气继续在瓶内燃烧,几分钟后火焰熄灭。
③ 用酒精灯加热反应管E,继续通氢气,待无底细口瓶C内水位下降到液面保持不变时,打开弹簧夹b,无底细口瓶C内气体经D进入反应管E,片刻后F中的溶液变红。
回答下列问题:
⑴检验氢气纯度的目的是:排除空气,保证安全 。
⑵C瓶内水位下降到液面保持不变时,A装置内发生的现象是 锌粒与酸脱离 ,防止了实验装置中压强过大。此时再打开弹簧夹b的原因是:尽量增大氢气的浓度以提高氮气的转化率 ,C瓶内气体的成份是:N2;H2 。
⑶在步骤③中,先加热铁触媒的原因是:铁触媒在较高温度时活性增大,加快氨合成的反应速率 。反应管E中发生反应的化学方程式是:N2+3H22NH3 。
45.(04天津29)将32.64 g铜与140 mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2 L。请回答:
⑴NO的体积为 5.8 L,NO2的体积为 5.4 L。
⑵待产生的气体全部释放后,向溶液加入V mL a mol / L的NaOH溶液,恰好使溶液中的Cu2+ 全部转化成沉淀,则原硝酸溶液的浓度为: (aV×10-3+0.5)/0.14 mol / L。
⑶欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要30%的双氧水57.8 g。
46.(05全国卷I26)已知A、B、C、D为气体,E、F为固体,G是氯化钙,它们之间的转换关系如右图所示:
⑴ D的化学式(分子式)是:NH3 ,
E的化学式(分子式)是:NH4Cl 。
⑵ A和B反应生成C的化学方程式是:
H2+Cl22HCl ___ _。
⑶ E和F反应生成D、H和G的化学方程式是:Ca(OH)2+2NH4ClCaCl2+2NH3↑+2H2O_。
—7—
47.(05江苏29)某同学拟用氯化钙固体、碳酸钠溶液和稀硝酸等试剂,先制得碳酸钙,最终制得纯净的硝酸钙晶体。
⑴写出制取过程中反应的离子方程式:
Ca2++CO32-=CaCO3↓ 、 CaCO3+2H+==Ca2++CO2↑+H2O 。
⑵请帮助该同学完成下列实验操作步骤(不要求回答使用的仪器)
①用蒸馏水完全溶解CaCl2后,加入碳酸钠溶液 。
②将反应后的混合物过滤,并用适量蒸馏水洗涤沉淀至无Cl-。
③加入 稀硝酸 ,使沉淀完全溶解。
④蒸发 结晶 ,得到纯净的硝酸钙晶体。
48.(05天津29)磷在氧气中燃烧,可能生成两种固态氧化物。3.1g的单质磷(P)在3.2g的氧气中燃烧,至反应物耗尽,并放出X KJ热量。
⑴ 通过计算确定反应产物的组成(用化学式表示)是P2O3 P2O5 _,其相应的质量(g)为m(P2O3) =2.75g m(P2O5)=3.55g 。
⑵ 已知单质磷的燃烧热为Y KJ/mol,则1mol P与O2反应生成固态P2O5 的反应热△H ===
-(20X-Y) KJ/mol 。
⑶ 写出1mol P与O2反应生成固态P2O3 的热化学反应方程式:
P(s) + 3/4O2(g) == 1/2 P2O3(s);△H = -(20X-Y) KJ/mol__。
49.(06江苏21)稀薄燃烧是指汽油在较大空/燃比(空气与燃油气的体积比)条件下的燃烧。随着全球能源危机的加剧,稀薄燃烧技术的
研究受到了人们的重视,但稀薄燃烧时,常
用的汽车尾气净化装置不能有效地将NOx转
化为N2。不同空/燃比时汽车尾气中主要污染
物的含量变化如右图所示。
⑴稀薄燃烧技术除能节约能源外,还具有的
优点是:减少CO和碳氢化合物的污染;
(填一项)。排放到大气中的NOx会导致酸雨、
光化学烟雾或破坏臭氧层 等环境问题(填一项)。
⑵某校化学研究性学习小组的同学在技术人员的指导下,
按下列流程探究不同催化剂对NH3还原NO反应的催化性能。若控制其他实验条件相同,在催化反应器中装载不同的催化剂,将经催化反应后的混合气体通入滴有酚酞的稀硫酸溶液(溶液的体积、浓度均相同)。为比较不同催化剂的催化性能,需要测量并记录的数据是:溶液显色所需要的时间 。
⑶若某一催化剂能同时催化NH3等还原性气体与NOx的反应。将该催化剂分别用于催化还原等物质的量NOx的两种气体:①纯NO气体,②汽车尾气。消耗NH3的物质的量较多的可能是 A (填字母),原因是汽车尾气中含有一定量的CO和碳氢化合物,少消耗NH3 或B 汽车尾气中含有一定量的 NO2,多消耗NH3或C 汽车尾气中同时含有CO、碳氢化合物等还原性气体和NO2等氧化性气体,二者相对含量的不同可导致消耗NH3的增多或减少 。
A.① B.② C.都有可能
50.(07年江苏20)(10分)图中各物质均由常见元素(原子序数≤20)组成。已知A、B、K为单质,且在常温下A和K为气体,B为固体。D为常见的无色液体。I是一种常用的化肥,在其水溶液中滴加AgNO3溶液有不溶于稀HNO3的白色沉淀产生。J是一种实验室常用的干燥剂。它们的相互转化关系如图所示(图中反应条件未列出)。请回答下列问题:
⑴I的化学式为_NH4Cl __;J的电子式为______ 。
⑵反应①的化学方程式为:Ca3N2+6H2O = 3Ca(OH)2+2NH3↑ _。
—8—
⑶F的水溶液与氯气反应的离子方程式为:2OH-+Cl2 = Cl-+ClO-+H2O _。
51.(A) (07年上海26)实验室模拟合成氨和氨催化氧化的流程如下:
已知实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气。
⑴从图中选择制取气体的合适装置:氮气 a 、氢气 b 。
⑵氮气和氢气通过甲装置,甲装置的作用除了将气体混合外,还有干燥气体 、 控制氢气和氮气的流速(合理即给分) 。
⑶氨合成器出来经冷却的气体连续通入乙装置的水中吸收氨,不会 (“会”或“不会”)发生倒吸,原因是:因为混合气体中含有大量难溶于水的氮、氢两种气体 。
⑷用乙装置吸收一段时间氨后,再通入空气,同时将经加热的铂丝插入乙装置的锥形瓶内,能使铂丝保持红热的原因是:说明氨的氧化反应是一个放热反应 ,锥形瓶中还可观察到的现象是:有红棕色气体产生(合理即给分 。
⑸写出乙装置中氨氧化的化学方程式:_4NH3十5O24NO+6H2O __。
⑹反应结束后锥形瓶内的溶液中含有H+、OH-、NH4+ 、 NO3- 离子。
52.(07年四川27)(15分)下图是无机物A~M在一定条件下的转化关系(部分产物及反应条件未列出)。其中,I是由第三周期元素组成的单质中熔点最高的金属,K是一种红棕色气体。
请填写下列空白:
⑴在周期表中,组成单质G的元素位于第_四(或4)___周期第_Ⅷ__族。
⑵在反应⑦中氧化剂与还原剂的物质的量之比为_1:2______。
⑶在反应②、③、⑥、⑨中,既属于化合反应又能属于非氧化还原反应的是__③___(填写序号)。
⑷反应④的离子方程式是:3Fe2++NO3- +4H+ = 3Fe3++NO↑+2H2O___。
—9—
⑸将化合物D与KNO3、KOH共融,可制得一种“绿色”环保高效净水剂K2FeO4(高铁酸钾),同时还生成KNO2和H2O。该反应的化学方程式是:
Fe2O3+3KNO3+4KOH2K2FeO4+3KNO2+2H2O 。
53.(07年重庆27)(16分)某兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化。
方案 反应物
甲 Cu、浓HNO3
乙 Cu、稀HNO3
丙 Cu、O2、稀HNO3
(1)实验前,关闭活塞b,试管d中加水至浸没长导管口,塞紧试管c和d的胶塞,加热c,其目的是:检查装置气密性 。
⑵在d中加适量NaOH溶液,c中放一小块铜片,由分液漏斗a向c中加入2 mL浓硝酸,c中反应的化学方程式是Cu+4HNO3(浓) = Cu(NO3)2+2NO2↑+2H2O _。再由a向c中加2 mL蒸馏水,c中的实验现象是:反应变缓,气体颜色变淡 。
⑶上表是制取硝酸铜的三种方案,能体现绿色化学理念的最佳方案是 丙 ,理由是耗酸量最少,无污染 。
⑷该小组还用上述装置进行实验证明氧化性KMnO4>Cl2>Br2,操作步骤为_向d中加入KBr溶液,c中加入固体KMnO4,由a向c中加入浓盐酸_,实验现象为_c中有黄绿色气体产生,d中溶液变为黄棕色 ;但此实验的不足之处是没有处理尾气 。
54. (03北京春季理综26)为了检验Pb(NO3)2热分解的产物,有人用示意图中的装置进行实验。(图中铁架台、铁夹和加热设备均略去)实验时在试管中放入研细的Pb(NO3)2晶体;实验结束后,试管中得到黄色粉末(PbO),U型管下部有少量液体X,集气瓶中收集到无色气体Y。(如图) 回答下面问题:
⑴在装置中试管和U型管上的橡皮塞最好用锡箔包住,用橡皮管连接的两玻璃管口要相互紧靠,原因是:NO2气体会损坏橡胶 。
⑵液体X可能是N2O4(答液态的NO2同样给分) ;气体Y可能是 O2 。
⑶导管口不再有气泡冒出时,停止反应,这时在操作上应注意先把导气管移出水面,然后熄灭火焰 ,理由是:防止水槽中的水反吸到U型管中 。
⑷用简单的实验证实⑵中的判断:
①对X的判断:在通风橱中取下U型管放置,观察到U型管中液体迅速消失,管中充满红棕色气体,证明X是液态N2O4。(其他合理答案同样给分)。
②对Y的判断(要求:怎样从水槽中取出集气瓶、实验方法、现象、结论):在水槽,用玻璃片盖住集气瓶口,按住玻璃片,小心把集气瓶移出水面,正放在桌上,用带火星的木条插入瓶口,木条迅速燃烧,证明Y是O2 。
—10—
E
+
+
G
L
M
水
a b c
C
A
B
空/燃比
A:NOx
B:CO
C:碳氢化合物
13 14 15 16 17 18
污染物的含量
NO、NH3
混合气体
催化反应器
检测
尾气处理
a
b
c
N2
H2
原料气
浓硫酸
甲
铂
乙
a
b
c
d
PAGE
同课章节目录
