第二节几种重要的金属化合物
文档属性
| 名称 | 第二节几种重要的金属化合物 |

|
|
| 格式 | rar | ||
| 文件大小 | 599.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2007-12-10 00:00:00 | ||
图片预览






文档简介
课件27张PPT。第二节 几种重要的金属化合物湖南广益卫星远程学校 高一年级第一学年第一学期高一年级 化学
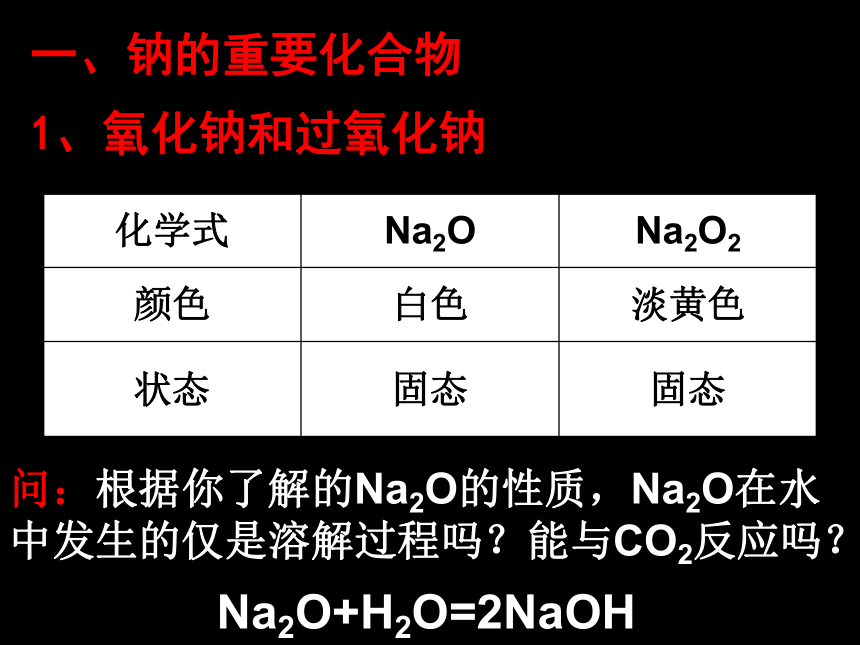
第三章 金属及其化合物授课者 罗爱斌一、钠的重要化合物1、氧化钠和过氧化钠问:根据你了解的Na2O的性质,Na2O在水
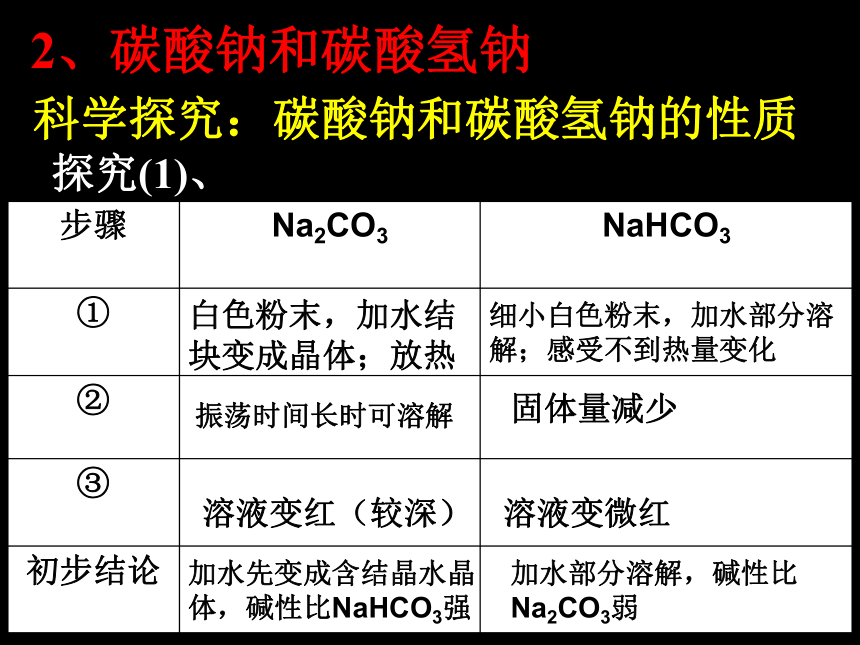
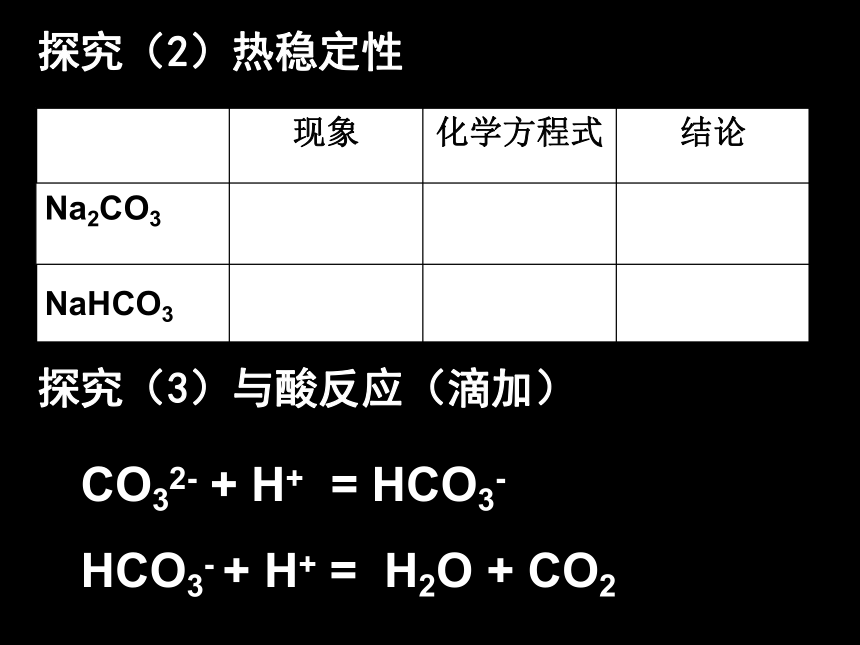
中发生的仅是溶解过程吗?能与CO2反应吗?Na2O+H2O=2NaOHNa2O+CO2=Na2CO3问:Na2O2是否能表现类似的性质?请同学们设计一个实验来探索:如何证明Na2O2是否与水、CO2发生了反应?(1)、过氧化钠与水反应实验3-5 过氧化钠与水反应现象:产生大量气泡;带火星的木条复燃;试管外壁发热;滴加酚酞溶液变红2Na2O2 + 2H2O = 4NaOH + O2 ↑(2) 、过氧化钠与二氧化碳反应补充实验:过氧化钠与二氧化碳反应2Na2O2+2CO2==2Na2CO3+O2Na2O2既是氧化剂又是还原剂。两者都是放热反应,放出热能使棉花燃烧,生成的氧气更使棉花燃烧加剧。用途简介:Na2O2是用在呼吸面具或潜水艇里作氧气来源。2、碳酸钠和碳酸氢钠 科学探究:碳酸钠和碳酸氢钠的性质现象: 探究(1)、白色粉末,加水结块变成晶体;放热细小白色粉末,加水部分溶解;感受不到热量变化振荡时间长时可溶解固体量减少溶液变微红溶液变红(较深)加水先变成含结晶水晶体,碱性比NaHCO3强加水部分溶解,碱性比Na2CO3弱探究(2)热稳定性探究(3)与酸反应(滴加)CO32- + H+ = HCO3-
HCO3- + H+ = H2O + CO21939年,中国化工专家侯德榜提出“联合制碱法”,1939年侯德榜完成了世界上第一部纯碱工业专著《制碱》。 1942年中国科学家侯德榜发明了遐迩闻名的“侯氏制碱法”,成为世界上生产纯碱的重要方法。其主要化学原理是:
CO2+H2O+NH3+NaCl=NH4Cl+NaHCO3↓实验3-6:金属的焰色反应 钠:黄色 钾:紫色
钙:砖红色 铜:绿色3、焰色反应二、铝的重要化合物 1、氧化铝闪耀着六射星光的天然蓝宝石“亚洲之星”重330克拉,缅甸产,世界著名珍宝,现藏于美国华盛顿斯密森博物馆。闪耀着六射星光的天然红宝石“罗斯利夫斯”,重138.7克拉,斯里兰卡产,世界著名珍宝。现藏于美国华盛顿斯密森博物馆。
氧化铝的天然存在形式铝土矿
由氧化铝的水合物和少量的氧化铁和二氧化硅杂质组成刚 玉
氧化铝的天然晶体,硬度大仅次于金刚石、金刚砂(SiC)(蓝宝石、红宝石是刚玉的一种)
1、物理性质
白色、粉末状、难溶解、难熔化的固体2、化学性质
两性氧化物的性质——既与酸又与强碱
反应但不与氨水反应Al2O3+ 6H+ = 2Al3+ + 3H2OAl2O3+ 2OHˉ = 2AlO2? + H2O2、氢氧化铝讨 论:如何制取氢氧化铝? 最佳方法——铝盐和碱反应氢氧化铝的实验室制法 氨水与铝盐反应Al3++3NH3.H2O =Al(OH)3↓+3NH4+水蒸气的发生装置水蒸气与铁粉反应装置产物收集装置沉淀
溶解沉淀
溶解氢氧化铝与氢氧化钠反应而溶解 氢氧化铝
与盐酸反
应而溶解Al(OH)3+ NaOH = NaAlO2+2H2O Al(OH)3+OHˉ = AlO2?+2H2O Al(OH)3+3HCl = AlCl3+3 H2OAl(OH)3+3H+ = Al3++3H2O取一份氢氧化铝,向其中逐滴滴入氢氧化钠观察现象取一份氢氧化铝,向其中滴入盐酸观察现象。 向氢氧化铝中滴加氨水沉淀不溶解氢氧化铝不与氨水反应 无1.氢氧化铝的物理性质
白色、胶状、难溶的物质
2.化学性质
典型的两性氢氧化物的性质——与强酸、强碱反应Al(OH)3+OHˉ = AlO2?+2H2O Al(OH)3+3H+ = Al3++3H2OAlO2? Al(OH)3 Al3+ HCl NaOH NaOH?拓展:铝的化合物的用途胃不痛了,多亏了胃舒平!!!胃舒平又名复方氢氧化铝,是由能中和胃酸的氢氧化铝和三硅酸镁两药合用,并组合解痉止痛药颠茄浸膏而成。 HCl明矾:KAl(SO4)2·12H2O
或K2SO4·Al2(SO4)3·24H2O(1) 物理性质:无色晶体、易溶于水(2) 化学性质:在水中完全电离。KAl(SO4)2 =K++Al3++2SO42-Al3++3H2O(胶体)Al(OH)3+3H+思考:铝盐的性质探究 思考与实验研究: 1,向氯化铝中逐滴加入氢氧化钠 2,向氢氧化钠中逐滴加入氯化铝 描述实验现象,并书写相关的化学方程式三、铁的重要化合物1、铁的氧化物砖的颜色为何有青有红?同学们大都见过红砖和青砖,你们是否知道它们是由同种砖胚烧制而成的?为什么用相同的材料制成的砖的颜色会不相同呢?磁铁矿赤铁矿 氧化亚铁铁 红磁性氧化铁黑色粉末红棕色粉末黑色晶体+ 2+ 3+ 2、+ 3不 溶不 溶不 溶2、铁的氢氧化物实验3-9 氢氧化铁和氢氧化亚铁的制备Fe3+ + 3OH- == Fe(OH)3↓
Fe2+ + 2OH- == Fe(OH)2↓4Fe(OH)2 + O2 + 2H2O == 4Fe(OH)3白色沉淀迅速变为灰绿色,最后变为红褐色)Fe(OH)2的制取探索性实验改进思考:怎样才能在较长时间内观察到白色的Fe(OH)2沉淀?(2003全国理综)(在如图装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。
(1)在试管Ⅰ里加入的试剂是 。
(2)在试管Ⅱ里加入的试剂是 。
(3)怎样操作就可以长时间看到白色的Fe(OH)2沉淀?3、铁盐和亚铁盐⑴Fe2+ 、Fe3+常用的检验方法
Fe3+的检验:
a.观察颜色: Fe3+的溶液呈
b.加碱液:Fe3? + 3OH? = Fe(OH)3?
c.加KSCN溶液:Fe3? + 3SCN? = Fe(SCN)3棕黄色(红褐色沉淀)(血红色溶液)Fe2+的检验:a.观察颜色: Fe2+的溶液呈
b.加碱液:Fe2? + 2OH? = Fe(OH)2?
c.将Fe2?转化为Fe3?检验:
Fe2?
浅绿色(白色沉淀迅速变为灰绿色,最后变为红褐色)KSCN氯水血红色溶液无现象Fe2+Fe3+Cl2 O2 HNO3 KMnO4Fe Cu I- S2-浅绿色棕黄色Fe(OH)3Fe(OH)2红褐色白色碱酸碱酸空气中放置
第三章 金属及其化合物授课者 罗爱斌一、钠的重要化合物1、氧化钠和过氧化钠问:根据你了解的Na2O的性质,Na2O在水
中发生的仅是溶解过程吗?能与CO2反应吗?Na2O+H2O=2NaOHNa2O+CO2=Na2CO3问:Na2O2是否能表现类似的性质?请同学们设计一个实验来探索:如何证明Na2O2是否与水、CO2发生了反应?(1)、过氧化钠与水反应实验3-5 过氧化钠与水反应现象:产生大量气泡;带火星的木条复燃;试管外壁发热;滴加酚酞溶液变红2Na2O2 + 2H2O = 4NaOH + O2 ↑(2) 、过氧化钠与二氧化碳反应补充实验:过氧化钠与二氧化碳反应2Na2O2+2CO2==2Na2CO3+O2Na2O2既是氧化剂又是还原剂。两者都是放热反应,放出热能使棉花燃烧,生成的氧气更使棉花燃烧加剧。用途简介:Na2O2是用在呼吸面具或潜水艇里作氧气来源。2、碳酸钠和碳酸氢钠 科学探究:碳酸钠和碳酸氢钠的性质现象: 探究(1)、白色粉末,加水结块变成晶体;放热细小白色粉末,加水部分溶解;感受不到热量变化振荡时间长时可溶解固体量减少溶液变微红溶液变红(较深)加水先变成含结晶水晶体,碱性比NaHCO3强加水部分溶解,碱性比Na2CO3弱探究(2)热稳定性探究(3)与酸反应(滴加)CO32- + H+ = HCO3-
HCO3- + H+ = H2O + CO21939年,中国化工专家侯德榜提出“联合制碱法”,1939年侯德榜完成了世界上第一部纯碱工业专著《制碱》。 1942年中国科学家侯德榜发明了遐迩闻名的“侯氏制碱法”,成为世界上生产纯碱的重要方法。其主要化学原理是:
CO2+H2O+NH3+NaCl=NH4Cl+NaHCO3↓实验3-6:金属的焰色反应 钠:黄色 钾:紫色
钙:砖红色 铜:绿色3、焰色反应二、铝的重要化合物 1、氧化铝闪耀着六射星光的天然蓝宝石“亚洲之星”重330克拉,缅甸产,世界著名珍宝,现藏于美国华盛顿斯密森博物馆。闪耀着六射星光的天然红宝石“罗斯利夫斯”,重138.7克拉,斯里兰卡产,世界著名珍宝。现藏于美国华盛顿斯密森博物馆。
氧化铝的天然存在形式铝土矿
由氧化铝的水合物和少量的氧化铁和二氧化硅杂质组成刚 玉
氧化铝的天然晶体,硬度大仅次于金刚石、金刚砂(SiC)(蓝宝石、红宝石是刚玉的一种)
1、物理性质
白色、粉末状、难溶解、难熔化的固体2、化学性质
两性氧化物的性质——既与酸又与强碱
反应但不与氨水反应Al2O3+ 6H+ = 2Al3+ + 3H2OAl2O3+ 2OHˉ = 2AlO2? + H2O2、氢氧化铝讨 论:如何制取氢氧化铝? 最佳方法——铝盐和碱反应氢氧化铝的实验室制法 氨水与铝盐反应Al3++3NH3.H2O =Al(OH)3↓+3NH4+水蒸气的发生装置水蒸气与铁粉反应装置产物收集装置沉淀
溶解沉淀
溶解氢氧化铝与氢氧化钠反应而溶解 氢氧化铝
与盐酸反
应而溶解Al(OH)3+ NaOH = NaAlO2+2H2O Al(OH)3+OHˉ = AlO2?+2H2O Al(OH)3+3HCl = AlCl3+3 H2OAl(OH)3+3H+ = Al3++3H2O取一份氢氧化铝,向其中逐滴滴入氢氧化钠观察现象取一份氢氧化铝,向其中滴入盐酸观察现象。 向氢氧化铝中滴加氨水沉淀不溶解氢氧化铝不与氨水反应 无1.氢氧化铝的物理性质
白色、胶状、难溶的物质
2.化学性质
典型的两性氢氧化物的性质——与强酸、强碱反应Al(OH)3+OHˉ = AlO2?+2H2O Al(OH)3+3H+ = Al3++3H2OAlO2? Al(OH)3 Al3+ HCl NaOH NaOH?拓展:铝的化合物的用途胃不痛了,多亏了胃舒平!!!胃舒平又名复方氢氧化铝,是由能中和胃酸的氢氧化铝和三硅酸镁两药合用,并组合解痉止痛药颠茄浸膏而成。 HCl明矾:KAl(SO4)2·12H2O
或K2SO4·Al2(SO4)3·24H2O(1) 物理性质:无色晶体、易溶于水(2) 化学性质:在水中完全电离。KAl(SO4)2 =K++Al3++2SO42-Al3++3H2O(胶体)Al(OH)3+3H+思考:铝盐的性质探究 思考与实验研究: 1,向氯化铝中逐滴加入氢氧化钠 2,向氢氧化钠中逐滴加入氯化铝 描述实验现象,并书写相关的化学方程式三、铁的重要化合物1、铁的氧化物砖的颜色为何有青有红?同学们大都见过红砖和青砖,你们是否知道它们是由同种砖胚烧制而成的?为什么用相同的材料制成的砖的颜色会不相同呢?磁铁矿赤铁矿 氧化亚铁铁 红磁性氧化铁黑色粉末红棕色粉末黑色晶体+ 2+ 3+ 2、+ 3不 溶不 溶不 溶2、铁的氢氧化物实验3-9 氢氧化铁和氢氧化亚铁的制备Fe3+ + 3OH- == Fe(OH)3↓
Fe2+ + 2OH- == Fe(OH)2↓4Fe(OH)2 + O2 + 2H2O == 4Fe(OH)3白色沉淀迅速变为灰绿色,最后变为红褐色)Fe(OH)2的制取探索性实验改进思考:怎样才能在较长时间内观察到白色的Fe(OH)2沉淀?(2003全国理综)(在如图装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。
(1)在试管Ⅰ里加入的试剂是 。
(2)在试管Ⅱ里加入的试剂是 。
(3)怎样操作就可以长时间看到白色的Fe(OH)2沉淀?3、铁盐和亚铁盐⑴Fe2+ 、Fe3+常用的检验方法
Fe3+的检验:
a.观察颜色: Fe3+的溶液呈
b.加碱液:Fe3? + 3OH? = Fe(OH)3?
c.加KSCN溶液:Fe3? + 3SCN? = Fe(SCN)3棕黄色(红褐色沉淀)(血红色溶液)Fe2+的检验:a.观察颜色: Fe2+的溶液呈
b.加碱液:Fe2? + 2OH? = Fe(OH)2?
c.将Fe2?转化为Fe3?检验:
Fe2?
浅绿色(白色沉淀迅速变为灰绿色,最后变为红褐色)KSCN氯水血红色溶液无现象Fe2+Fe3+Cl2 O2 HNO3 KMnO4Fe Cu I- S2-浅绿色棕黄色Fe(OH)3Fe(OH)2红褐色白色碱酸碱酸空气中放置
