盐类的水解
图片预览







文档简介
课件24张PPT。第三节 盐类的水解黄山市田家炳实验学校 程培红酸溶液显酸性,碱溶液显碱性,那么盐溶液显什么性?
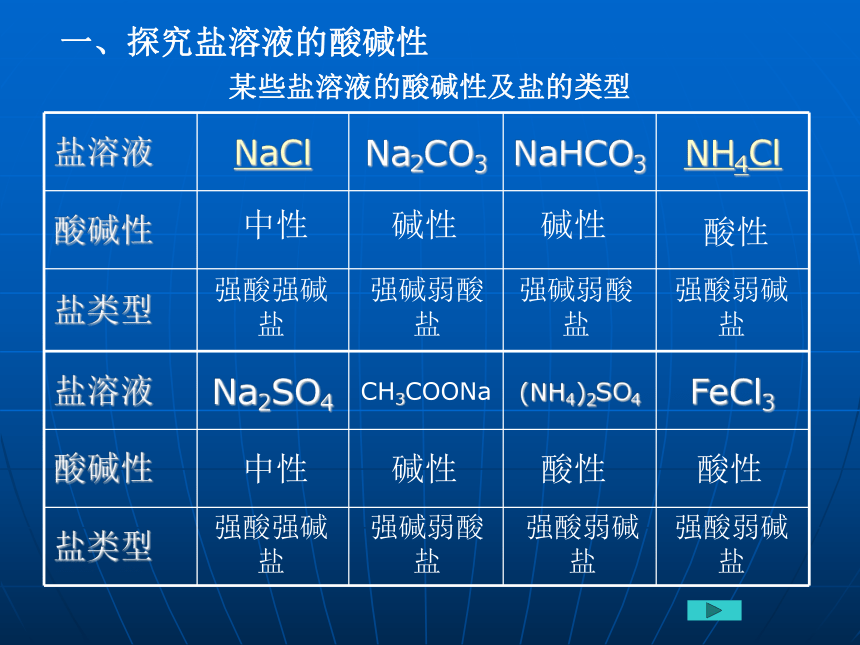
碳酸钠是盐,俗名叫纯碱,明明是盐为何要叫“碱”? 中性 碱性 碱性 酸性 中性 碱性 酸性 酸性强酸强碱盐强碱弱酸盐强碱弱酸盐强酸弱碱盐强酸强碱盐强碱弱酸盐强酸弱碱盐强酸弱碱盐某些盐溶液的酸碱性及盐的类型一、探究盐溶液的酸碱性盐溶液酸碱性与盐类型的关系中 性酸 性碱 性⒈盐溶液不都显中性,有的显酸性,有的显碱性⒉盐溶液的酸碱性与盐的类型有关:“谁强显谁性”,“两强显中性”。二、盐溶液呈现不同酸碱性的原因盐在水中完全电离为离子,但不产生H+和OH-,不能使溶液显酸碱性;
纯水会微弱电离产生H+ 和OH-,但c(H+) =c(OH-) ,显中性;
盐溶液显酸(碱)性,说明溶液中c(H+) ≠c(OH-);
是什么原因使得溶液中c(H+) ≠c(OH-)?
可能是盐与水之间发生了某种反应。
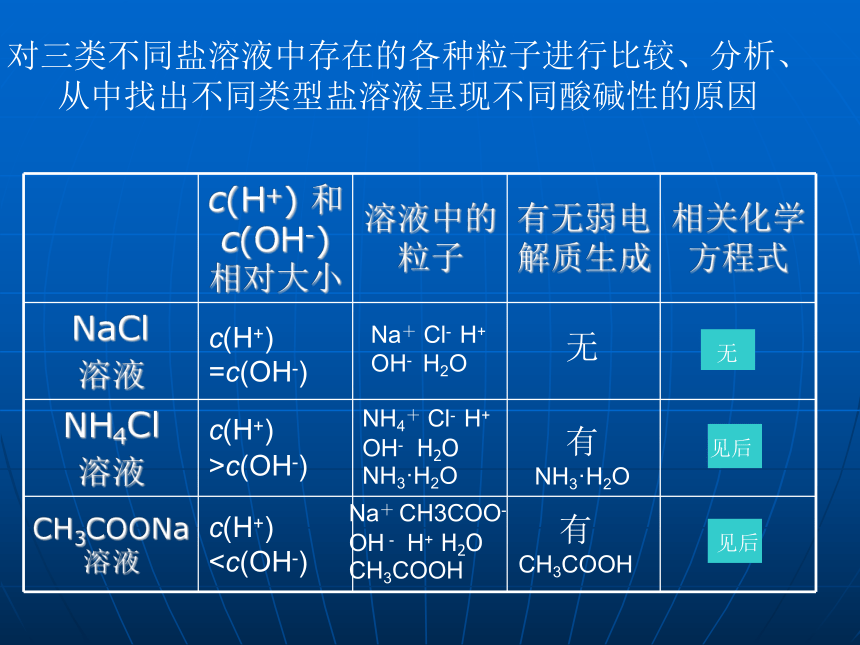
对三类不同盐溶液中存在的各种粒子进行比较、分析、从中找出不同类型盐溶液呈现不同酸碱性的原因c(H+) =c(OH-)c(H+) >c(OH-)c(H+)c(OH-),显酸性。本质是弱碱阳离子与水电离出的OH-作用生成弱电解质。+CH3COOH溶液中c(H+)本质是弱酸阴离子与水电离出的H+作用生成弱电解质。NaCl Na+ + Cl-
H2O H+ + OH-
强酸强碱盐电离出的阴、阳离子都不能与水电离出的H+ 或 OH-生成弱电解质,也就是说强酸强碱盐不跟水反应(即不水解),溶液中c(H+)=c(OH-),显中性。“有弱就水解,无弱不水解”⒈盐类水解定义:
盐电离产生的离子与水电离产生的H+或OH-生成弱电解质— 弱碱或弱酸的反应叫做盐类的水解。
⒉盐类水解的本质:
盐的离子破坏了水的电离平衡,使溶液中c(H+) ≠c(OH-)。
⒊盐类水解的特点:
水解是微弱的、可逆的。存在着水解平衡。
三、影响盐类水解的主要因素⒈盐的组成:
“越弱越水解”
盐类水解的实质是盐与水作用生成弱电解质(弱酸或弱碱),生成弱电解质的倾向越大(生成的弱电解质越难电离),对水电离平衡的影响越大,也就是水解程度越大。
例:酸性:乙酸>碳酸>碳酸氢根离子
水解程度:乙酸钠<碳酸氢钠<碳酸钠
即pH : CH3COONa 增大盐的浓度可使平衡向水解方向移动,溶液的酸性(或碱性)增大,盐的水解程度减小;
盐溶液中加水稀释,也可使平衡向水解方向移动,但溶液酸性(或碱性)减小,盐的水解程度增大。
例:碳酸钠溶液加水稀释,水解程度增大,溶液的碱性减小(pH变小)。三、影响盐类水解的主要因素⒊溶液的酸碱性:
溶液的酸碱性可以抑制或促进盐的水解。
例:
加酸:H+与OH-反应生成水,降低了生成物浓度,平衡向水解方向移动。即促进了CH3COONa的水解。
加碱:增加了OH-浓度,使平衡向逆反应方向移动,即抑制了CH3COONa的水解。 三、影响盐类水解的主要因素⒋温度:
盐类水解的逆反应是中和反应,则盐类的水解反应是 热反应。
升温,水解平衡向 反应方向移动。
问题:蒸干并灼烧ACl3溶液,最后得到什么物质?吸正(Al2O3)四、盐类水解原理的应用⒈配制某些易水解盐溶液
例:配制FeCl3溶液,由于:
Fe3+ + 3H2O Fe(OH)3 +3H+
因生成难溶的Fe(OH)3而得不到澄清溶液,可加入少量盐酸以防止浑浊。
配制FeCl3、SnCl2等溶液时,先用少量浓盐酸溶解 ,再加水稀释到所需的浓度。
四、盐类水解原理的应用⒉热的碳酸钠溶液去油污
CO32- + H2O HCO3- + OH-
升温可使水解平衡向正反应方向移动,提高了c(OH-),增强了去污力。
⒊铁盐、铝盐作净水剂
许多盐在水解时,可生成难溶于水的氢氧化物,当生成的氢氧化物呈胶状且无毒时,可用作净水剂。如明矾,硫酸铁等。
四、盐类水解原理的应用⒋制取纳米材料
若盐的浓度较低时,也可以利用水解反应来获得纳米材料。
⒌制取某些无机化合物
当水解程度很大时,可用来制取某些物质:
TiCl4 +(x+2)H2O (过量) TiO2·xH2O↓ + 4HCl 四、盐类水解原理的应用⒍泡沫灭火器工作原理
泡沫灭火器中的反应物分别是硫酸铝溶液和碳酸氢钠溶液,它们是如何产生二氧化碳的?
Al3+ + 3H2O Al(OH)3 + 3H+
HCO3- + H2O H2CO3 + OH-
混合时, H+ + OH- H2O
两个平衡相互促进, Al(OH)3形成沉淀, H2CO3 分解为CO2,总反应为:
Al3+ + 3HCO3- Al(OH)3 ↓+3CO2↑五、盐溶液中离子浓度间关系“三个守恒”:以Na2CO3溶液为例。
⒈电荷守恒:因溶液是电中性的,所以溶液中阳离子所带的正电荷总数与阴离子所带负电荷总数相等。
c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)
⒉物料守恒:关键元素的原子数目之比守恒。
c(Na+)=2[c(CO32-)+ c(HCO3-)+c(H2CO3)]
⒊水的电离守恒:
c(OH-)=c(H+)+ c(HCO3-)+2c(H2CO3)
练习:写出醋酸钠溶液中的三个守恒关系。五、盐溶液中离子浓度间关系“大小比较”
⒈ CH3COONa溶液
c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
⒉Na2CO3溶液
c(Na+)>c(CO32-)> c(OH-)>c(HCO3-)> c(H+)
⒊NH4Cl溶液
c(Cl-)>c(NH4+)> c(H+)>c(OH-)
练习:已知等物质的量浓度醋酸与醋酸钠混合溶液呈酸性,写出混合溶液中各离子浓度大小关系。c(CH3COO-)>c(Na+)>c(H+)>c(OH-)1、0.1mol/l下列溶液PH值由大到小的顺序是 _________________
①H2SO4 ② NH3·H2O ③ NaOH ④NH4Cl ⑤NaCl ⑥CH3COONa ⑦ HCl ⑧ CH3COOH ⑨Ba(OH)2 2、将10 mL0.2 mol/L氨水和10 mL0.1 mol/L盐酸混合后, 溶液里各种离子物质的量浓度的关系是 ( )
A. c (Cl-) + c (OH-) = c(NH4+) + c (H+)
B. c (Cl-)> c(NH4+)> c (H+) > c (OH-)
C. c(NH4+) > c (Cl--)> c (OH-)> c (H+)
D. c (Cl-)> c (H+) > c (NH4+) > c (OH-)AC⑨>③>②>⑥>⑤>④>⑧>⑦>①练习:
碳酸钠是盐,俗名叫纯碱,明明是盐为何要叫“碱”? 中性 碱性 碱性 酸性 中性 碱性 酸性 酸性强酸强碱盐强碱弱酸盐强碱弱酸盐强酸弱碱盐强酸强碱盐强碱弱酸盐强酸弱碱盐强酸弱碱盐某些盐溶液的酸碱性及盐的类型一、探究盐溶液的酸碱性盐溶液酸碱性与盐类型的关系中 性酸 性碱 性⒈盐溶液不都显中性,有的显酸性,有的显碱性⒉盐溶液的酸碱性与盐的类型有关:“谁强显谁性”,“两强显中性”。二、盐溶液呈现不同酸碱性的原因盐在水中完全电离为离子,但不产生H+和OH-,不能使溶液显酸碱性;
纯水会微弱电离产生H+ 和OH-,但c(H+) =c(OH-) ,显中性;
盐溶液显酸(碱)性,说明溶液中c(H+) ≠c(OH-);
是什么原因使得溶液中c(H+) ≠c(OH-)?
可能是盐与水之间发生了某种反应。
对三类不同盐溶液中存在的各种粒子进行比较、分析、从中找出不同类型盐溶液呈现不同酸碱性的原因c(H+) =c(OH-)c(H+) >c(OH-)c(H+)
H2O H+ + OH-
强酸强碱盐电离出的阴、阳离子都不能与水电离出的H+ 或 OH-生成弱电解质,也就是说强酸强碱盐不跟水反应(即不水解),溶液中c(H+)=c(OH-),显中性。“有弱就水解,无弱不水解”⒈盐类水解定义:
盐电离产生的离子与水电离产生的H+或OH-生成弱电解质— 弱碱或弱酸的反应叫做盐类的水解。
⒉盐类水解的本质:
盐的离子破坏了水的电离平衡,使溶液中c(H+) ≠c(OH-)。
⒊盐类水解的特点:
水解是微弱的、可逆的。存在着水解平衡。
三、影响盐类水解的主要因素⒈盐的组成:
“越弱越水解”
盐类水解的实质是盐与水作用生成弱电解质(弱酸或弱碱),生成弱电解质的倾向越大(生成的弱电解质越难电离),对水电离平衡的影响越大,也就是水解程度越大。
例:酸性:乙酸>碳酸>碳酸氢根离子
水解程度:乙酸钠<碳酸氢钠<碳酸钠
即pH : CH3COONa
盐溶液中加水稀释,也可使平衡向水解方向移动,但溶液酸性(或碱性)减小,盐的水解程度增大。
例:碳酸钠溶液加水稀释,水解程度增大,溶液的碱性减小(pH变小)。三、影响盐类水解的主要因素⒊溶液的酸碱性:
溶液的酸碱性可以抑制或促进盐的水解。
例:
加酸:H+与OH-反应生成水,降低了生成物浓度,平衡向水解方向移动。即促进了CH3COONa的水解。
加碱:增加了OH-浓度,使平衡向逆反应方向移动,即抑制了CH3COONa的水解。 三、影响盐类水解的主要因素⒋温度:
盐类水解的逆反应是中和反应,则盐类的水解反应是 热反应。
升温,水解平衡向 反应方向移动。
问题:蒸干并灼烧ACl3溶液,最后得到什么物质?吸正(Al2O3)四、盐类水解原理的应用⒈配制某些易水解盐溶液
例:配制FeCl3溶液,由于:
Fe3+ + 3H2O Fe(OH)3 +3H+
因生成难溶的Fe(OH)3而得不到澄清溶液,可加入少量盐酸以防止浑浊。
配制FeCl3、SnCl2等溶液时,先用少量浓盐酸溶解 ,再加水稀释到所需的浓度。
四、盐类水解原理的应用⒉热的碳酸钠溶液去油污
CO32- + H2O HCO3- + OH-
升温可使水解平衡向正反应方向移动,提高了c(OH-),增强了去污力。
⒊铁盐、铝盐作净水剂
许多盐在水解时,可生成难溶于水的氢氧化物,当生成的氢氧化物呈胶状且无毒时,可用作净水剂。如明矾,硫酸铁等。
四、盐类水解原理的应用⒋制取纳米材料
若盐的浓度较低时,也可以利用水解反应来获得纳米材料。
⒌制取某些无机化合物
当水解程度很大时,可用来制取某些物质:
TiCl4 +(x+2)H2O (过量) TiO2·xH2O↓ + 4HCl 四、盐类水解原理的应用⒍泡沫灭火器工作原理
泡沫灭火器中的反应物分别是硫酸铝溶液和碳酸氢钠溶液,它们是如何产生二氧化碳的?
Al3+ + 3H2O Al(OH)3 + 3H+
HCO3- + H2O H2CO3 + OH-
混合时, H+ + OH- H2O
两个平衡相互促进, Al(OH)3形成沉淀, H2CO3 分解为CO2,总反应为:
Al3+ + 3HCO3- Al(OH)3 ↓+3CO2↑五、盐溶液中离子浓度间关系“三个守恒”:以Na2CO3溶液为例。
⒈电荷守恒:因溶液是电中性的,所以溶液中阳离子所带的正电荷总数与阴离子所带负电荷总数相等。
c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)
⒉物料守恒:关键元素的原子数目之比守恒。
c(Na+)=2[c(CO32-)+ c(HCO3-)+c(H2CO3)]
⒊水的电离守恒:
c(OH-)=c(H+)+ c(HCO3-)+2c(H2CO3)
练习:写出醋酸钠溶液中的三个守恒关系。五、盐溶液中离子浓度间关系“大小比较”
⒈ CH3COONa溶液
c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
⒉Na2CO3溶液
c(Na+)>c(CO32-)> c(OH-)>c(HCO3-)> c(H+)
⒊NH4Cl溶液
c(Cl-)>c(NH4+)> c(H+)>c(OH-)
练习:已知等物质的量浓度醋酸与醋酸钠混合溶液呈酸性,写出混合溶液中各离子浓度大小关系。c(CH3COO-)>c(Na+)>c(H+)>c(OH-)1、0.1mol/l下列溶液PH值由大到小的顺序是 _________________
①H2SO4 ② NH3·H2O ③ NaOH ④NH4Cl ⑤NaCl ⑥CH3COONa ⑦ HCl ⑧ CH3COOH ⑨Ba(OH)2 2、将10 mL0.2 mol/L氨水和10 mL0.1 mol/L盐酸混合后, 溶液里各种离子物质的量浓度的关系是 ( )
A. c (Cl-) + c (OH-) = c(NH4+) + c (H+)
B. c (Cl-)> c(NH4+)> c (H+) > c (OH-)
C. c(NH4+) > c (Cl--)> c (OH-)> c (H+)
D. c (Cl-)> c (H+) > c (NH4+) > c (OH-)AC⑨>③>②>⑥>⑤>④>⑧>⑦>①练习:
