第一节 无机非金属材料的主角-硅(湖南省永州市江华瑶族自治县)
文档属性
| 名称 | 第一节 无机非金属材料的主角-硅(湖南省永州市江华瑶族自治县) |  | |
| 格式 | rar | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2007-12-16 14:14:00 | ||
图片预览






文档简介
课件17张PPT。江华二中化学组
奉飞活第四章 非金属及其化合物
第一节 无机非金属材料的主角——硅第四章 非金属及其化合物第一节 无机非金属材料的主角——硅地壳中硅的含量仅次于氧,为26.3%,
由硅酸盐构成的岩石、 沙子和土壤,
约占地壳的90%以上。
2 、存在方式:硅是亲氧元素,在自然界的存在形式: 氧化物SiO2 和 硅酸盐。
单质硅有晶体和无定形两种。
一、硅
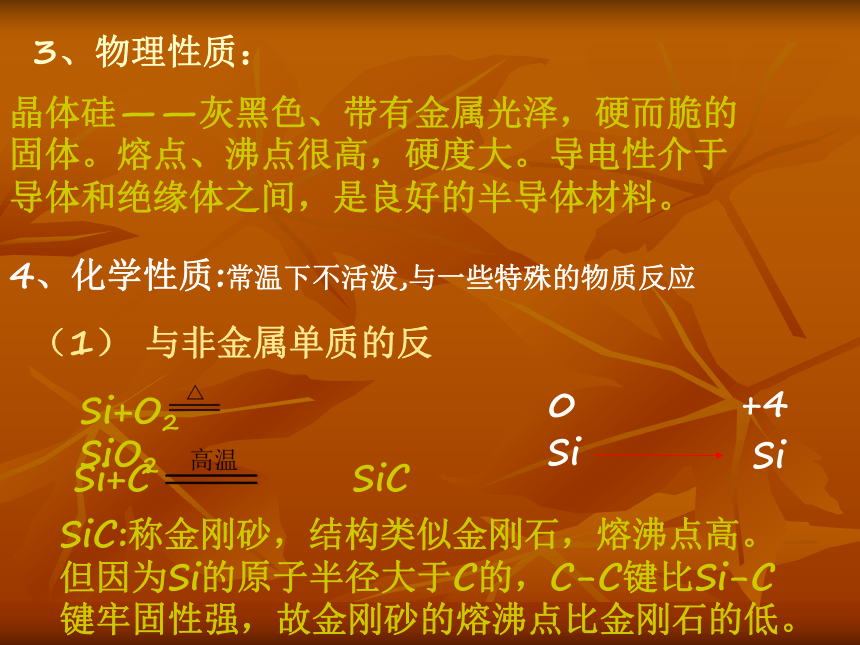
1、结构:位于第三周期,第IV A族位于碳的下方。原子最外层有4个电子。原子结构示意图:特点:难得电子,难失电子.3、物理性质:晶体硅——灰黑色、带有金属光泽,硬而脆的
固体。熔点、沸点很高,硬度大。导电性介于
导体和绝缘体之间,是良好的半导体材料。4、化学性质:常温下不活泼,与一些特殊的物质反应(1) 与非金属单质的反
Si+O2 SiO2SiC:称金刚砂,结构类似金刚石,熔沸点高。但因为Si的原子半径大于C的,C-C键比Si-C键牢固性强,故金刚砂的熔沸点比金刚石的低。Si+2Cl2 SiCl4Si+4 HF = SiF4 + 2H2↑Si+2 F2 = SiF4SiF4:是一种强挥发性物质,不是盐。(2)与酸的反应提问:Si是否与HCl 、HNO3 、H2SO4反应呢?回答:不反应。小结:Si与唯一酸HF酸反应,与其它酸不反应。(3)与强碱的反应Si + 2NaOH + H2O = Na2SiO3 + 2H2↑
特点:放出H2,与AL和强反应碱相似生成盐和气体,水依然是氧化剂而不是氢氧化钠。提问:等物质的量的下列物质与足量的烧碱溶液反应得到气体最多的是( )
A 、Na B 、Mg C 、AL D 、SiD4、硅的工业制法
制粗硅:SiO2+2C Si+2CO↑制纯硅:Si+2Cl2 SiCl4SiCl4+2H2 Si+4HCl↑5、用途:半导体、光电池、计算机芯片。二、二氧化硅 SiO21、存在:广泛存在自然界中,天然的SiO2 叫硅石,约占地壳质量的12%,是岩石的主要成分。有结晶形和无定形两种形态。结晶SiO2 也叫石英。3、物理性质:SiO2 是坚硬的难熔的
固体,不溶于水,纯
净的SiO2 晶体为无色
透明的固体。水晶是
其中的一种。2、结构:每个 Si 与 4个 O 结合,每个 O 与 两个 Si 结合。构成立体网状结构,与金刚石的结构类似。 Si : O=1 : 2 只表示其
结构中的 个数比,其没
有分子式,只有化学式。4、化学性质(与CO2性质比较)(2)与H2的反应但CO2不反应SiO2+2H2 Si+2H2O(3)与HF酸的反应:SiO2 + 4HF = SiF4 ↑+ 2H2O1)SiO2 只与唯一酸HF酸反应,与其它酸不反应。2)HF酸的保存:不能用玻璃瓶盛装而用胶袋装。3)本反应用于雕刻各种花纹玻璃。(方法:在玻璃上涂满薄薄的一层石蜡,用雕刻笔雕好所要的花纹,再倒上HF酸即可。)小结:(1)与H2O的反应 SiO2与水不反应,但CO2与水反应生成弱酸H2CO3.(4)与碱性氧化物CaO等反应(CO2也反应生成盐)SiO2+CaO CaSiO3(5)与强碱(NaOH 、 KOH)的反应(CO2也反应生成盐和水)SiO2 + 2NaOH = Na2SiO3 + H2O小结:1)证明SiO2是酸性氧化物。2)盛放NaOH溶液时不能用磨口玻璃塞
而用橡胶塞或软木塞。 3) Na2SiO3的水溶液称水玻璃,具有粘稠性。 5、用途光导纤维、石英玻璃、光学仪器、装饰品。练习:
1、已知玻璃的主要成分之一是 SiO2 ,下列物质
中,不能用玻璃来盛装的是 ( )
烧碱溶液 B. 浓硫酸
C. 氢氟酸 D. 碳酸钠溶液
2、下列反应能说明 SiO2 是酸性氧化物的是( )
A. SiO2+2C Si+2CO↑ B. SiO2 + 2NaOH = Na2SiO3 + H2OC. SiO2 + HF = SiF4 ↑+ 2H2OD. SiO2+CaCO3 CaSiO3+CO2↑CB作业:(1)预习硅酸和硅酸盐部分。(2)课本第69页第3、4题。
奉飞活第四章 非金属及其化合物
第一节 无机非金属材料的主角——硅第四章 非金属及其化合物第一节 无机非金属材料的主角——硅地壳中硅的含量仅次于氧,为26.3%,
由硅酸盐构成的岩石、 沙子和土壤,
约占地壳的90%以上。
2 、存在方式:硅是亲氧元素,在自然界的存在形式: 氧化物SiO2 和 硅酸盐。
单质硅有晶体和无定形两种。
一、硅
1、结构:位于第三周期,第IV A族位于碳的下方。原子最外层有4个电子。原子结构示意图:特点:难得电子,难失电子.3、物理性质:晶体硅——灰黑色、带有金属光泽,硬而脆的
固体。熔点、沸点很高,硬度大。导电性介于
导体和绝缘体之间,是良好的半导体材料。4、化学性质:常温下不活泼,与一些特殊的物质反应(1) 与非金属单质的反
Si+O2 SiO2SiC:称金刚砂,结构类似金刚石,熔沸点高。但因为Si的原子半径大于C的,C-C键比Si-C键牢固性强,故金刚砂的熔沸点比金刚石的低。Si+2Cl2 SiCl4Si+4 HF = SiF4 + 2H2↑Si+2 F2 = SiF4SiF4:是一种强挥发性物质,不是盐。(2)与酸的反应提问:Si是否与HCl 、HNO3 、H2SO4反应呢?回答:不反应。小结:Si与唯一酸HF酸反应,与其它酸不反应。(3)与强碱的反应Si + 2NaOH + H2O = Na2SiO3 + 2H2↑
特点:放出H2,与AL和强反应碱相似生成盐和气体,水依然是氧化剂而不是氢氧化钠。提问:等物质的量的下列物质与足量的烧碱溶液反应得到气体最多的是( )
A 、Na B 、Mg C 、AL D 、SiD4、硅的工业制法
制粗硅:SiO2+2C Si+2CO↑制纯硅:Si+2Cl2 SiCl4SiCl4+2H2 Si+4HCl↑5、用途:半导体、光电池、计算机芯片。二、二氧化硅 SiO21、存在:广泛存在自然界中,天然的SiO2 叫硅石,约占地壳质量的12%,是岩石的主要成分。有结晶形和无定形两种形态。结晶SiO2 也叫石英。3、物理性质:SiO2 是坚硬的难熔的
固体,不溶于水,纯
净的SiO2 晶体为无色
透明的固体。水晶是
其中的一种。2、结构:每个 Si 与 4个 O 结合,每个 O 与 两个 Si 结合。构成立体网状结构,与金刚石的结构类似。 Si : O=1 : 2 只表示其
结构中的 个数比,其没
有分子式,只有化学式。4、化学性质(与CO2性质比较)(2)与H2的反应但CO2不反应SiO2+2H2 Si+2H2O(3)与HF酸的反应:SiO2 + 4HF = SiF4 ↑+ 2H2O1)SiO2 只与唯一酸HF酸反应,与其它酸不反应。2)HF酸的保存:不能用玻璃瓶盛装而用胶袋装。3)本反应用于雕刻各种花纹玻璃。(方法:在玻璃上涂满薄薄的一层石蜡,用雕刻笔雕好所要的花纹,再倒上HF酸即可。)小结:(1)与H2O的反应 SiO2与水不反应,但CO2与水反应生成弱酸H2CO3.(4)与碱性氧化物CaO等反应(CO2也反应生成盐)SiO2+CaO CaSiO3(5)与强碱(NaOH 、 KOH)的反应(CO2也反应生成盐和水)SiO2 + 2NaOH = Na2SiO3 + H2O小结:1)证明SiO2是酸性氧化物。2)盛放NaOH溶液时不能用磨口玻璃塞
而用橡胶塞或软木塞。 3) Na2SiO3的水溶液称水玻璃,具有粘稠性。 5、用途光导纤维、石英玻璃、光学仪器、装饰品。练习:
1、已知玻璃的主要成分之一是 SiO2 ,下列物质
中,不能用玻璃来盛装的是 ( )
烧碱溶液 B. 浓硫酸
C. 氢氟酸 D. 碳酸钠溶液
2、下列反应能说明 SiO2 是酸性氧化物的是( )
A. SiO2+2C Si+2CO↑ B. SiO2 + 2NaOH = Na2SiO3 + H2OC. SiO2 + HF = SiF4 ↑+ 2H2OD. SiO2+CaCO3 CaSiO3+CO2↑CB作业:(1)预习硅酸和硅酸盐部分。(2)课本第69页第3、4题。
