高二化学分子的立体结构 新课标 人教版 选修3(安徽省滁州市)
文档属性
| 名称 | 高二化学分子的立体结构 新课标 人教版 选修3(安徽省滁州市) |  | |
| 格式 | rar | ||
| 文件大小 | 3.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2007-12-24 08:00:00 | ||
图片预览




文档简介
课件24张PPT。分子的立体结构
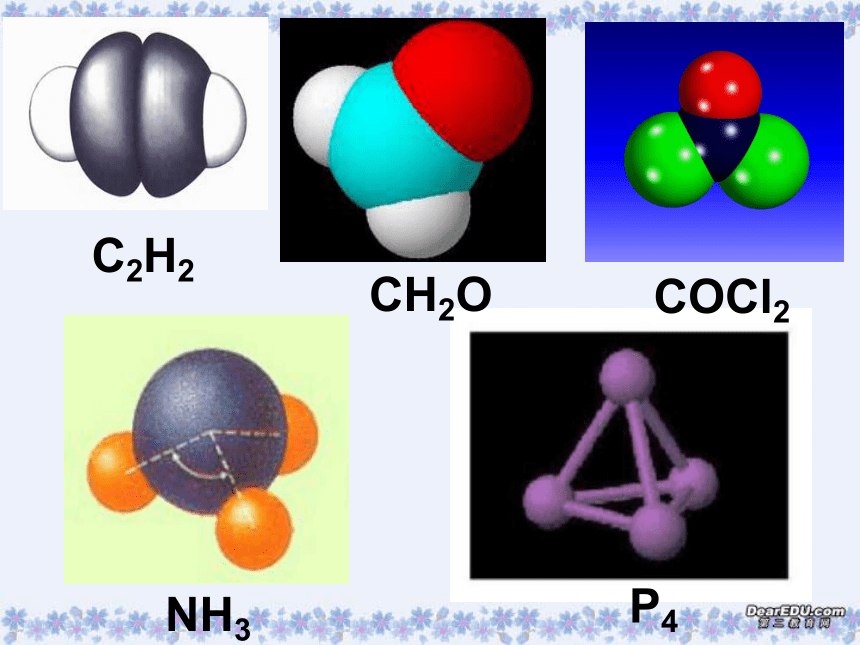
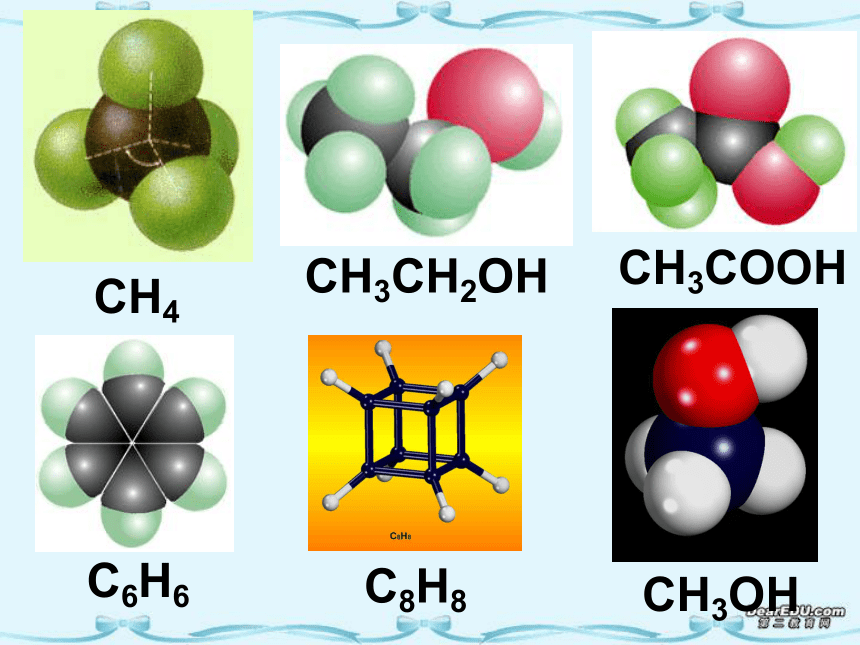
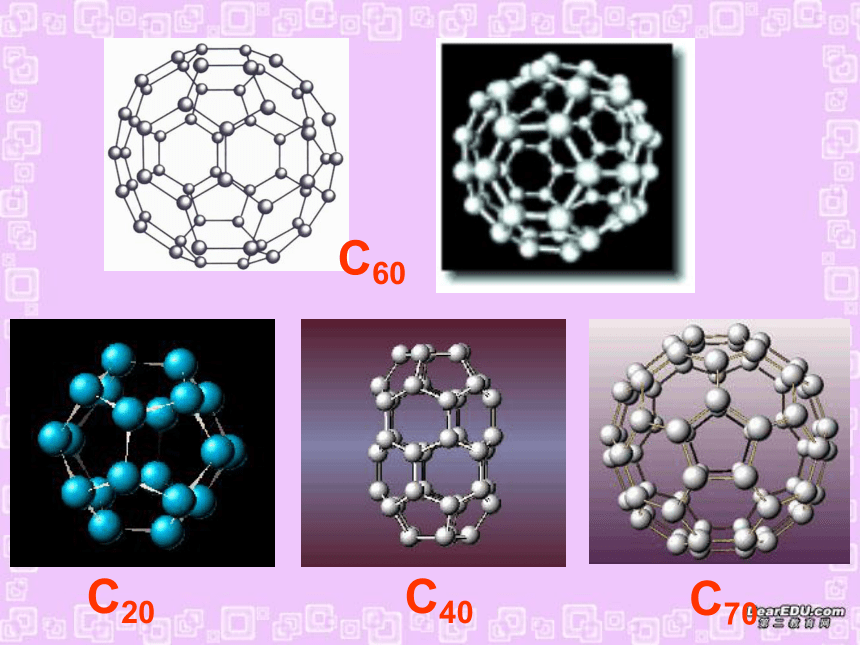
(第一课时)一、形形色色的分子O2HClH2OCO2C2H2CH2OCOCl2NH3P4CH4CH3CH2OHCH3COOHC6H6C8H8CH3OHC60C20C40C70三原子分子立体结构:有直线形C02 、CS2等,V形如H2O、S02等。
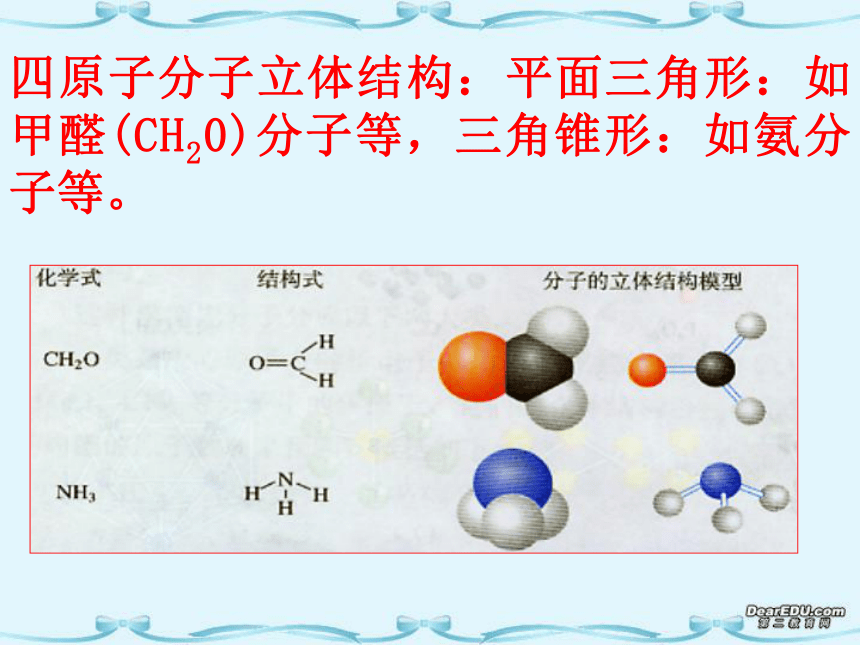
例如:四原子分子立体结构:平面三角形:如甲醛(CH20)分子等,三角锥形:如氨分子等。
五原子分子立体结构:正四面体形如甲烷、P4等。
肉眼不能看到分子,那么,科学家是怎样知道分子的形状的呢?早年的科学家主要靠对物质的宏观性质进行系统总结得出规律后进行推测,如今,科学家已经创造了许许多多测定分子结构的现代仪器,红外光谱就是其中的一种。
分子中的原子不是固定不动的,而是不断地振动着的。所谓分子立体结构其实只是分子中的原子处于平衡位置时的模型。当一束红外线透过分子时,分子会吸收跟它的某些化学键的振动频率相同的红外线,再记录到图谱上呈现吸收峰。通过计算机模拟,可以得知各吸收峰是由哪一个化学键、哪种振动方式引起的,综合这些信息,可分析出分子的立体结构。科学视野—分子的立体结构是怎样测定的?测分子体结构:红外光谱仪→吸收峰→分析。
思考: 同为三原子分子,CO2 和 H2O 分子的空间结构却不同,什么原因? 同为四原子分子,CH2O与 NH3 分子的的空间结构也不同,什么原因?探究与讨论:1、写出H、C、N、O等原子的电子式:1234 2、写出CO2、H2O、NH3、CH2O、CH4等分子的电子式、结构式及分子的空间结构:O=C=OH-O-H无有有无无直线形V 形三角
锥 形 平面
三角形 正
四面体直线形平面三角形正四面体V 形三角锥形小结:价层电子对互斥模型应用反馈:0120100022233444直线形 V 形V 型平面三角形三角锥形四面体正四面体正四面体SO42-04正四面体一.1994年度诺贝尔化学奖授予为研究臭氧作出特殊贡献的化学家。O3能吸收有害紫外线,保护人类赖以生存的空间。O3分子的结构如右图:呈V型,键角116.5o。三个原子以一个O原子为中心,与另外两个O原子分别构成一个非极性共价键;中间O原子提供2个电子,旁边两个O原子各提供1个电子,构成一个特殊的化学键(虚线内部分)——三个O原子均等地享有这4个电子。请回答:
1.臭氧与氧气的关系是练习2.下列物质的分子与O3分子的结构最相似的是
a、 H2O b、 CO2 c、 SO2 d、 BeCl2
3.分子中某1原子有1对没有跟其它原子共用电
子叫孤对电子,那么O3分子有 对孤对电子
4.O3分子是否为极性分子 (是or否)参考答案
1.同素异形体,因为氧气和臭氧是同一元素形成的不同的单质。
2.C 3.5 4.是
★价层电子对互斥模型(VSEPR模型)是一种可以用来预测分子立体结构的理论模型,总的原则是分子的中心原子上孤对电子对与成键电子对之间的排斥力最小(注意:分子中的双键、叁键等多重键要作为一对电子看待)。 这种理论把分子分为两类:一类是中心原子上的价电子都用于形成共价键,这种分子中,中心原子周围的原子数决定着分子的立体结构。 如HCN的空间结构为直线形;另一类是中心原子上有孤对电子(未用于形成共价键的电子)的分子,由于中心原子上的孤对电子也要占据中心原子周围的空间,并参与互相排斥。所以H2O的空间结构为V形。一类是中心原子上的价电子都用于形成共价键,这种分子中,中心原子周围的原子数决定着分子的立体结构。 ,如C02、CH20、CH4等分子中的碳原子,它们的立体结构可用中心原子周围的原子数n来预测,概括如下:
ABn 立体结构 范例
n=2 直线型 C02
n=3 平面三角形CH20
n=4 正四面体型CH4
另一类是中心原子上有孤对电子(未用于形成共价键的电子对)的分子,如H2O和NH3,中心原子上的孤对电子也要占据中心原子周围的空间,并参与互相排斥。例如,H20和NH3的中心原子工分别有2对和l对孤对电子,跟中心原子周围的σ键加起来都是4,它们相互排斥,形成四面体,因而H:O分子呈V形,NH3分子呈三角锥形。
(第一课时)一、形形色色的分子O2HClH2OCO2C2H2CH2OCOCl2NH3P4CH4CH3CH2OHCH3COOHC6H6C8H8CH3OHC60C20C40C70三原子分子立体结构:有直线形C02 、CS2等,V形如H2O、S02等。
例如:四原子分子立体结构:平面三角形:如甲醛(CH20)分子等,三角锥形:如氨分子等。
五原子分子立体结构:正四面体形如甲烷、P4等。
肉眼不能看到分子,那么,科学家是怎样知道分子的形状的呢?早年的科学家主要靠对物质的宏观性质进行系统总结得出规律后进行推测,如今,科学家已经创造了许许多多测定分子结构的现代仪器,红外光谱就是其中的一种。
分子中的原子不是固定不动的,而是不断地振动着的。所谓分子立体结构其实只是分子中的原子处于平衡位置时的模型。当一束红外线透过分子时,分子会吸收跟它的某些化学键的振动频率相同的红外线,再记录到图谱上呈现吸收峰。通过计算机模拟,可以得知各吸收峰是由哪一个化学键、哪种振动方式引起的,综合这些信息,可分析出分子的立体结构。科学视野—分子的立体结构是怎样测定的?测分子体结构:红外光谱仪→吸收峰→分析。
思考: 同为三原子分子,CO2 和 H2O 分子的空间结构却不同,什么原因? 同为四原子分子,CH2O与 NH3 分子的的空间结构也不同,什么原因?探究与讨论:1、写出H、C、N、O等原子的电子式:1234 2、写出CO2、H2O、NH3、CH2O、CH4等分子的电子式、结构式及分子的空间结构:O=C=OH-O-H无有有无无直线形V 形三角
锥 形 平面
三角形 正
四面体直线形平面三角形正四面体V 形三角锥形小结:价层电子对互斥模型应用反馈:0120100022233444直线形 V 形V 型平面三角形三角锥形四面体正四面体正四面体SO42-04正四面体一.1994年度诺贝尔化学奖授予为研究臭氧作出特殊贡献的化学家。O3能吸收有害紫外线,保护人类赖以生存的空间。O3分子的结构如右图:呈V型,键角116.5o。三个原子以一个O原子为中心,与另外两个O原子分别构成一个非极性共价键;中间O原子提供2个电子,旁边两个O原子各提供1个电子,构成一个特殊的化学键(虚线内部分)——三个O原子均等地享有这4个电子。请回答:
1.臭氧与氧气的关系是练习2.下列物质的分子与O3分子的结构最相似的是
a、 H2O b、 CO2 c、 SO2 d、 BeCl2
3.分子中某1原子有1对没有跟其它原子共用电
子叫孤对电子,那么O3分子有 对孤对电子
4.O3分子是否为极性分子 (是or否)参考答案
1.同素异形体,因为氧气和臭氧是同一元素形成的不同的单质。
2.C 3.5 4.是
★价层电子对互斥模型(VSEPR模型)是一种可以用来预测分子立体结构的理论模型,总的原则是分子的中心原子上孤对电子对与成键电子对之间的排斥力最小(注意:分子中的双键、叁键等多重键要作为一对电子看待)。 这种理论把分子分为两类:一类是中心原子上的价电子都用于形成共价键,这种分子中,中心原子周围的原子数决定着分子的立体结构。 如HCN的空间结构为直线形;另一类是中心原子上有孤对电子(未用于形成共价键的电子)的分子,由于中心原子上的孤对电子也要占据中心原子周围的空间,并参与互相排斥。所以H2O的空间结构为V形。一类是中心原子上的价电子都用于形成共价键,这种分子中,中心原子周围的原子数决定着分子的立体结构。 ,如C02、CH20、CH4等分子中的碳原子,它们的立体结构可用中心原子周围的原子数n来预测,概括如下:
ABn 立体结构 范例
n=2 直线型 C02
n=3 平面三角形CH20
n=4 正四面体型CH4
另一类是中心原子上有孤对电子(未用于形成共价键的电子对)的分子,如H2O和NH3,中心原子上的孤对电子也要占据中心原子周围的空间,并参与互相排斥。例如,H20和NH3的中心原子工分别有2对和l对孤对电子,跟中心原子周围的σ键加起来都是4,它们相互排斥,形成四面体,因而H:O分子呈V形,NH3分子呈三角锥形。
