原子的构成
图片预览





文档简介
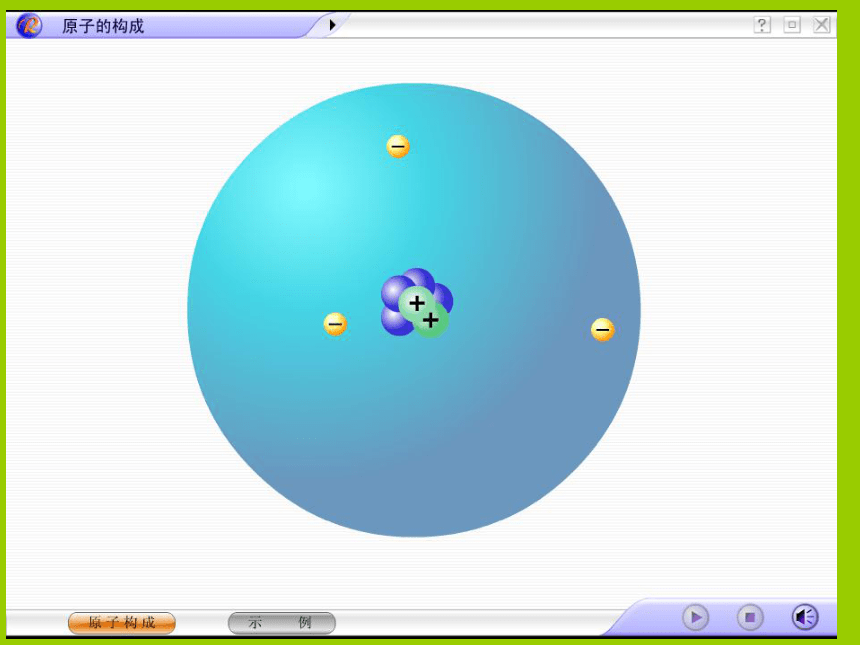
课件24张PPT。第四单元 物质构成的奥秘课题1 原子的构成我国成功爆炸第一颗原子弹 在化学变化中原子是不能再分的。原子是一个实心球体吗?
用其他方法能否将原子继续分下去?若能,它又可以分为哪几部分?
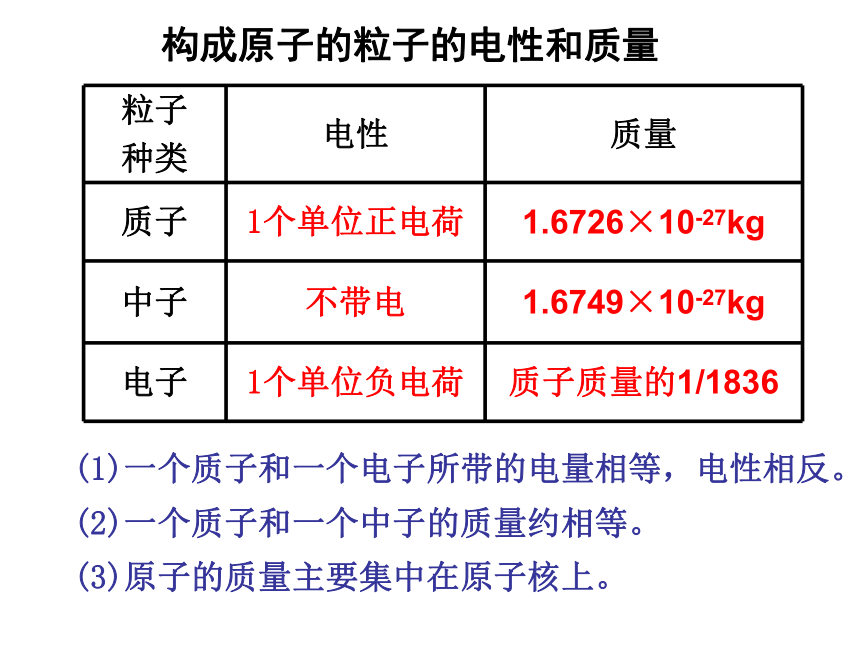
构成原子的粒子的电性和质量 (1)一个质子和一个电子所带的电量相等,电性相反。(2)一个质子和一个中子的质量约相等。(3)原子的质量主要集中在原子核上。一.原子的结构 :原子
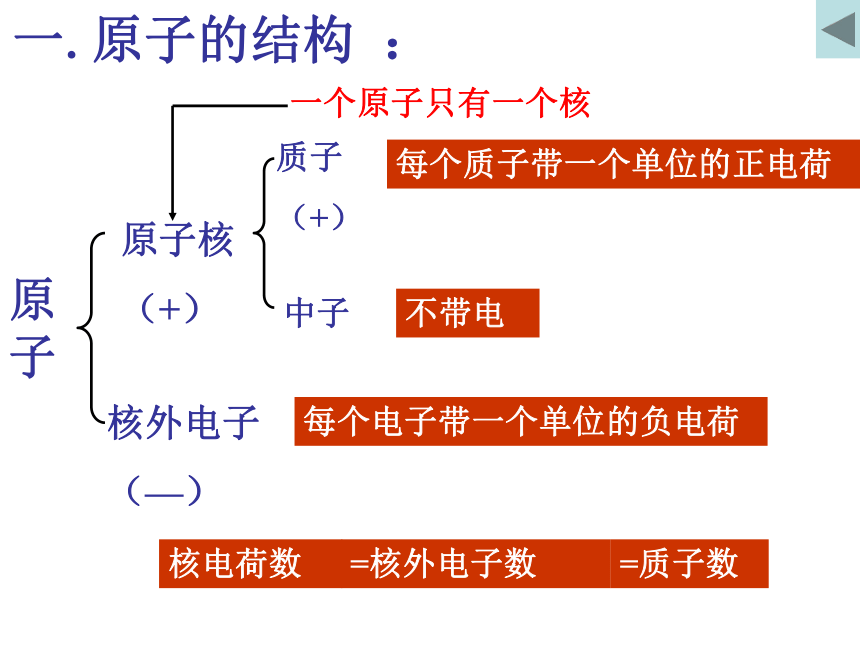
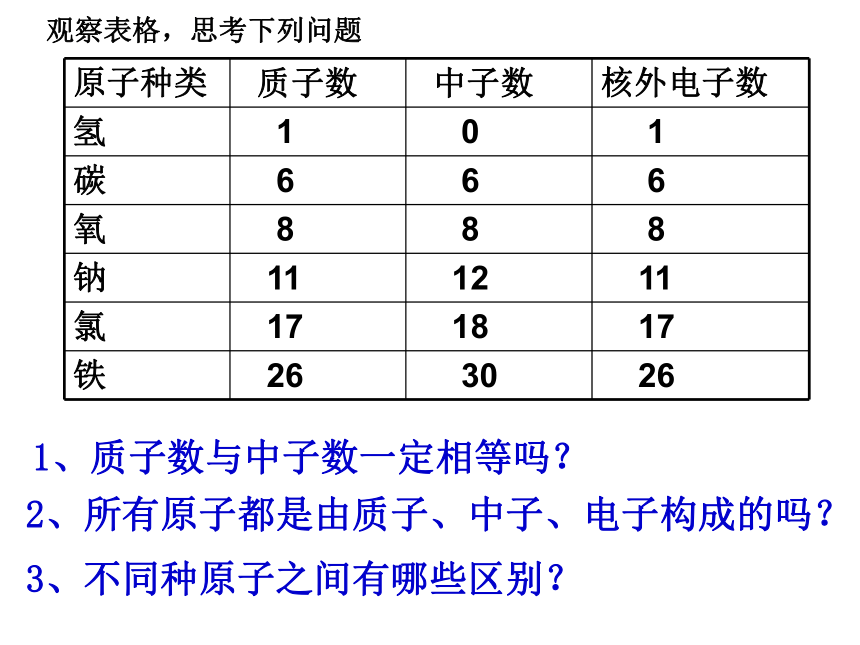
每个质子带一个单位的正电荷不带电每个电子带一个单位的负电荷观察表格,思考下列问题2、所有原子都是由质子、中子、电子构成的吗?3、不同种原子之间有哪些区别?1、质子数与中子数一定相等吗?1、原子构成的规律: ⑴、原子核所带的电荷数简称为核电荷数⑵、核电荷数=质子数=核外电子数=原子序数 ⑶、质 子 数 不 一 定 等 于 中 子 数
原 子 的 质 量 主 要 集 中 在 原 子 核 上
⑷ 、原 子 中 不 一 定 含 有 中 子(氢原子)
⑸、不种类的原子,其核内质子数和核
外电子数都不相同
2、原子不显电性的原因: 由于原子核所带电量和核外电子的
电量相等,但电性相反,所以整个原
子不显电性。课堂练习1、将①分子②原子③质子④中子⑤电子等粒子用序号分别填 入下列适当空格中:
(1)构成物质的基本粒子是________________
(2)构成原子的基本粒子是________________
(3)显电中性的粒子是________________
(4)带正电的粒子是________________
(5)参加化学反应一定发生变化的粒子是____________
(6)原子中数目一定相等的粒子是_______________
①②③④⑤①②④③①③⑤ 2、 一个原子共有40个粒子,其中14个粒子不显电性,则质子数和电子数各为多少?13原子体积很小原子核原子原子核比原子小得多说明:由于原子的质量数值太小,书写使用不方便,所以采用相对原子质量 以一种碳原子的质量的1/12(约1.66×10-27kg)作为标准,其他原子的质量跟它比较所得的值,就是这种原子的相对原子质量。二、相对原子质量
1.概念: 2.计算式: 某原子的相对原子质量
一个该原子的实际质量(kg)
= ─────────────
一个碳原子的实际质量 (kg) × 1/12
3.原子的质量与其相对原子质量成正比
4.相对原子质量是一个比值,国际单位制为1
找规律:相对原子质量的近似值与该原子的质子数,中子数的关系规律:相对原子质量=质子数+中子数三.填表:
66128816111211161616121224
相对原子质量=质子数 +中子数
核电荷数 =质子数= 核外电子数课堂练习下列叙述正确的是 ( )
A 原子核都由质子和中子构成
B 在原子中,核内的质子数与核外的电子数不一定相等
C 原子里有相对很大的空间,电子在这个空间里作高速运动
D 不同种类的原子,核内的质子数不同,核外电子数也不同C、D2.完成下列简表
??????????????????????????????????????????????????????????????????????????????????????????????????????????????? 4、已知一个碳12原子的质量为nKg,一个氧原子的质量为mkg,则氧的相对原子质量为 . 5、 碳和镁的相对原子质量分别是12和24,则碳和镁的原子质量之比为 ( )
A. 12:12 B. 2:12
C. 2:1 D. 1:23、某原子R的相对原子质量为m,核内有n个质子,其核内的中子数为___________,核外电子数为_____________.6、 碳原子的质量为a克,某原子的质量为b克, 则该原子的相对原子质量为 。 7、已知铁、镁的相对原子质量分别为56、24,
⑴.相同原子个数时,则它们的原子质量之比_______
⑵.铁、镁的原子个数之比分别为2:7,则它们的质量之比____________
用其他方法能否将原子继续分下去?若能,它又可以分为哪几部分?
构成原子的粒子的电性和质量 (1)一个质子和一个电子所带的电量相等,电性相反。(2)一个质子和一个中子的质量约相等。(3)原子的质量主要集中在原子核上。一.原子的结构 :原子
每个质子带一个单位的正电荷不带电每个电子带一个单位的负电荷观察表格,思考下列问题2、所有原子都是由质子、中子、电子构成的吗?3、不同种原子之间有哪些区别?1、质子数与中子数一定相等吗?1、原子构成的规律: ⑴、原子核所带的电荷数简称为核电荷数⑵、核电荷数=质子数=核外电子数=原子序数 ⑶、质 子 数 不 一 定 等 于 中 子 数
原 子 的 质 量 主 要 集 中 在 原 子 核 上
⑷ 、原 子 中 不 一 定 含 有 中 子(氢原子)
⑸、不种类的原子,其核内质子数和核
外电子数都不相同
2、原子不显电性的原因: 由于原子核所带电量和核外电子的
电量相等,但电性相反,所以整个原
子不显电性。课堂练习1、将①分子②原子③质子④中子⑤电子等粒子用序号分别填 入下列适当空格中:
(1)构成物质的基本粒子是________________
(2)构成原子的基本粒子是________________
(3)显电中性的粒子是________________
(4)带正电的粒子是________________
(5)参加化学反应一定发生变化的粒子是____________
(6)原子中数目一定相等的粒子是_______________
①②③④⑤①②④③①③⑤ 2、 一个原子共有40个粒子,其中14个粒子不显电性,则质子数和电子数各为多少?13原子体积很小原子核原子原子核比原子小得多说明:由于原子的质量数值太小,书写使用不方便,所以采用相对原子质量 以一种碳原子的质量的1/12(约1.66×10-27kg)作为标准,其他原子的质量跟它比较所得的值,就是这种原子的相对原子质量。二、相对原子质量
1.概念: 2.计算式: 某原子的相对原子质量
一个该原子的实际质量(kg)
= ─────────────
一个碳原子的实际质量 (kg) × 1/12
3.原子的质量与其相对原子质量成正比
4.相对原子质量是一个比值,国际单位制为1
找规律:相对原子质量的近似值与该原子的质子数,中子数的关系规律:相对原子质量=质子数+中子数三.填表:
66128816111211161616121224
相对原子质量=质子数 +中子数
核电荷数 =质子数= 核外电子数课堂练习下列叙述正确的是 ( )
A 原子核都由质子和中子构成
B 在原子中,核内的质子数与核外的电子数不一定相等
C 原子里有相对很大的空间,电子在这个空间里作高速运动
D 不同种类的原子,核内的质子数不同,核外电子数也不同C、D2.完成下列简表
??????????????????????????????????????????????????????????????????????????????????????????????????????????????? 4、已知一个碳12原子的质量为nKg,一个氧原子的质量为mkg,则氧的相对原子质量为 . 5、 碳和镁的相对原子质量分别是12和24,则碳和镁的原子质量之比为 ( )
A. 12:12 B. 2:12
C. 2:1 D. 1:23、某原子R的相对原子质量为m,核内有n个质子,其核内的中子数为___________,核外电子数为_____________.6、 碳原子的质量为a克,某原子的质量为b克, 则该原子的相对原子质量为 。 7、已知铁、镁的相对原子质量分别为56、24,
⑴.相同原子个数时,则它们的原子质量之比_______
⑵.铁、镁的原子个数之比分别为2:7,则它们的质量之比____________
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
