选修4总复习学案
图片预览

文档简介
《化学反应原理》复习学案
【教学目标】
为了迎接期末考试,针对本册书中的重难点、极容易出错容易忽略的知识点进行练习、复习
【应掌握的知识点】
化学反应中的能量变化、化学反应速率和化学平衡的关系、水溶液中的离子平衡、电化学
【教学重点】化学反应原理的理解及综合应用
【教学方法】 以练带复
【教学流程】师生互动部分
化学反应中的能量变化
考点一、用键能来解释化学反应中的能量问题
练习1、已知H2的化学键能为:436KJ/mol Cl2的化学键键能为:243KJ/mol HCl的化学键键能为 431KJ/mol,通过计算回答氢气和氯气生成氯化氢是吸热还是放热反应?
考点二、吸热反应与放热反应
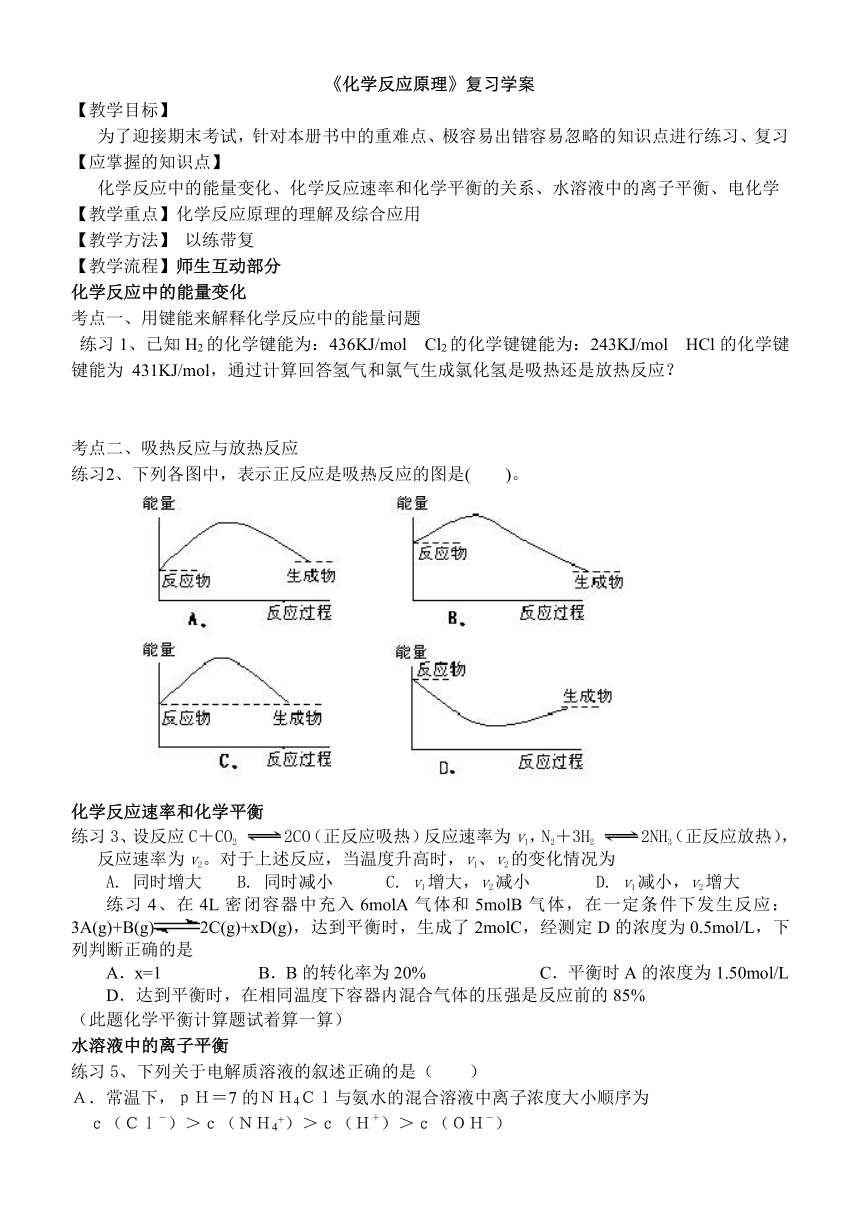
练习2、下列各图中,表示正反应是吸热反应的图是( )。
化学反应速率和化学平衡
练习3、设反应C+CO2 2CO(正反应吸热)反应速率为v1,N2+3H2 2NH3(正反应放热),反应速率为v2。对于上述反应,当温度升高时,v1、v2的变化情况为
A. 同时增大 B. 同时减小 C. v1增大,v2减小 D. v1减小,v2增大
练习4、在4L密闭容器中充入6molA气体和5molB气体,在一定条件下发生反应:3A(g)+B(g)2C(g)+xD(g),达到平衡时,生成了2molC,经测定D的浓度为0.5mol/L,下列判断正确的是
A.x=1 B.B的转化率为20% C.平衡时A的浓度为1.50mol/L
D.达到平衡时,在相同温度下容器内混合气体的压强是反应前的85%
(此题化学平衡计算题试着算一算)
水溶液中的离子平衡
练习5、下列关于电解质溶液的叙述正确的是( )
A.常温下,pH=7的NH4Cl与氨水的混合溶液中离子浓度大小顺序为
c(Cl-)>c(NH4+)>c(H+)>c(OH-)
B.将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低
C.中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同
D.常温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液的pH大
练习6、已知0.1mol/L的二元酸H2A溶液的pH = 4,则下列说法中正确的是 ( C )
A.在Na2A、NaHA两溶液中,离子种类不相同
B.在溶质物质的量相等的Na2A、NaHA两溶液中,离子总数相等
C.在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+ c (OH-) + 2c (A2-)
D.在Na2A溶液中一定有:c (Na+) > c (A2-) > c (H+) > c (OH-)
电化学部分
考点一、原电池、电解池两极的反应类型
原电池的两极确定:失去电子的一极叫负极,用 - 表示;
得到电子的一极叫正极,用 + 表示。
电解池两极的判断
阴极:与电源( )极相连;发生还愿反应; 阴极:与电源( )极相连;发生氧化反应
练习7、镍氢电池是近年来开发出来的可充电电池,它可以取代会产生镉污染的镍镉电池。镍氢电池的总反应式是:H2+NiO(OH) Ni(OH)2。根据此反应式判断,下列叙述中正确的是( )
A.电池放电时,氢元素被氧化 B.电池放电时,镍元素被氧化
C.电池充电时,氢元素被还原 D.电池放电时,氢气是负极
考点二、电解方程式的写法
归纳起来,电解质溶液的电解分为下列四种类型
CuSO4型,类似的有AgNO3 、Cu(NO3);NaCl型; CuCl2 型;Na2SO4 型类似的有NaOH 、H2SO4等;
考点三、原电池、电解池的应用
化学电源、金属的腐蚀与防护、电解饱和食盐水、电镀铜、铜的精炼
练习8、电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时, 同时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应式为 。在X极附近观察到的现象是 。
②Y电极上的电极反应式为 ,检验该电极反应产物的方法是
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的材料是 ,电极反应式是 。
②Y电极的材料是 ,电极反应式是 。
〖反馈练习〗
1、已知常温时红磷比白磷稳定,在下列反应中:
4P(白磷,s)+5O2(g)====2P2O5(s);△H=== -a kJ/mol
4P(红磷,s)+5O2(g)====2P2O5(s);△H=== -b kJ/mol
若a、b均大于零,则a和b的关系为 ( )
A.a<b B.a=b C.a>b D.无法确定
2、25℃、101 kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5 kJ/mol、285.8 kJ/mol
890.3 kJ/mol、2800 kJ/mol,则下列热化学方程式正确的是
A.C(s)+O2(g)=CO(g) △H= ―393.5 kJ/mol
B.2H2(g)+O2(g)=2H2O(l) △H= +571.6 kJ/mol
C.CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H= ―890.3 kJ/mol
D.C6H12O6(s) +6O2(g)=6CO2(g)+6H2O(l) △H=―2800 kJ/mol
3.在373 K时,把0.5 mol N2O4通入体积为5 L的真空密闭容器中,立即出现棕色。反应进行到2 s时,NO2的浓度为0.02 mol·L-1。在60 s时,体系已达平衡,此时容器内压强为开始的1.6倍。 下列说法正确的是
A. 前2 s,以N2O4的浓度表示的平衡反应速率为0. 01 mol·L-1·s-1
B. 在2 s时体系内的压强为开始时的1. 1倍
C. 在平衡时体系内含N2O4 0. 25 mol
4.下列事实可证明氨水是弱碱的是 ( )
A . 氨水能跟氯化亚铁溶液反应生成氢氧化亚铁 B . 铵盐受热易分解
C . 0.1mol / L氨水可以使酚酞试液变红 D . 0.1mol / L氯化铵溶液的pH约为5
5、pH=a的某电解质溶液中,插入两支惰性电极通直流电一段时间后,溶液的pH>a,则该电解质可能是
A.NaOH B.H2SO4 C.AgNO3 D.Na2SO4
6、25℃时,用石墨电极电解,溶液,如有电子发生转移,试回答下列问题:
(1)阴极发生 反应,电极反应为 。
(2)阳极发生 反应,电极反应为 。
(3)电解后得到的的质量是 ,得到的体积(标准状况)是 ,溶液的是 。
(4)如用等质量的两块铜片代替石墨作电极,电解后两铜片的质量相差 ,电解液的 (填“变小”、“变大”或“不变”)
〖课下作业〗
1、列各组热化学方程式中,△H1>△H2的是
①C(s)+O2(g)===CO2(g) △H1 C(s)+O2(g)===CO(g) △H2
②S(s)+O2(g)===SO2(g) △H1 S(g)+O2(g)===SO2(g) △H2
③H2(g)+O2(g)===H2O(l) △H1 2H2(g)+O2(g)===2H2O(l) △H2
④CaCO3(s)===CaO(s)+CO2(g) △H1 CaO(s)+H2O(l)===Ca(OH)2(s) △H2
A.① B.④ C.②③④ D.①②③
2、箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出256.7kJ的热量(相当于25℃、101 kPa下测得的热量)。(1)反应的热化学方程式为
(2)又已知H2O(l)=H2O(g) ΔH=+44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出的热量是 kJ。
3、反应2A(g)2B(g)+E(g)(正反应为吸热反应)达到平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是
A. 加压 B. 减压 C. 减少E的浓度 D. 降温
4、现有反应:mA(g)+nB(g)pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1)该反应的逆反应为_________热反应,且m+n_________p(填“>”“=”“<”)。
(2)减压时,A的质量分数_________。(填“增大”“减小”或“不变”,下同)
(3)若加入B(体积不变),则A的转化率_________,B的转化率_________。
(4)若升高温度,则平衡时B、C的浓度之比 将_________。
(5)若加入催化剂,平衡时气体混合物的总物质的量_________。
(6)若B是有色物质,A、C均无色,则加入C(体积不变)时混合物颜色_______,而维持容器内压强不变,充入氖气时,混合物颜色_______(填“变深”“变浅”或“不变”)。
3、列关于铜电极的叙述正确的是( )。
A. 铜锌原电池中铜是负极 B. 用电解法精炼粗铜时粗铜做阴极
C. 在镀件上电镀铜时,可用金属铜做阳极 D. 电解稀硫酸制、时铜做阳极
4、图所示的装置进行电解。通电一会儿,发现湿润的淀粉KI试纸的C端变为蓝色。
(1)A中发生反应的化学方程式为_______________________________________________。 A B
(2)在B中观察到的现象是 。
(3)室温下,若从电解开始到时间t s,A装置中共收集到气体0.56 L(SPT),经测定电解后A中溶液体积恰为1000 mL,则A溶液的pH为______。
A
a
X
Y
PAGE
【教学目标】
为了迎接期末考试,针对本册书中的重难点、极容易出错容易忽略的知识点进行练习、复习
【应掌握的知识点】
化学反应中的能量变化、化学反应速率和化学平衡的关系、水溶液中的离子平衡、电化学
【教学重点】化学反应原理的理解及综合应用
【教学方法】 以练带复
【教学流程】师生互动部分
化学反应中的能量变化
考点一、用键能来解释化学反应中的能量问题
练习1、已知H2的化学键能为:436KJ/mol Cl2的化学键键能为:243KJ/mol HCl的化学键键能为 431KJ/mol,通过计算回答氢气和氯气生成氯化氢是吸热还是放热反应?
考点二、吸热反应与放热反应
练习2、下列各图中,表示正反应是吸热反应的图是( )。
化学反应速率和化学平衡
练习3、设反应C+CO2 2CO(正反应吸热)反应速率为v1,N2+3H2 2NH3(正反应放热),反应速率为v2。对于上述反应,当温度升高时,v1、v2的变化情况为
A. 同时增大 B. 同时减小 C. v1增大,v2减小 D. v1减小,v2增大
练习4、在4L密闭容器中充入6molA气体和5molB气体,在一定条件下发生反应:3A(g)+B(g)2C(g)+xD(g),达到平衡时,生成了2molC,经测定D的浓度为0.5mol/L,下列判断正确的是
A.x=1 B.B的转化率为20% C.平衡时A的浓度为1.50mol/L
D.达到平衡时,在相同温度下容器内混合气体的压强是反应前的85%
(此题化学平衡计算题试着算一算)
水溶液中的离子平衡
练习5、下列关于电解质溶液的叙述正确的是( )
A.常温下,pH=7的NH4Cl与氨水的混合溶液中离子浓度大小顺序为
c(Cl-)>c(NH4+)>c(H+)>c(OH-)
B.将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低
C.中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同
D.常温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液的pH大
练习6、已知0.1mol/L的二元酸H2A溶液的pH = 4,则下列说法中正确的是 ( C )
A.在Na2A、NaHA两溶液中,离子种类不相同
B.在溶质物质的量相等的Na2A、NaHA两溶液中,离子总数相等
C.在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+ c (OH-) + 2c (A2-)
D.在Na2A溶液中一定有:c (Na+) > c (A2-) > c (H+) > c (OH-)
电化学部分
考点一、原电池、电解池两极的反应类型
原电池的两极确定:失去电子的一极叫负极,用 - 表示;
得到电子的一极叫正极,用 + 表示。
电解池两极的判断
阴极:与电源( )极相连;发生还愿反应; 阴极:与电源( )极相连;发生氧化反应
练习7、镍氢电池是近年来开发出来的可充电电池,它可以取代会产生镉污染的镍镉电池。镍氢电池的总反应式是:H2+NiO(OH) Ni(OH)2。根据此反应式判断,下列叙述中正确的是( )
A.电池放电时,氢元素被氧化 B.电池放电时,镍元素被氧化
C.电池充电时,氢元素被还原 D.电池放电时,氢气是负极
考点二、电解方程式的写法
归纳起来,电解质溶液的电解分为下列四种类型
CuSO4型,类似的有AgNO3 、Cu(NO3);NaCl型; CuCl2 型;Na2SO4 型类似的有NaOH 、H2SO4等;
考点三、原电池、电解池的应用
化学电源、金属的腐蚀与防护、电解饱和食盐水、电镀铜、铜的精炼
练习8、电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时, 同时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应式为 。在X极附近观察到的现象是 。
②Y电极上的电极反应式为 ,检验该电极反应产物的方法是
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的材料是 ,电极反应式是 。
②Y电极的材料是 ,电极反应式是 。
〖反馈练习〗
1、已知常温时红磷比白磷稳定,在下列反应中:
4P(白磷,s)+5O2(g)====2P2O5(s);△H=== -a kJ/mol
4P(红磷,s)+5O2(g)====2P2O5(s);△H=== -b kJ/mol
若a、b均大于零,则a和b的关系为 ( )
A.a<b B.a=b C.a>b D.无法确定
2、25℃、101 kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5 kJ/mol、285.8 kJ/mol
890.3 kJ/mol、2800 kJ/mol,则下列热化学方程式正确的是
A.C(s)+O2(g)=CO(g) △H= ―393.5 kJ/mol
B.2H2(g)+O2(g)=2H2O(l) △H= +571.6 kJ/mol
C.CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H= ―890.3 kJ/mol
D.C6H12O6(s) +6O2(g)=6CO2(g)+6H2O(l) △H=―2800 kJ/mol
3.在373 K时,把0.5 mol N2O4通入体积为5 L的真空密闭容器中,立即出现棕色。反应进行到2 s时,NO2的浓度为0.02 mol·L-1。在60 s时,体系已达平衡,此时容器内压强为开始的1.6倍。 下列说法正确的是
A. 前2 s,以N2O4的浓度表示的平衡反应速率为0. 01 mol·L-1·s-1
B. 在2 s时体系内的压强为开始时的1. 1倍
C. 在平衡时体系内含N2O4 0. 25 mol
4.下列事实可证明氨水是弱碱的是 ( )
A . 氨水能跟氯化亚铁溶液反应生成氢氧化亚铁 B . 铵盐受热易分解
C . 0.1mol / L氨水可以使酚酞试液变红 D . 0.1mol / L氯化铵溶液的pH约为5
5、pH=a的某电解质溶液中,插入两支惰性电极通直流电一段时间后,溶液的pH>a,则该电解质可能是
A.NaOH B.H2SO4 C.AgNO3 D.Na2SO4
6、25℃时,用石墨电极电解,溶液,如有电子发生转移,试回答下列问题:
(1)阴极发生 反应,电极反应为 。
(2)阳极发生 反应,电极反应为 。
(3)电解后得到的的质量是 ,得到的体积(标准状况)是 ,溶液的是 。
(4)如用等质量的两块铜片代替石墨作电极,电解后两铜片的质量相差 ,电解液的 (填“变小”、“变大”或“不变”)
〖课下作业〗
1、列各组热化学方程式中,△H1>△H2的是
①C(s)+O2(g)===CO2(g) △H1 C(s)+O2(g)===CO(g) △H2
②S(s)+O2(g)===SO2(g) △H1 S(g)+O2(g)===SO2(g) △H2
③H2(g)+O2(g)===H2O(l) △H1 2H2(g)+O2(g)===2H2O(l) △H2
④CaCO3(s)===CaO(s)+CO2(g) △H1 CaO(s)+H2O(l)===Ca(OH)2(s) △H2
A.① B.④ C.②③④ D.①②③
2、箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出256.7kJ的热量(相当于25℃、101 kPa下测得的热量)。(1)反应的热化学方程式为
(2)又已知H2O(l)=H2O(g) ΔH=+44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出的热量是 kJ。
3、反应2A(g)2B(g)+E(g)(正反应为吸热反应)达到平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是
A. 加压 B. 减压 C. 减少E的浓度 D. 降温
4、现有反应:mA(g)+nB(g)pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1)该反应的逆反应为_________热反应,且m+n_________p(填“>”“=”“<”)。
(2)减压时,A的质量分数_________。(填“增大”“减小”或“不变”,下同)
(3)若加入B(体积不变),则A的转化率_________,B的转化率_________。
(4)若升高温度,则平衡时B、C的浓度之比 将_________。
(5)若加入催化剂,平衡时气体混合物的总物质的量_________。
(6)若B是有色物质,A、C均无色,则加入C(体积不变)时混合物颜色_______,而维持容器内压强不变,充入氖气时,混合物颜色_______(填“变深”“变浅”或“不变”)。
3、列关于铜电极的叙述正确的是( )。
A. 铜锌原电池中铜是负极 B. 用电解法精炼粗铜时粗铜做阴极
C. 在镀件上电镀铜时,可用金属铜做阳极 D. 电解稀硫酸制、时铜做阳极
4、图所示的装置进行电解。通电一会儿,发现湿润的淀粉KI试纸的C端变为蓝色。
(1)A中发生反应的化学方程式为_______________________________________________。 A B
(2)在B中观察到的现象是 。
(3)室温下,若从电解开始到时间t s,A装置中共收集到气体0.56 L(SPT),经测定电解后A中溶液体积恰为1000 mL,则A溶液的pH为______。
A
a
X
Y
PAGE
