高二化学 第二章 分子的性质
文档属性
| 名称 | 高二化学 第二章 分子的性质 |

|
|
| 格式 | rar | ||
| 文件大小 | 635.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2008-01-11 00:00:00 | ||
图片预览








文档简介
课件25张PPT。3 分子的性质一、键的极性和分子的极性极性键与非极性键
(1)何谓共价键?
(2)何谓电负性?
(3)分别以H2、HCl为例,探究电负性对共价键有何影响?
练习与巩固1.含有非极性键的离子化合物是?? (???? )
A.?NaOH B?.Na2O2?
C.NaCl D?.NH4Cl
2.下列元素间形成的共价键中,极性最强的是? (???? )
A.F―F B.H―F
C.H―Cl D.H―O极性分子与非极性分子
(1)由非极性键构成的分子,正电荷的中心和负电荷的中心怎样分布?
(2)以HCl和CH4为例,分析:由极性键形成的分子,怎样找正电荷的中心和负电荷的中心?
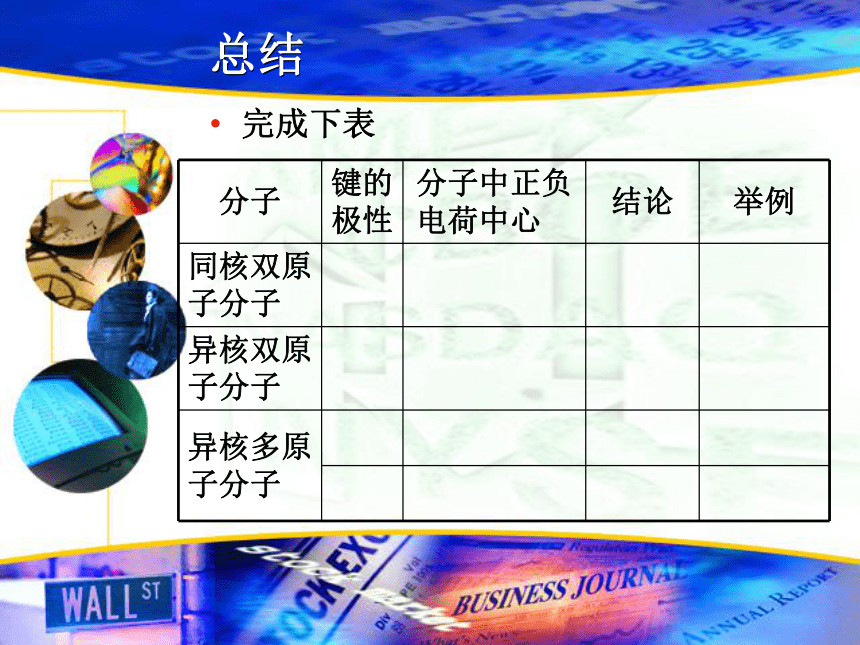
(3)常见的极性分子和非极性分子有哪些?如何简单判断?思考与交流用价层电子对互斥模型画出分子的立体结构模型总结完成下表总结:键的极性与分子极性的关系 A、都是由非极性键构成的分子一定是非极 性分子。
B、极性键结合形成的双原子分子一定为极 性分子。
C、极性键结合形成的多原子分子,可能为 非极性分子,也可能为极性分子。
D、多原子分子的极性,应有键的极性和分子的空间构型共同来决定。
二、范德华力及其对物质性质的影响(1)气体在加压或降温是为什么会变为液体、固体?
(2)仔细观察书中表2-4,结合分子结构的特点和数据,能得出什么结论?
(3)怎样解释卤素单质从F2-I2熔、沸点越来越高?对范德华力的理解①分子间作用力比化学键弱得多,它主要影响物质的熔点、沸点、溶解性等物理性质,而化学键主要影响物质的化学性质。
②分子间作用力只存在于由分子构成的物质之间,离子化合物、圆子化合物、金属之间不存在范德华力。
③分子间作用力范围很小,即分子充分接近时才有相互间的作用力。
④分子的大小、分子的极性对范德华力有显著影响。结构相似的分子,相对分子质量越大范德华力越大;分子的极性越大,范德华力也越大。拓展与应用为什么常温下Cl2为气态,而Br2为液态,I2为固态?
已知在常温常压下,氧气在水中的溶解度比氮气大,试推测其原因?三、氢键及其对物质性质的影响氢键的本质
氢原子与电负性大的原子X以共价键结合时,H原子还能够跟另外一个电负性大的原子Y之间产生静电引力的作用,成为氢键,表示为:X-H…Y(X、Y为N、O、F)。
氢键的特征
氢键既有方向性(X-H…Y尽可能在同一条直线上),又有饱和性(X-H只能和一个Y原子结合)。
氢键的大小,介于化学键与范德华力之间,不属于化学键。但也有键长、键能。氢键的存在
氢键可分为分子间氢键和分子内氢键两大类。
一个分子中的X-H与另一个分子的Y结合而成的氢键成为分子间氢键。如:水分子之间、甲酸分子之间,以及氨分子与水分子之间等。一般成直线型。
在某些分子里,如:邻羟基苯甲醛分子中,O-H与相邻的醛基中的O形成的氢键在分子内部,故称分子内氢键。不能在一条直线上。氢键的形成对化合物性质的影响(1)对沸点和熔点的影响
分子间氢键使物质熔、沸点升高。而分子内氢键使物质的沸点和熔点降低。
(2)对溶解度的影响
极性溶剂里,溶质分子与溶剂分子间的氢键使溶质溶解度增大,而当溶质分子形成分子间氢键使恰好相反。 应用与拓展为什么NH3极易溶于水?
冰的硬度比一般固体共价化合物大,为什么?
课后习题5?
1.准备两个烧杯,分别在两个烧杯中注入水和四氯化碳。 2.分别在两个烧杯中加入少量的蔗糖,轻轻地用玻棒搅拌,观察这两个培养皿中的蔗糖,有何变化。
3.同样地,在另外两个烧杯中注入水和四氯化碳。分别加入少量的碘,轻轻地用玻棒搅拌,观察这两个烧杯中的碘有何变化。 四、溶解性探究实验:现象?结论?相似相溶原理 “凡是分子结构相似的物质,都是易于互相溶解的。”这是从大量事实总结出来的一条规律,叫做相似相溶原理。由于分子的极性是否相似对溶解性影响很大,所以,相似相溶原理又可以理解为“极性分子易溶于极性溶剂中,非极性分子易溶于非极性溶剂中。”例如:CCl4是非极性分子,作为溶剂它就是非极性溶剂;而H20是极性分子,所以它是极性溶剂。Br2、I2等都是非极性分子,所以易溶于CCl4、苯等非极性溶剂,而在水这一极性溶剂中溶解度就很小。相反,盐类(NaCl等)这些离子化合物可看做是极性最强的,它们就易溶于水而不溶于CCl4、苯等非极性溶剂。HCl、H2S04是强极性分手,易溶于水而难溶于CCl4。利用相似相溶原理,有助于我们判断物质在不同溶剂中的溶解性。 结论:影响溶解度的因素(1)内因:相似相溶原理
(2)外因:影响固体溶解度的主要因素是温度;影响气体溶解度的主要因素是温度和压强。
(3)其他因素:
A)如果溶质与溶剂之间能形成氢键,则溶解度增大,且氢键越强,溶解性越好。如:NH3。
B)溶质与水发生反应时可增大其溶解度,如:SO2。思考与交流五、手性观察一下两组图片,有何特征?一对分子,组成和原子的排列方式完全相同,但如同左手和右手一样互为镜像,在三维空间无论如何旋转不能重叠,这对分子互称手性异构体。有手性异构体的分子称为手性分子。中心原子成为手性原子。例如:乳酸分子CH3CHOHCOOH有以下两种异构体: ??? 六、无机含氧酸分子的酸性 把含氧酸的化学式写成(HO)m ROn,
就能根据n值判断常见含氧酸的强弱。
n=0,极弱酸,如硼酸(H3BO3)。
n=1,弱酸,如亚硫酸(H2SO3)。
n=2,强酸,如硫酸(H2SO4)、硝酸(HNO3)。
n=3,极强酸,如高氯酸(HClO4)。无机含氧酸强度的变化本质 含氧酸的强度取决于中心原子的电负性、原子半径、氧化数。
当中心原子的电负性大、原子半径小、氧化数高时,使O-H键减弱,酸性增强。H2SiO4 H3PO4 H2SO4 HClO4 HClO HClO3 HClO4HClO HBrO HIO练习:比较下列含氧酸酸性的强弱 同周期的含氧酸,自左至右,随中心原子原子序数增大 ,酸性增强。 同一族的含氧酸,自上而下,随中心原子原子序数增大 ,酸性减弱。 同一元素不同价态的含氧酸酸性高价强于低价 。无机含氧酸强度的变化规律无氧酸的酸性强弱变化规律 若用通式R-H表示无氧酸,则其酸性的强弱主要取决于R的电负性。
如果R原子电负性大,对氢原子的束缚力强,则其酸性弱。
如果R原子的电负性小,对氢原子的束缚力弱,则其酸性就强。练习:比较下列物质的酸性强弱,有何结论?
(1)CH4、NH3、H2O、HF
(2)HF、HCl、HBr、HI
(1)何谓共价键?
(2)何谓电负性?
(3)分别以H2、HCl为例,探究电负性对共价键有何影响?
练习与巩固1.含有非极性键的离子化合物是?? (???? )
A.?NaOH B?.Na2O2?
C.NaCl D?.NH4Cl
2.下列元素间形成的共价键中,极性最强的是? (???? )
A.F―F B.H―F
C.H―Cl D.H―O极性分子与非极性分子
(1)由非极性键构成的分子,正电荷的中心和负电荷的中心怎样分布?
(2)以HCl和CH4为例,分析:由极性键形成的分子,怎样找正电荷的中心和负电荷的中心?
(3)常见的极性分子和非极性分子有哪些?如何简单判断?思考与交流用价层电子对互斥模型画出分子的立体结构模型总结完成下表总结:键的极性与分子极性的关系 A、都是由非极性键构成的分子一定是非极 性分子。
B、极性键结合形成的双原子分子一定为极 性分子。
C、极性键结合形成的多原子分子,可能为 非极性分子,也可能为极性分子。
D、多原子分子的极性,应有键的极性和分子的空间构型共同来决定。
二、范德华力及其对物质性质的影响(1)气体在加压或降温是为什么会变为液体、固体?
(2)仔细观察书中表2-4,结合分子结构的特点和数据,能得出什么结论?
(3)怎样解释卤素单质从F2-I2熔、沸点越来越高?对范德华力的理解①分子间作用力比化学键弱得多,它主要影响物质的熔点、沸点、溶解性等物理性质,而化学键主要影响物质的化学性质。
②分子间作用力只存在于由分子构成的物质之间,离子化合物、圆子化合物、金属之间不存在范德华力。
③分子间作用力范围很小,即分子充分接近时才有相互间的作用力。
④分子的大小、分子的极性对范德华力有显著影响。结构相似的分子,相对分子质量越大范德华力越大;分子的极性越大,范德华力也越大。拓展与应用为什么常温下Cl2为气态,而Br2为液态,I2为固态?
已知在常温常压下,氧气在水中的溶解度比氮气大,试推测其原因?三、氢键及其对物质性质的影响氢键的本质
氢原子与电负性大的原子X以共价键结合时,H原子还能够跟另外一个电负性大的原子Y之间产生静电引力的作用,成为氢键,表示为:X-H…Y(X、Y为N、O、F)。
氢键的特征
氢键既有方向性(X-H…Y尽可能在同一条直线上),又有饱和性(X-H只能和一个Y原子结合)。
氢键的大小,介于化学键与范德华力之间,不属于化学键。但也有键长、键能。氢键的存在
氢键可分为分子间氢键和分子内氢键两大类。
一个分子中的X-H与另一个分子的Y结合而成的氢键成为分子间氢键。如:水分子之间、甲酸分子之间,以及氨分子与水分子之间等。一般成直线型。
在某些分子里,如:邻羟基苯甲醛分子中,O-H与相邻的醛基中的O形成的氢键在分子内部,故称分子内氢键。不能在一条直线上。氢键的形成对化合物性质的影响(1)对沸点和熔点的影响
分子间氢键使物质熔、沸点升高。而分子内氢键使物质的沸点和熔点降低。
(2)对溶解度的影响
极性溶剂里,溶质分子与溶剂分子间的氢键使溶质溶解度增大,而当溶质分子形成分子间氢键使恰好相反。 应用与拓展为什么NH3极易溶于水?
冰的硬度比一般固体共价化合物大,为什么?
课后习题5?
1.准备两个烧杯,分别在两个烧杯中注入水和四氯化碳。 2.分别在两个烧杯中加入少量的蔗糖,轻轻地用玻棒搅拌,观察这两个培养皿中的蔗糖,有何变化。
3.同样地,在另外两个烧杯中注入水和四氯化碳。分别加入少量的碘,轻轻地用玻棒搅拌,观察这两个烧杯中的碘有何变化。 四、溶解性探究实验:现象?结论?相似相溶原理 “凡是分子结构相似的物质,都是易于互相溶解的。”这是从大量事实总结出来的一条规律,叫做相似相溶原理。由于分子的极性是否相似对溶解性影响很大,所以,相似相溶原理又可以理解为“极性分子易溶于极性溶剂中,非极性分子易溶于非极性溶剂中。”例如:CCl4是非极性分子,作为溶剂它就是非极性溶剂;而H20是极性分子,所以它是极性溶剂。Br2、I2等都是非极性分子,所以易溶于CCl4、苯等非极性溶剂,而在水这一极性溶剂中溶解度就很小。相反,盐类(NaCl等)这些离子化合物可看做是极性最强的,它们就易溶于水而不溶于CCl4、苯等非极性溶剂。HCl、H2S04是强极性分手,易溶于水而难溶于CCl4。利用相似相溶原理,有助于我们判断物质在不同溶剂中的溶解性。 结论:影响溶解度的因素(1)内因:相似相溶原理
(2)外因:影响固体溶解度的主要因素是温度;影响气体溶解度的主要因素是温度和压强。
(3)其他因素:
A)如果溶质与溶剂之间能形成氢键,则溶解度增大,且氢键越强,溶解性越好。如:NH3。
B)溶质与水发生反应时可增大其溶解度,如:SO2。思考与交流五、手性观察一下两组图片,有何特征?一对分子,组成和原子的排列方式完全相同,但如同左手和右手一样互为镜像,在三维空间无论如何旋转不能重叠,这对分子互称手性异构体。有手性异构体的分子称为手性分子。中心原子成为手性原子。例如:乳酸分子CH3CHOHCOOH有以下两种异构体: ??? 六、无机含氧酸分子的酸性 把含氧酸的化学式写成(HO)m ROn,
就能根据n值判断常见含氧酸的强弱。
n=0,极弱酸,如硼酸(H3BO3)。
n=1,弱酸,如亚硫酸(H2SO3)。
n=2,强酸,如硫酸(H2SO4)、硝酸(HNO3)。
n=3,极强酸,如高氯酸(HClO4)。无机含氧酸强度的变化本质 含氧酸的强度取决于中心原子的电负性、原子半径、氧化数。
当中心原子的电负性大、原子半径小、氧化数高时,使O-H键减弱,酸性增强。H2SiO4 H3PO4 H2SO4 HClO4 HClO HClO3 HClO4HClO HBrO HIO练习:比较下列含氧酸酸性的强弱 同周期的含氧酸,自左至右,随中心原子原子序数增大 ,酸性增强。 同一族的含氧酸,自上而下,随中心原子原子序数增大 ,酸性减弱。 同一元素不同价态的含氧酸酸性高价强于低价 。无机含氧酸强度的变化规律无氧酸的酸性强弱变化规律 若用通式R-H表示无氧酸,则其酸性的强弱主要取决于R的电负性。
如果R原子电负性大,对氢原子的束缚力强,则其酸性弱。
如果R原子的电负性小,对氢原子的束缚力弱,则其酸性就强。练习:比较下列物质的酸性强弱,有何结论?
(1)CH4、NH3、H2O、HF
(2)HF、HCl、HBr、HI
