硅和及其化合物(福建省厦门市思明区)
文档属性
| 名称 | 硅和及其化合物(福建省厦门市思明区) |

|
|
| 格式 | rar | ||
| 文件大小 | 78.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2008-02-10 00:00:00 | ||
图片预览





文档简介
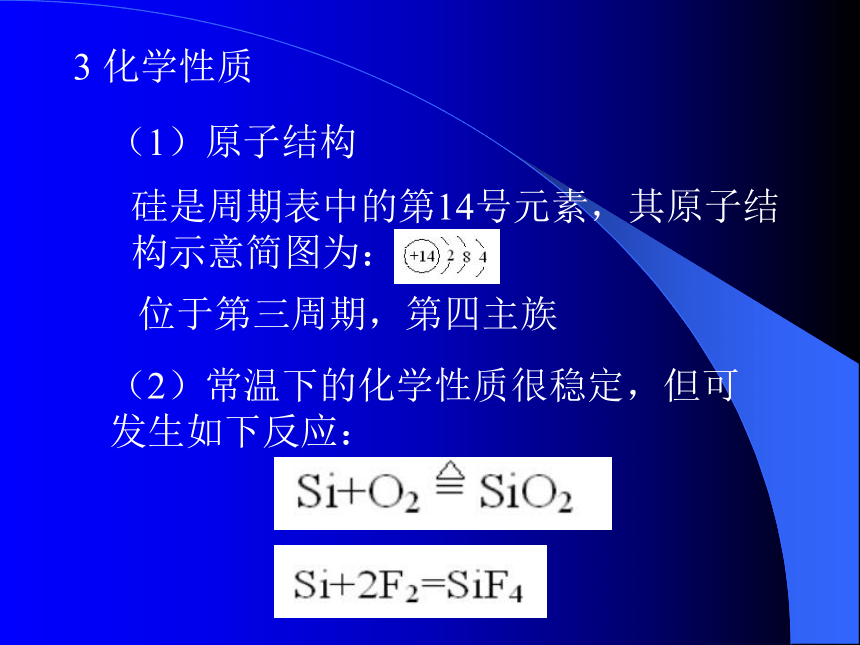
课件18张PPT。一 硅1 存在含量:地壳第二形式:只有化合态,无游离态同素异形体: 晶体硅和无定形硅2 物理性质灰黑色、有金属光泽、硬而脆的固体,熔沸点都很高,硬度大,良好的半导体材料3 化学性质(1)原子结构硅是周期表中的第14号元素,其原子结构示意简图为:位于第三周期,第四主族(2)常温下的化学性质很稳定,但可发生如下反应:(3)工业制法粗硅提纯:(4)用途 a)半导体材料:集成电路、晶体管、硅 整流器、太阳能电池; b)合金:含硅4%的钢用来制造变压铁芯、含硅15%的钢用来制造耐酸设备。(5) 碳和硅的比较(a)结构:最外层都有4个电子,碳的原子半
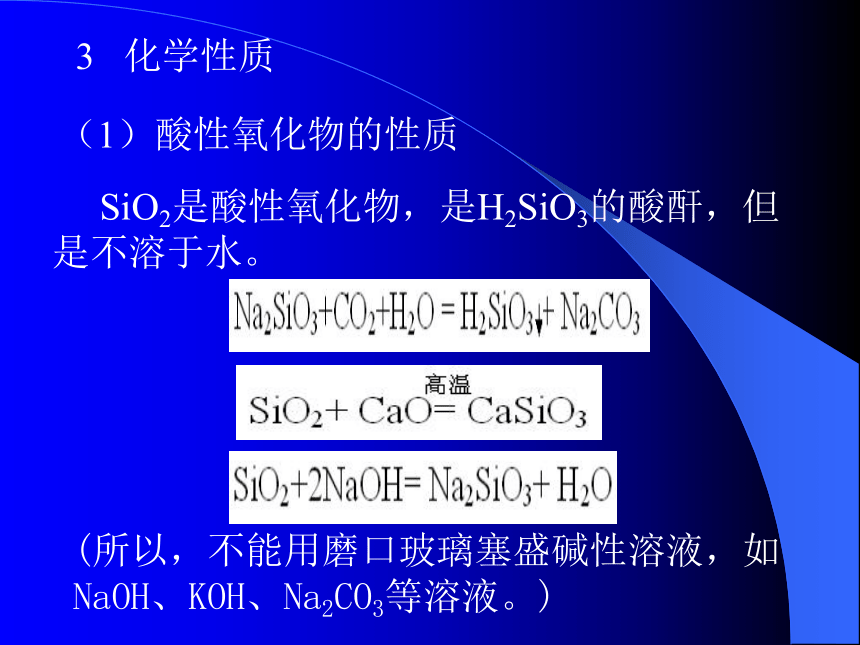
径小于硅的原子半径(b)物理性质: 都具有较高的熔沸点,硬度都较高。金刚石的熔沸点、硬度都高于晶体硅。金刚石是绝缘体、石墨是良导体,而Si是半导体。(c)化学性质: 常温时都很稳定,都能跟O2反应, Si能跟HF、NaOH溶液反应,而C不行。二 二氧化硅1 存在形式:石英、水晶 、砂子2 物理性质:SiO2是一种坚硬难溶的固体,不溶于水,天然的SiO2又叫硅石,是构成岩石的成分之一 3 化学性质(1)酸性氧化物的性质 SiO2是酸性氧化物,是H2SiO3的酸酐,但是不溶于水。(所以,不能用磨口玻璃塞盛碱性溶液,如NaOH、KOH、Na2CO3等溶液。) (3)特性4 用途(1)光导纤维(2) 石英玻璃、石英电子表、石英钟 (3)电子工业的重要部件 (2)弱氧化性氢氟酸用于雕刻玻璃(4)石英砂常用做制造玻璃和建筑材料CO2和SiO2的比较
空气 岩石中熔沸点低,常温下是气体,微溶于水坚硬难溶的固体,不溶于水CO2+H2O=H2CO3 不反应不反应除HF外不反应SiO2+2NaOH= Na2SiO3+H2O CO2+ CaO=CaCO3 SiO2+CaO=CaSiO3(高温) 饮料、制碱 光导纤维等 CO2+2NaOH=Na2CO3+H2O 三 硅酸及硅酸盐:1 硅酸:硅酸、原硅酸都不溶于水,属于弱酸,其酸性比碳酸弱H4SiO4===H2SiO3+H2O(易)2 硅酸盐:(1)多数不溶于水(Na2SiO3易溶)(2)金属氧化物形式:顺序:活泼金属氧化物 · 较活泼金属氧化物 ·二氧化硅 · 水把下列硅酸盐改写成氧化物的形式:1 硅酸钠 Na2SiO3 2 镁橄榄石 Mg2SiO43 水玻璃:Na2SiO3的水溶液无色粘稠的溶液,是一种矿物胶,做粘合剂、防腐剂。1 Na2O ·SiO2 2 2 MgO · SiO2四、常见的无机非金属材料⑴玻璃、水泥、陶瓷⑷金刚石钻头⑶玻璃刀⑵石英钟表⑹ 煤气炉中的电子打火⑸彩电(荧光材料)⑺海底电缆(光导纤维)⑻ 电脑的CPU(单晶硅)⑼隐形飞机(特殊光学材料)硅酸盐材料 玻璃工业水泥工业陶 瓷水泥工业原料设备生产过程反应条件水泥成分水泥应用硅酸三钙、硅酸二钙、铝酸三钙石灰石、粘土、辅助原料高温生料→熟料建筑粘合剂水 泥 回 转 窑玻璃工业Na2O ·CaO ·6SiO2纯碱、石灰石和石英。2、原料:1、组成:3、反应原理:Na2CO3+SiO2==Na2SiO3+CO2↑ CaCO3+SiO2==CaSiO3+CO2↑高温4、几种常见的玻璃:几种常见玻璃简介普通玻璃因混有铁的化合物显浅绿色蓝玻璃红玻璃 在原料里加入某些金属氧化物均匀地分散到玻璃态物质里,使玻璃呈现出特征颜色。化学仪器玻璃如试管等光学仪器玻璃如放大镜钢化玻璃 把普通玻璃放在电炉里加热,使它软化,然后急速冷却,得到钢化玻璃。其机械强度比普通玻璃大4——6倍,不易破碎。光纤玻璃光导纤维:1964年8月华裔科学家高锟首先提出用玻璃纤维代替金属导线,被誉为“纤维光学之父”。比头发丝还细的一对光导纤维上同时传送3万门电话且中继距离长达20——50Km,保密性能好。
陶 瓷 陶瓷工业发展更加 迅速,各种新型陶瓷不断问世,美国“哥伦比亚”号航天飞机的外壳,就是铺砌了3.2万块这样的金属陶瓷耐热片。用新型陶瓷材料代替金属材料制发动机,1990年我国第一台无水冷发电机试车成功。这是继美、日之后,国际上仅有的几次试验之一。专家们预言:随着新陶瓷技术的发展,人类将“重返”“石器时代,不过是一个全新的石器时代。”
径小于硅的原子半径(b)物理性质: 都具有较高的熔沸点,硬度都较高。金刚石的熔沸点、硬度都高于晶体硅。金刚石是绝缘体、石墨是良导体,而Si是半导体。(c)化学性质: 常温时都很稳定,都能跟O2反应, Si能跟HF、NaOH溶液反应,而C不行。二 二氧化硅1 存在形式:石英、水晶 、砂子2 物理性质:SiO2是一种坚硬难溶的固体,不溶于水,天然的SiO2又叫硅石,是构成岩石的成分之一 3 化学性质(1)酸性氧化物的性质 SiO2是酸性氧化物,是H2SiO3的酸酐,但是不溶于水。(所以,不能用磨口玻璃塞盛碱性溶液,如NaOH、KOH、Na2CO3等溶液。) (3)特性4 用途(1)光导纤维(2) 石英玻璃、石英电子表、石英钟 (3)电子工业的重要部件 (2)弱氧化性氢氟酸用于雕刻玻璃(4)石英砂常用做制造玻璃和建筑材料CO2和SiO2的比较
空气 岩石中熔沸点低,常温下是气体,微溶于水坚硬难溶的固体,不溶于水CO2+H2O=H2CO3 不反应不反应除HF外不反应SiO2+2NaOH= Na2SiO3+H2O CO2+ CaO=CaCO3 SiO2+CaO=CaSiO3(高温) 饮料、制碱 光导纤维等 CO2+2NaOH=Na2CO3+H2O 三 硅酸及硅酸盐:1 硅酸:硅酸、原硅酸都不溶于水,属于弱酸,其酸性比碳酸弱H4SiO4===H2SiO3+H2O(易)2 硅酸盐:(1)多数不溶于水(Na2SiO3易溶)(2)金属氧化物形式:顺序:活泼金属氧化物 · 较活泼金属氧化物 ·二氧化硅 · 水把下列硅酸盐改写成氧化物的形式:1 硅酸钠 Na2SiO3 2 镁橄榄石 Mg2SiO43 水玻璃:Na2SiO3的水溶液无色粘稠的溶液,是一种矿物胶,做粘合剂、防腐剂。1 Na2O ·SiO2 2 2 MgO · SiO2四、常见的无机非金属材料⑴玻璃、水泥、陶瓷⑷金刚石钻头⑶玻璃刀⑵石英钟表⑹ 煤气炉中的电子打火⑸彩电(荧光材料)⑺海底电缆(光导纤维)⑻ 电脑的CPU(单晶硅)⑼隐形飞机(特殊光学材料)硅酸盐材料 玻璃工业水泥工业陶 瓷水泥工业原料设备生产过程反应条件水泥成分水泥应用硅酸三钙、硅酸二钙、铝酸三钙石灰石、粘土、辅助原料高温生料→熟料建筑粘合剂水 泥 回 转 窑玻璃工业Na2O ·CaO ·6SiO2纯碱、石灰石和石英。2、原料:1、组成:3、反应原理:Na2CO3+SiO2==Na2SiO3+CO2↑ CaCO3+SiO2==CaSiO3+CO2↑高温4、几种常见的玻璃:几种常见玻璃简介普通玻璃因混有铁的化合物显浅绿色蓝玻璃红玻璃 在原料里加入某些金属氧化物均匀地分散到玻璃态物质里,使玻璃呈现出特征颜色。化学仪器玻璃如试管等光学仪器玻璃如放大镜钢化玻璃 把普通玻璃放在电炉里加热,使它软化,然后急速冷却,得到钢化玻璃。其机械强度比普通玻璃大4——6倍,不易破碎。光纤玻璃光导纤维:1964年8月华裔科学家高锟首先提出用玻璃纤维代替金属导线,被誉为“纤维光学之父”。比头发丝还细的一对光导纤维上同时传送3万门电话且中继距离长达20——50Km,保密性能好。
陶 瓷 陶瓷工业发展更加 迅速,各种新型陶瓷不断问世,美国“哥伦比亚”号航天飞机的外壳,就是铺砌了3.2万块这样的金属陶瓷耐热片。用新型陶瓷材料代替金属材料制发动机,1990年我国第一台无水冷发电机试车成功。这是继美、日之后,国际上仅有的几次试验之一。专家们预言:随着新陶瓷技术的发展,人类将“重返”“石器时代,不过是一个全新的石器时代。”
