碳族元素、碳及其化合物(福建省厦门市思明区)复习
文档属性
| 名称 | 碳族元素、碳及其化合物(福建省厦门市思明区)复习 |

|
|
| 格式 | zip | ||
| 文件大小 | 705.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2008-02-10 00:00:00 | ||
图片预览






文档简介
课件25张PPT。第七章 硅和硅酸盐工业复习本章知识点:
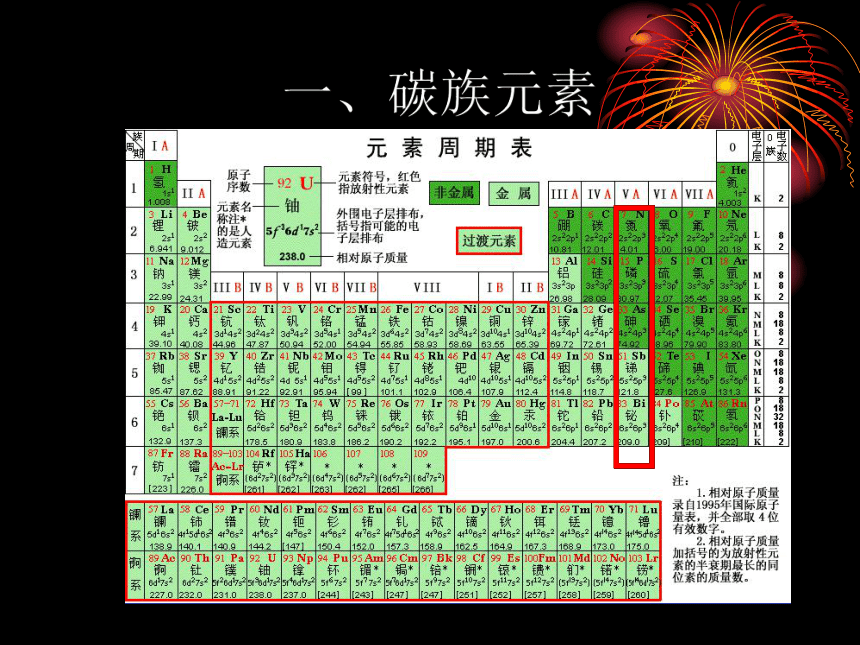
第一节 碳族元素及其化合物第二节 硅及其化合物、硅酸盐工业简介第一节 碳族元素、碳及其化合物内容提要:一、碳 族 元 素
三、碳 及 其 化 合 物的转化关 系
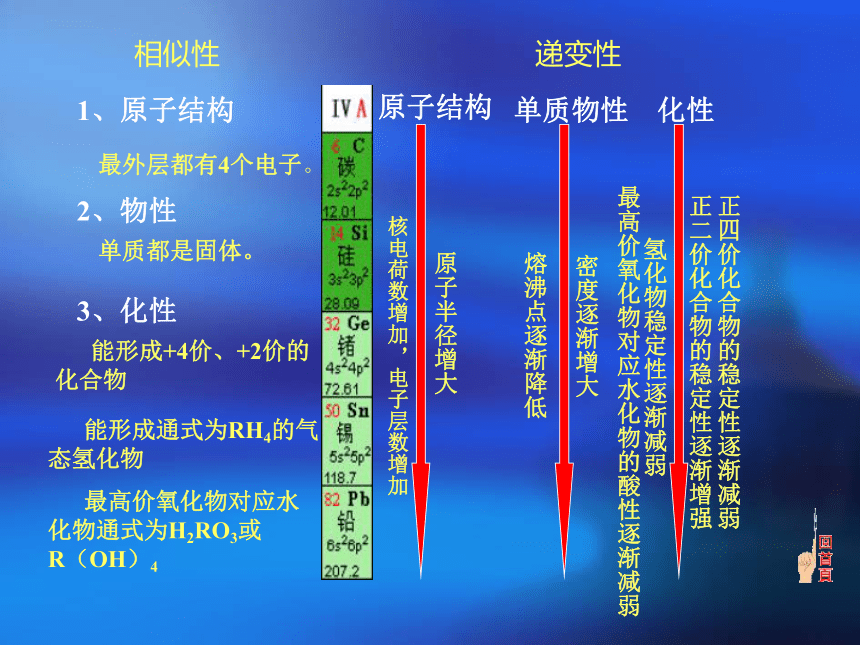
二、碳 的 单 质 性 质四、针 对 性 讲 练一、碳族元素 能形成+4价、+2价的
化合物 能形成通式为RH4的气
态氢化物 最高价氧化物对应水化物通式为H2RO3或
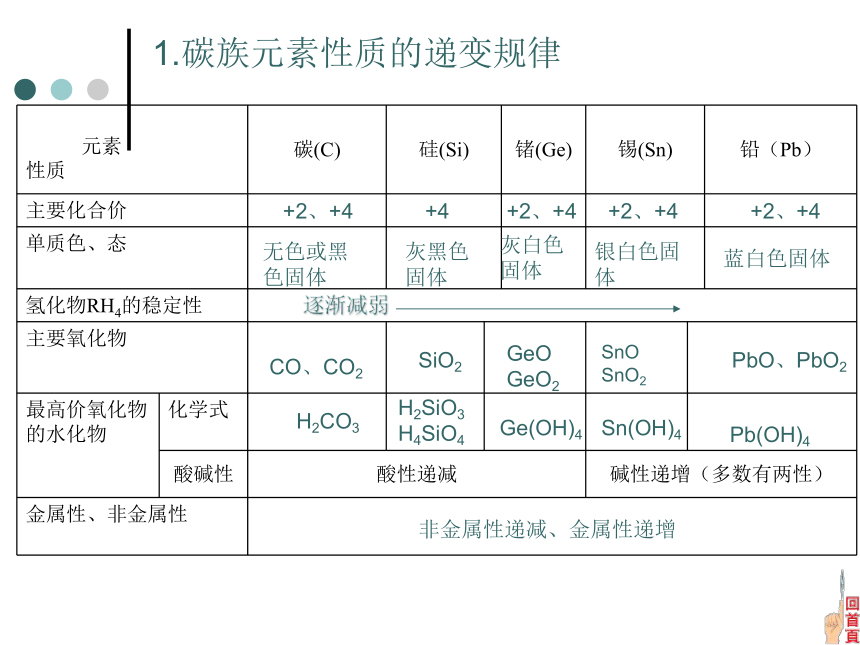
R(OH)4相似性递变性1、原子结构最外层都有4个电子。2、物性单质都是固体。3、化性原子结构单质物性化性核电荷数增加,电子层数增加原子半径增大熔沸点逐渐降低密度逐渐增大氢化物稳定性逐渐减弱最高价氧化物对应水化物的酸性逐渐减弱正二价化合物的稳定性逐渐增强正四价化合物的稳定性逐渐减弱1.碳族元素性质的递变规律 +2、+4+2、+4+2、+4+4+2、+4无色或黑色固体灰黑色固体灰白色固体银白色固体蓝白色固体CO、CO2SiO2GeO
GeO2SnOSnO2PbO、PbO2H2CO3H2SiO3 H4SiO4Ge(OH)4Sn(OH)4Pb(OH)4非金属性递减、金属性递增学生练习2下列关于碳族元素的说法中,错误的是( )
A.它们从上到下的非金属性向金属性递变的趋势比卤族元素明显
B.碳族元素的气态氢化物的稳定性从上到下逐渐减弱
C.碳族元素原子的最外层都有4个电子
D.主要化合价有+2价和+4价,大多数+2价化合物稳定D3、锡、铅两种元素的主要化合价是+2价和+4价,其中+2价锡和+4价铅的化合物是不稳定的,+2价锡离子有强还原性,+4价铅化合物有强氧化性。如Sn2+比Fe2+还原性强,PbO2比Cl2氧化性强,写出下列反应的化学方程式:
①FeCl3溶液滴入SnCl2溶液;
②PbO2遇浓盐酸。
答案:① 2 FeCl3+SnCl2=2 FeCl2+ SnCl4② PbO2+4HCl=PbCl2+2H2O+ Cl2针对性训练1、碳的同素异形体金刚石石 墨C60二、碳的单质二、碳的单质性质1、同素异形体⑴金刚石: 色_______晶体, 键角______,硬度 , 导电
⑵石墨: 色不透明, 金属光泽,滑腻, 导电
⑶无定形碳:包括炭黑、木炭、活性炭、焦炭
⑷C60:“足球烯”,属_________晶体无原子晶体109028`高不黑有能分子晶体2、3 一氧化碳和二氧化碳无色无毒味气体,有毒,难溶于水。无色略带酸味气体,无毒,
能溶于水,固态时俗称干冰。1、可燃性2、还原性(跟Fe3O4、CuO、H2O
SiO2的反应)3、不成盐氧化物 1、不能燃烧,一般情况下不助燃2、氧化性(跟C、Mg的反应)3、酸性氧化物(跟碱反应)CaCO3+2HCl=CaCl2+CO2↑+H2O排水法向上排空气法 点燃后在火焰上罩上干燥的
烧杯和粘有澄清石灰水的烧杯,
出现浑浊使澄清石灰水变浑浊针对性训练吸收CO2检验CO2钟乳石的形成制碳铵候氏制碱二、碳及其化合物的转化关系CCO2Na2CO3NaHCO3COCaCO3Ca(HCO3)2CaC2C2H2O2、HNO3等O2、SiO2等CaOH2OMgNaOH、Na2O2等C Ca(OH)2O2等SiO2、高温等CO2+H2O Ca(OH)2或△H+或加热CO2+H2ONaOH或加热Ca(OH)2Ca(OH)2H+写出下列1~8的反应式练习:点击:进入针对性训练109o28' 金刚石是一种具有空间网状结构的原子晶体,在晶体中,每
个碳原子都被相邻的4个碳原子包围,处于4个碳原子的中心,以
共价键与4个碳原子结合。成为正四面体结构,这些正四面体向空
间发展,构成彼此联结的立体网状结构。金刚石的熔点(>3550℃)
和沸点(4827℃)都很高,硬度很大。
金刚石返 回返 回120o共价键范德华力 石墨是层状结构,在每一层内,碳原子排成六边形,每个碳原子与其它
3个碳原子以共价键结合,形成平面的网状结构;在层与层之间,是以分子间
作用力结合的。由于同一层的碳原子以较强共价键结合,使石墨的熔点很高
(比金刚石的还要高) ,沸点与金刚石相同。但由于层与层之间的分子间作用
力很弱,容易滑动,使石墨的硬度很小。石墨C60返 回双基巩固第一题第二题第三题第一题第二题研究性试题1、下列对碳的同素异形体:金刚石、石墨、
和C60的说法中,错误的是﹙ ﹚
A 熔点:金刚石>石墨>C60
B 沸点:金刚石=石墨>C60
C 在一定条件下与O2反应生成CO2
D 在一定条件下它们可能相互转化A返回一、双基巩固一、巩固双基2、第ⅣA族元素中C、Si、Ge、Sn的+4价化合物是稳定的,而铅的+2价化合物是稳定的。Ge是一种良好的半导体材料,被广泛应用于电子工业上。它可从煤燃烧的烟道灰中提取。其过程如下:烟道灰(含GeO2)锗的氯化物锗酸纯净的锗的氧化物锗。写出⑴、⑵、⑷步反应的化学方程式。返回3、 BGO是我国研制的一种闪烁晶体材料,曾用于锘贝尔奖获得者丁肇中的著名实验,它是锗酸铋的简称。若知:① BGO中,锗处于最高价态;②在BGO中,铋的价态与铋跟氯形成某种共价氯化物时所呈的价态相同,在此氯化物中铋具有最外层8个电子稳定结构;③BGO可看成是由锗和铋两种元素的氧化物所形成的复杂氧化物,且在BGO 晶体的化学式中,这两种氧化物所含的总质量相同。请填空:
⑴锗和铋的元素符号分别是___和___。
⑵BGO晶体的化学式是________________。
⑶BGO晶体中所含铋的氧化物的化学式是____。GeBi2Bi2O3?3GeO2或Bi4(GeO4)3Bi2O3返回 因为在BGO中,锗处于最高价(即+4价),其氧化 物的化学式可写成GeO2。而铋的价态跟氯化铋相同,且因 为在此化合物中铋具有8个电子的稳定结构,可知铋的化合 价应是+3价,则铋的氧化物的化学式可写成Bi2O3,又因为 在BGO中这两种氧化物中氧元素的总质量相同故根据第③点
可知:BGO的化学式可写成2Bi2O3?3GeO2[或Bi4(GeO4)3的形式。
返回解析研究性试题(题见学案)1、课题式课堂是研究性学习的一种方式,其基本教学模式为:
提出课题——确定研究方案——解决问题——总结和评价证明CO有还原实验装置返回证明PbO中有氧的装置返回谢谢光临指导再见!
第一节 碳族元素及其化合物第二节 硅及其化合物、硅酸盐工业简介第一节 碳族元素、碳及其化合物内容提要:一、碳 族 元 素
三、碳 及 其 化 合 物的转化关 系
二、碳 的 单 质 性 质四、针 对 性 讲 练一、碳族元素 能形成+4价、+2价的
化合物 能形成通式为RH4的气
态氢化物 最高价氧化物对应水化物通式为H2RO3或
R(OH)4相似性递变性1、原子结构最外层都有4个电子。2、物性单质都是固体。3、化性原子结构单质物性化性核电荷数增加,电子层数增加原子半径增大熔沸点逐渐降低密度逐渐增大氢化物稳定性逐渐减弱最高价氧化物对应水化物的酸性逐渐减弱正二价化合物的稳定性逐渐增强正四价化合物的稳定性逐渐减弱1.碳族元素性质的递变规律 +2、+4+2、+4+2、+4+4+2、+4无色或黑色固体灰黑色固体灰白色固体银白色固体蓝白色固体CO、CO2SiO2GeO
GeO2SnOSnO2PbO、PbO2H2CO3H2SiO3 H4SiO4Ge(OH)4Sn(OH)4Pb(OH)4非金属性递减、金属性递增学生练习2下列关于碳族元素的说法中,错误的是( )
A.它们从上到下的非金属性向金属性递变的趋势比卤族元素明显
B.碳族元素的气态氢化物的稳定性从上到下逐渐减弱
C.碳族元素原子的最外层都有4个电子
D.主要化合价有+2价和+4价,大多数+2价化合物稳定D3、锡、铅两种元素的主要化合价是+2价和+4价,其中+2价锡和+4价铅的化合物是不稳定的,+2价锡离子有强还原性,+4价铅化合物有强氧化性。如Sn2+比Fe2+还原性强,PbO2比Cl2氧化性强,写出下列反应的化学方程式:
①FeCl3溶液滴入SnCl2溶液;
②PbO2遇浓盐酸。
答案:① 2 FeCl3+SnCl2=2 FeCl2+ SnCl4② PbO2+4HCl=PbCl2+2H2O+ Cl2针对性训练1、碳的同素异形体金刚石石 墨C60二、碳的单质二、碳的单质性质1、同素异形体⑴金刚石: 色_______晶体, 键角______,硬度 , 导电
⑵石墨: 色不透明, 金属光泽,滑腻, 导电
⑶无定形碳:包括炭黑、木炭、活性炭、焦炭
⑷C60:“足球烯”,属_________晶体无原子晶体109028`高不黑有能分子晶体2、3 一氧化碳和二氧化碳无色无毒味气体,有毒,难溶于水。无色略带酸味气体,无毒,
能溶于水,固态时俗称干冰。1、可燃性2、还原性(跟Fe3O4、CuO、H2O
SiO2的反应)3、不成盐氧化物 1、不能燃烧,一般情况下不助燃2、氧化性(跟C、Mg的反应)3、酸性氧化物(跟碱反应)CaCO3+2HCl=CaCl2+CO2↑+H2O排水法向上排空气法 点燃后在火焰上罩上干燥的
烧杯和粘有澄清石灰水的烧杯,
出现浑浊使澄清石灰水变浑浊针对性训练吸收CO2检验CO2钟乳石的形成制碳铵候氏制碱二、碳及其化合物的转化关系CCO2Na2CO3NaHCO3COCaCO3Ca(HCO3)2CaC2C2H2O2、HNO3等O2、SiO2等CaOH2OMgNaOH、Na2O2等C Ca(OH)2O2等SiO2、高温等CO2+H2O Ca(OH)2或△H+或加热CO2+H2ONaOH或加热Ca(OH)2Ca(OH)2H+写出下列1~8的反应式练习:点击:进入针对性训练109o28' 金刚石是一种具有空间网状结构的原子晶体,在晶体中,每
个碳原子都被相邻的4个碳原子包围,处于4个碳原子的中心,以
共价键与4个碳原子结合。成为正四面体结构,这些正四面体向空
间发展,构成彼此联结的立体网状结构。金刚石的熔点(>3550℃)
和沸点(4827℃)都很高,硬度很大。
金刚石返 回返 回120o共价键范德华力 石墨是层状结构,在每一层内,碳原子排成六边形,每个碳原子与其它
3个碳原子以共价键结合,形成平面的网状结构;在层与层之间,是以分子间
作用力结合的。由于同一层的碳原子以较强共价键结合,使石墨的熔点很高
(比金刚石的还要高) ,沸点与金刚石相同。但由于层与层之间的分子间作用
力很弱,容易滑动,使石墨的硬度很小。石墨C60返 回双基巩固第一题第二题第三题第一题第二题研究性试题1、下列对碳的同素异形体:金刚石、石墨、
和C60的说法中,错误的是﹙ ﹚
A 熔点:金刚石>石墨>C60
B 沸点:金刚石=石墨>C60
C 在一定条件下与O2反应生成CO2
D 在一定条件下它们可能相互转化A返回一、双基巩固一、巩固双基2、第ⅣA族元素中C、Si、Ge、Sn的+4价化合物是稳定的,而铅的+2价化合物是稳定的。Ge是一种良好的半导体材料,被广泛应用于电子工业上。它可从煤燃烧的烟道灰中提取。其过程如下:烟道灰(含GeO2)锗的氯化物锗酸纯净的锗的氧化物锗。写出⑴、⑵、⑷步反应的化学方程式。返回3、 BGO是我国研制的一种闪烁晶体材料,曾用于锘贝尔奖获得者丁肇中的著名实验,它是锗酸铋的简称。若知:① BGO中,锗处于最高价态;②在BGO中,铋的价态与铋跟氯形成某种共价氯化物时所呈的价态相同,在此氯化物中铋具有最外层8个电子稳定结构;③BGO可看成是由锗和铋两种元素的氧化物所形成的复杂氧化物,且在BGO 晶体的化学式中,这两种氧化物所含的总质量相同。请填空:
⑴锗和铋的元素符号分别是___和___。
⑵BGO晶体的化学式是________________。
⑶BGO晶体中所含铋的氧化物的化学式是____。GeBi2Bi2O3?3GeO2或Bi4(GeO4)3Bi2O3返回 因为在BGO中,锗处于最高价(即+4价),其氧化 物的化学式可写成GeO2。而铋的价态跟氯化铋相同,且因 为在此化合物中铋具有8个电子的稳定结构,可知铋的化合 价应是+3价,则铋的氧化物的化学式可写成Bi2O3,又因为 在BGO中这两种氧化物中氧元素的总质量相同故根据第③点
可知:BGO的化学式可写成2Bi2O3?3GeO2[或Bi4(GeO4)3的形式。
返回解析研究性试题(题见学案)1、课题式课堂是研究性学习的一种方式,其基本教学模式为:
提出课题——确定研究方案——解决问题——总结和评价证明CO有还原实验装置返回证明PbO中有氧的装置返回谢谢光临指导再见!
