元素周期律(浙江省舟山市)
图片预览






文档简介
课件29张PPT。第二节元素周期律 门捷列夫
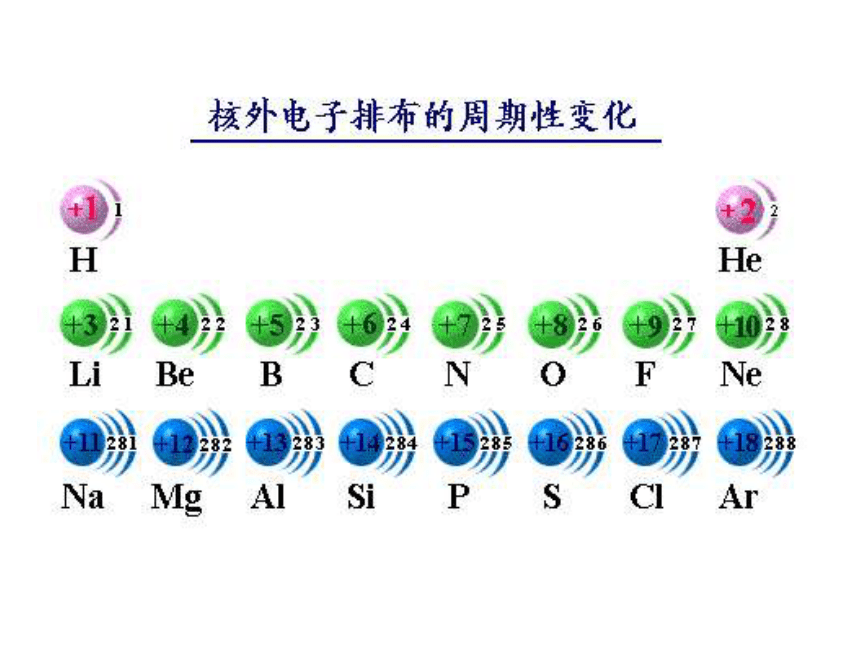
不自觉地应用黑格尔的量转化为质的规律,完成了科学史上一个勋业—— 恩格斯19世纪中叶门捷列夫发现了元素周期律你知道吗什么是原子序数?
它与核电荷数、质子数有何关系?人们按核电荷数由小到大的顺序给元素编号,
这种编号叫做原子序数.
元素的原子序数在数值上等于该元素原子的
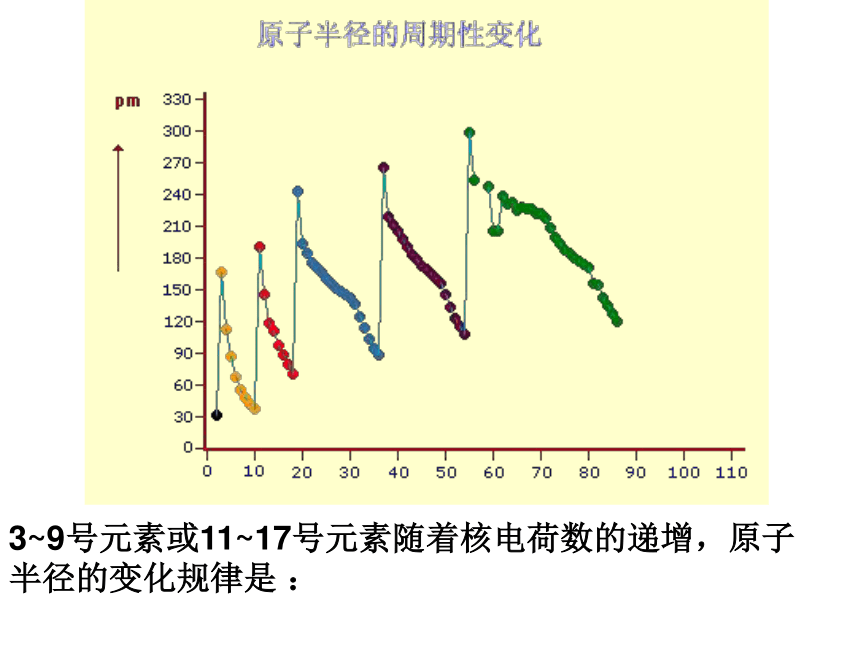
核电荷数.原子半径问题与讨论:随着元素核电荷数的递增,元素的原子半径有怎样的变化规律?2.微粒半径大小比较中的规律
(1)同周期元素的原子或最高价阳离子半径从左至右变小
(稀有气体元素除外)
如:Na>Mg>Al>Si;Na+>Mg2+>Al3+。
(2)同主族元素(同列)的原子或离子半径从上到下变大
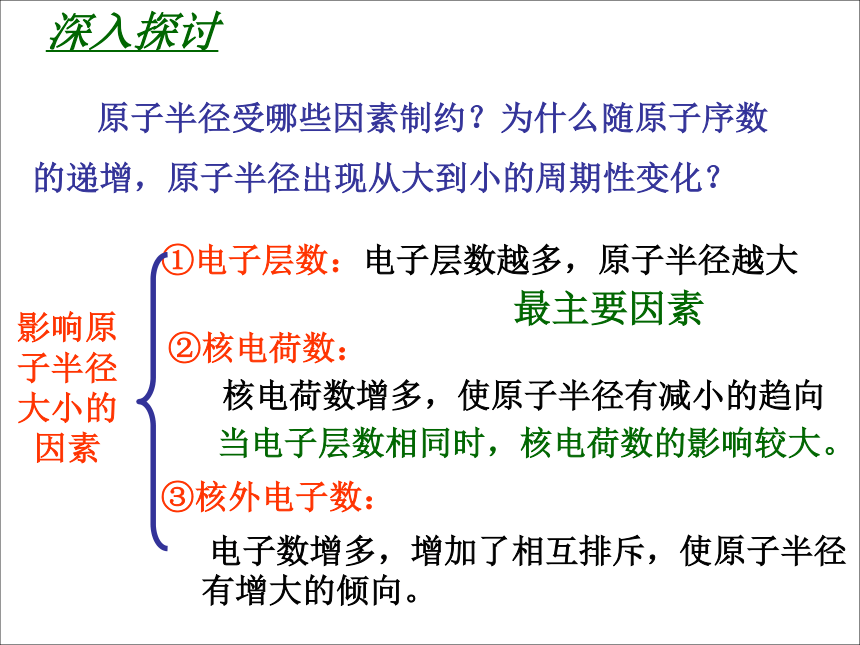
如:Li的递增,原子半径出现从大到小的周期性变化? 影响原
子半径
大小的
因素①电子层数:电子层数越多,原子半径越大②核电荷数:核电荷数增多,使原子半径有减小的趋向③核外电子数: 电子数增多,增加了相互排斥,使原子半径有增大的倾向。
最主要因素 当电子层数相同时,核电荷数的影响较大。问题与解决请比较以下微粒的大小
Na Al P Si
F Cl Br I
元素的主要化合价元素的主要化合价随着原子序数的变化如何?元素最高化合价和最低化合价的递变规律。2 3结论:随着原子序数的递增,元素化合价呈现 变化。
周期性2, 8, 12, 8, 22, 8, 32, 8, 42, 8,52, 8, 62, 8, 72, 8, 811~17号元素的最高正化合价与最外层电子数有何关系?最高正价==
最外层电子数最低负化合价数 = 8 – 最外层电子数 结论: 随着原子序数的递增,元素原子的电子层排布和化合价都呈周期性变化! 元素的金属性和非金属性是否也随原子序数的变化呈现周期性变化呢?疑问元素的金属性与非金属性强弱判断元素金属性强弱的方法判断元素非金属性强弱的方法问题与解决根据所学的知识,设计实验,探究Na、Mg、
Al的活动性
并写出相关的化学方程式冷水剧烈热水较快一般沸水发生反应较剧烈剧烈元素的化学性质钠、镁、铝单质活动性强弱的顺序是:钠 > 镁 > 铝问题与解决:请写出钠、镁、铝最高价氧化物对应的水化物,并比较他们的碱性强弱? 非金属性:Si < P < S < Cl硅、磷、硫、氯元素的气态氢化物问题与解决:随着元素核电荷数的递增,气态氢化物的热稳定性如何变化?非金属性如何变化?最高价氧化物对应水化物的酸碱性金属性和非金属性递变金属性逐渐减弱,非金属性逐渐增强金属性逐渐减弱,非金属性逐渐增强
(1)同周期元素的原子或最高价阳离子半径从左至右变小
(稀有气体元素除外)
同周期元素的原子金属性从左至右变小
同周期元素的原子金属性从左至右变大
(2)同主族元素(同列)的原子或离子半径从上到下变大
同列的原子金属性从上到下变大
同列的原子非金属性从上到下变小元素的性质随着原子序数的递增而呈现周期性的变化的规律叫做元素周期律。原子半径;元素化合价;原子核外电子排布;元素的金属性、非金属性。元素的性质为什么随着元素原子序数的递增
而呈周期性的变化?(元素周期律的实质)元素周期律的实质:元素性质的周期性变化是元素原子的核
外电子排布的周期性变化的必然结果练 习1 从原子序数11依次增加到17,下列所述递变关系中,错误的是( )A 电子层数逐渐增多B 原子半径逐渐增大C 最高正化合价数值逐渐增大D 从硅到氯,最低负化合价从-4到-1AB3 (04·江苏)X、Y是元素周期表ⅦA族中的两种元素。下列叙述中能说明X的非金属性比Y强的是( )
A.X原子的电子层数比Y原子的电子层数多
B.X的氢化物的沸点比Y的氢化物的沸点低
C.X的气态氢化物比Y的气态氢化物稳定
D.Y的单质能将X从NaX的溶液中置换出来C2 3小结
不自觉地应用黑格尔的量转化为质的规律,完成了科学史上一个勋业—— 恩格斯19世纪中叶门捷列夫发现了元素周期律你知道吗什么是原子序数?
它与核电荷数、质子数有何关系?人们按核电荷数由小到大的顺序给元素编号,
这种编号叫做原子序数.
元素的原子序数在数值上等于该元素原子的
核电荷数.原子半径问题与讨论:随着元素核电荷数的递增,元素的原子半径有怎样的变化规律?2.微粒半径大小比较中的规律
(1)同周期元素的原子或最高价阳离子半径从左至右变小
(稀有气体元素除外)
如:Na>Mg>Al>Si;Na+>Mg2+>Al3+。
(2)同主族元素(同列)的原子或离子半径从上到下变大
如:Li
子半径
大小的
因素①电子层数:电子层数越多,原子半径越大②核电荷数:核电荷数增多,使原子半径有减小的趋向③核外电子数: 电子数增多,增加了相互排斥,使原子半径有增大的倾向。
最主要因素 当电子层数相同时,核电荷数的影响较大。问题与解决请比较以下微粒的大小
Na Al P Si
F Cl Br I
元素的主要化合价元素的主要化合价随着原子序数的变化如何?元素最高化合价和最低化合价的递变规律。2 3结论:随着原子序数的递增,元素化合价呈现 变化。
周期性2, 8, 12, 8, 22, 8, 32, 8, 42, 8,52, 8, 62, 8, 72, 8, 811~17号元素的最高正化合价与最外层电子数有何关系?最高正价==
最外层电子数最低负化合价数 = 8 – 最外层电子数 结论: 随着原子序数的递增,元素原子的电子层排布和化合价都呈周期性变化! 元素的金属性和非金属性是否也随原子序数的变化呈现周期性变化呢?疑问元素的金属性与非金属性强弱判断元素金属性强弱的方法判断元素非金属性强弱的方法问题与解决根据所学的知识,设计实验,探究Na、Mg、
Al的活动性
并写出相关的化学方程式冷水剧烈热水较快一般沸水发生反应较剧烈剧烈元素的化学性质钠、镁、铝单质活动性强弱的顺序是:钠 > 镁 > 铝问题与解决:请写出钠、镁、铝最高价氧化物对应的水化物,并比较他们的碱性强弱? 非金属性:Si < P < S < Cl硅、磷、硫、氯元素的气态氢化物问题与解决:随着元素核电荷数的递增,气态氢化物的热稳定性如何变化?非金属性如何变化?最高价氧化物对应水化物的酸碱性金属性和非金属性递变金属性逐渐减弱,非金属性逐渐增强金属性逐渐减弱,非金属性逐渐增强
(1)同周期元素的原子或最高价阳离子半径从左至右变小
(稀有气体元素除外)
同周期元素的原子金属性从左至右变小
同周期元素的原子金属性从左至右变大
(2)同主族元素(同列)的原子或离子半径从上到下变大
同列的原子金属性从上到下变大
同列的原子非金属性从上到下变小元素的性质随着原子序数的递增而呈现周期性的变化的规律叫做元素周期律。原子半径;元素化合价;原子核外电子排布;元素的金属性、非金属性。元素的性质为什么随着元素原子序数的递增
而呈周期性的变化?(元素周期律的实质)元素周期律的实质:元素性质的周期性变化是元素原子的核
外电子排布的周期性变化的必然结果练 习1 从原子序数11依次增加到17,下列所述递变关系中,错误的是( )A 电子层数逐渐增多B 原子半径逐渐增大C 最高正化合价数值逐渐增大D 从硅到氯,最低负化合价从-4到-1AB3 (04·江苏)X、Y是元素周期表ⅦA族中的两种元素。下列叙述中能说明X的非金属性比Y强的是( )
A.X原子的电子层数比Y原子的电子层数多
B.X的氢化物的沸点比Y的氢化物的沸点低
C.X的气态氢化物比Y的气态氢化物稳定
D.Y的单质能将X从NaX的溶液中置换出来C2 3小结
