元素周期表及应用(浙江省舟山市)
图片预览





文档简介
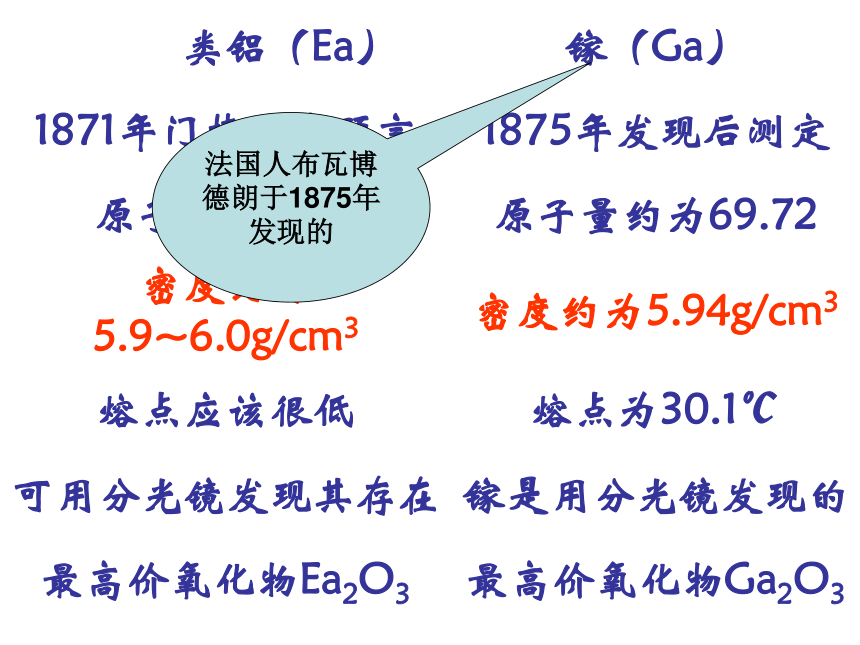
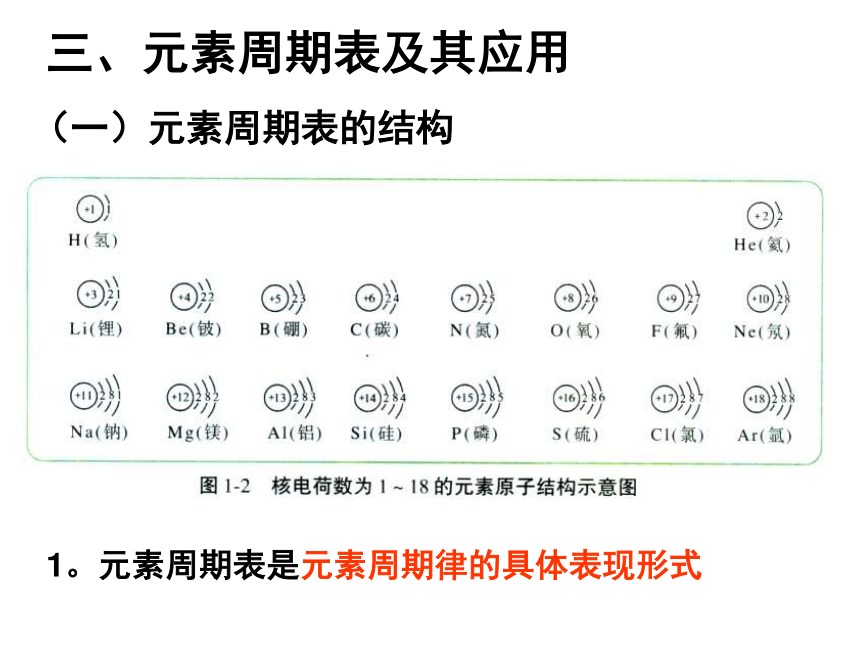
课件45张PPT。元素周期表及其应用法国人布瓦博德朗于1875年发现的三、元素周期表及其应用1。元素周期表是元素周期律的具体表现形式(一)元素周期表的结构元素周期表的结构(周期)周期(横行)
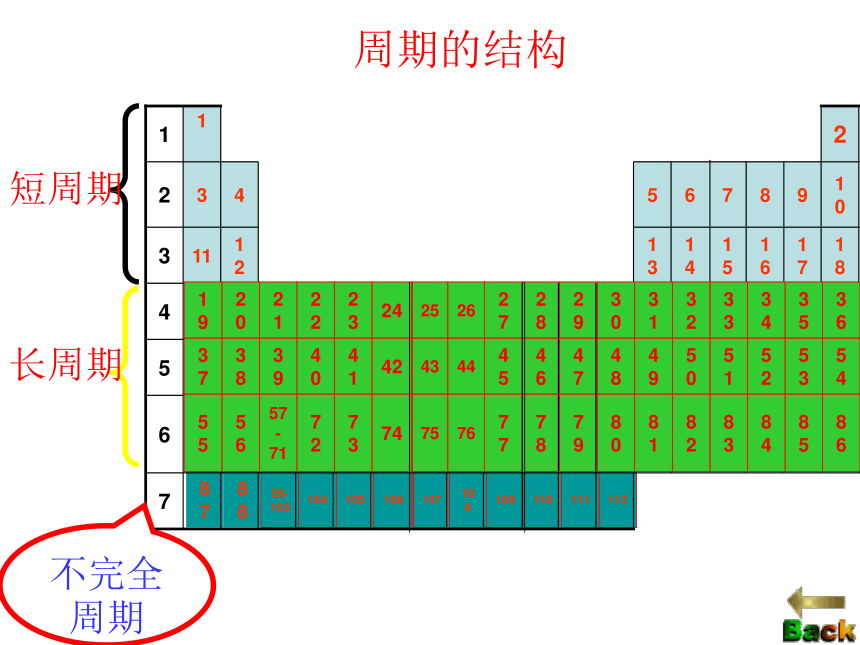
具有相同的电子层数而又按原子序数递增的顺序排列的一系列元素,称为一个周期。周期数为其电子层数。短周期:
长周期:
不完全周期:周期第一、二、三周期第四、五、六周期第七周期返回子菜单三长三短一不全765418
8
2M
L
k38
2L
K22K1周期的结构不完全周期一、元素周期表的结构1、周期(横行)
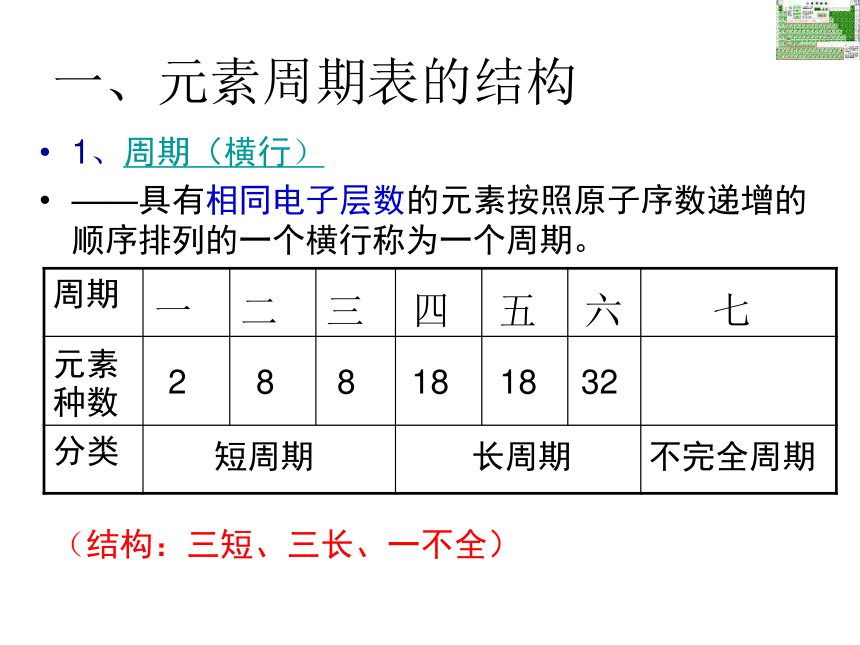
——具有相同电子层数的元素按照原子序数递增的顺序排列的一个横行称为一个周期。
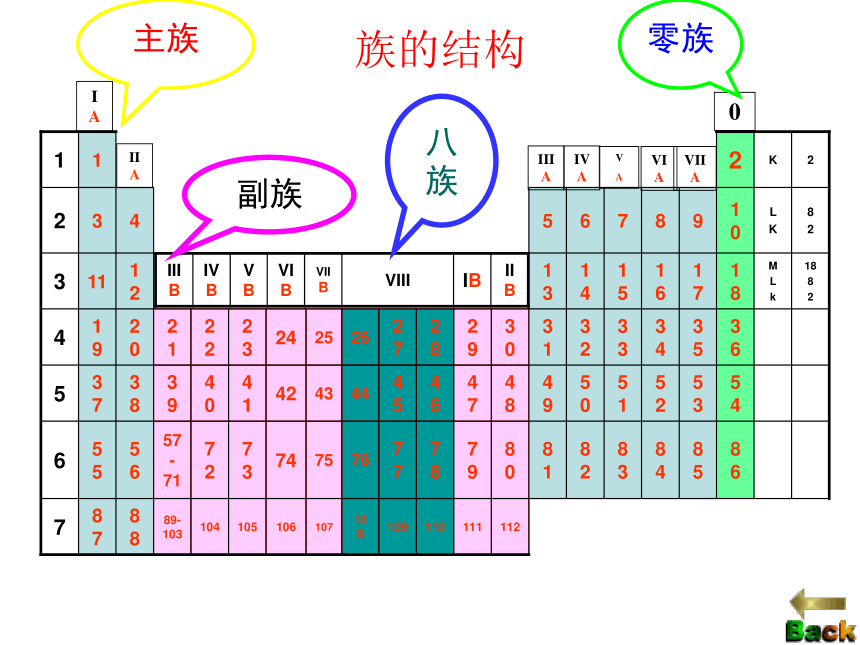
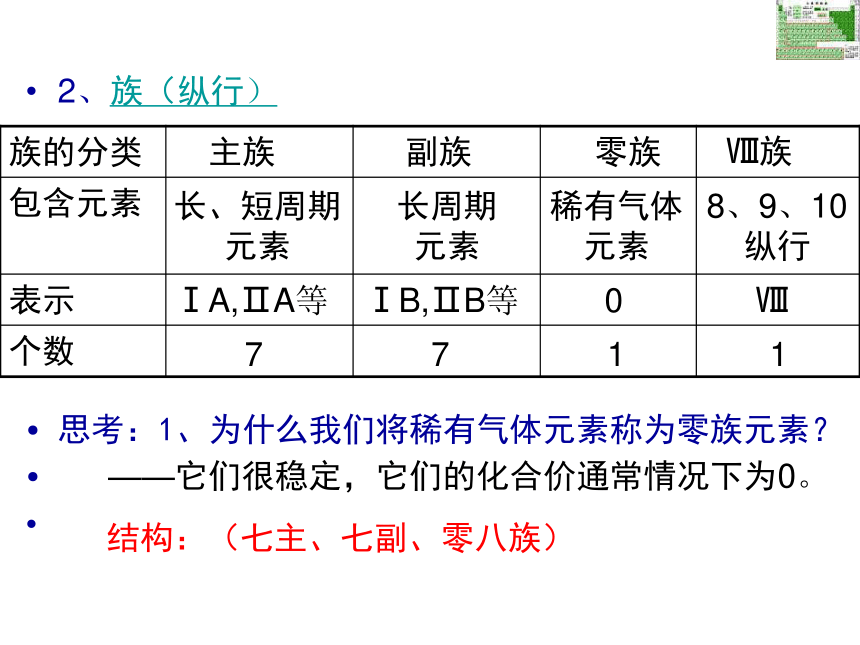
一 二 三 四 五 六 七288181832短周期长周期不完全周期(结构:三短、三长、一不全)元素周期表的结构(族)族(纵行)
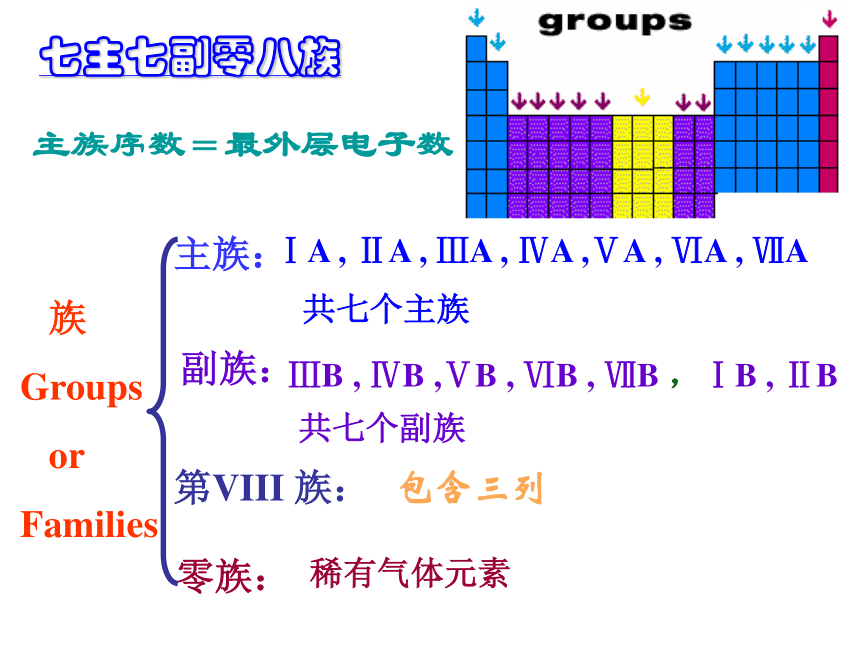
1.主族 由短周期元素和长周期元素共同构成的族。 表示方法:在族序数后面标一“A”字。ⅠA、ⅡA、ⅢA、… 主族序数=最外层电子数
2.副族:完全由长周期元素构成的族。 表示方法:在族序数后标“B”字。如ⅠB、ⅡB、ⅢB、…
第VⅢ族:
0族:(“八、九、十” 三个纵行)稀有气体元素七主七副零八族IAIIAIIIAIVAV
AVIAVIIA0主族副族八族零族族的结构2、族(纵行)
思考:1、为什么我们将稀有气体元素称为零族元素?
——它们很稳定,它们的化合价通常情况下为0。
结构:(七主、七副、零八族)主族副族零族 Ⅷ族长、短周期
元素长周期
元素稀有气体
元素8、9、10纵行ⅠA,ⅡA等 ⅠB,ⅡB等 0 Ⅷ77112。元素周期表的编排原则横行(周期):将电子层数相同的元素,
按核电荷数递增的顺序从左到右排列。纵行(族):将最外层电子数相同的元素,
按核电荷数递增的顺序从上到下排列。原子序数 =核电荷数
=质子数
=核外电子数(电中性原子) 短周期
short periods 长周期
long periods 不完全周期
uncompleted period 第7周期:26种元素三长三短一不全周期数 = 电子层数 族
Groups
or
Families主族:副族:ⅠA , ⅡA , ⅢA , ⅣA ,ⅤA , ⅥA , ⅦA 第VIII 族:稀有气体元素 零族:共七个主族ⅢB , ⅣB ,ⅤB , ⅥB , ⅦB ,ⅠB , ⅡB 共七个副族包含三列七主七副零八族主族序数=最外层电子数3、结构:1、周期:周期数 = 电子层数三长三短一不全2、族:七主七副零八族主族序数=最外层电子数族顺序:ⅠA ⅡA ⅢB ⅣB ⅤB ⅥB ⅦB Ⅷ ⅠB ⅡB ⅢA ⅣA ⅤA ⅥA ⅦA 0 ⅠAⅡ AⅢ BⅣBⅤ BⅥ BⅦ BⅧⅠ BⅡ BⅢ AⅣ AⅤ AⅥ AⅦ A0周期序数 = 电子层数 主族序数 = 最外层电子数 同周期元素电子层数相等 同主族元素最外层电子数相等 23332第三周期第ⅥA 族第三周期第ⅠA 族第三周期第ⅢA 族第二周期0族56138+5+6+1+3—-3-2—元素原子结构与其在周期表中位置关系16S练习 推算原子序数为6,13,34,53,88,82的
元素在周期表中的位置。 第6号元素: 6-2=4 第二周期第ⅣA 族。 第13号元素: 13-10=3 第三周期第ⅢA 族。 第34号元素: 34-18=16 第四周期第ⅥA 族。 第53号元素: 53-36=17 第五周期第ⅦA 族。 第88号元素: 88-86 =2 第七周期第ⅡA 族。2
8
8
18
18
32
元素金属性和非金属性判断依据元素金属性强弱的判断依据:
单质跟水或酸起反应置换出氢的难易;
元素氧化物的水化物——氢氧化物的碱性强弱。
元素非金属性强弱的判断依据:
氧化物的水化物的酸性强弱;
单质与氢气生成气态氢化物的难易。(二) .元素的性质和元素周期表的位置关系1.同周期元素的性质变化规律同一
周期最 外 层 电 子 数 逐 渐 增 多原 子 半 径 逐 渐 减 小(稀有气体除外)金 属 性 逐 渐 减 弱,非 金 属 性 逐 渐 增 强电子层数相同化合价+1+2+3+4-4+5-3+6-2+7-10最高氧化物R对应
水化
物碱性酸性气态氢化物稳定性R2OROR2O3RO2R2O5RO3R2O7对应水化物
化学式ROHR(OH)2R(OH)3H2RO3HRO3H3RO4H4RO4H2RO4HRO4递 增递 增递 减RH4RH3H2RHR金 属 性减 弱,非 金 属 性增 强2、同主族元素性质的变化规律同一主族(电子层数相同)电
子
层
数
依
次
增
多原
子
半
径
依
次
增
大单
质
还
原
性
增
强金
属
性
?
增
强原
子
半
径
增
大电
子
层
数
依
次
增
多单
质
氧
化
性
减
弱气
态
氢
化
物
稳
定
性
递
减非
金
属
性
减
弱原
子
半
径氧化
还原
性金属性
非金属
性高价氧
化对应
水化物
酸碱性气态
氢化
物稳
定性递
增单
质
还
原
性
增
氧
化
性
递
减金
属
性
递
增
非
金
属
性
递
减碱
性
递
增
酸
性
递
减递
减元素金属性与非金属性的递变金属性逐渐增强非金属性逐渐增强金属性逐渐增强非金属性逐渐增强B
Al Si
Ge As
Sb Te
Po At 半径由大变小半径由小变大非 金 属 性 递 增金 属 性 递 增金 属 最 强 1B Al SiGe As Sb Te 2 3 4 5 6 7ⅠAⅡAⅢAⅣAⅤAⅥAⅦA 0 Po At非金属性逐渐增强 金属性逐渐增强金属性逐渐增强 非金属性逐渐增强2、元素性质与其在周期表中位置的 关系。(1)从原子结构的角度预测金属性与非金属性的递变规律
A、同一周期,从左到右,金属性逐渐减弱,非金属性逐渐增强。
B、同一主族,从上到下,金属性逐渐增强,非金属性逐渐减弱。
(2)举例证明
思考:周期表中什么元素的金属性最强?什么元素的非金属性最强,为什么?
——根据递变规律,周期表左下方的钫金属性最强,右上方的氟非金属性最强。同周期、同主族元素的递变规律依次增大逐渐增多相同逐渐减小周期性变化金属性减弱,非金属性增强碱性减弱,酸性增强逐渐增强按周期元素数增加相同依次递增逐渐增大基本相同非金属性减弱,金属性增强酸性减弱,碱性增强逐渐减弱同周期、同主族元素的递变规律依次增大逐渐增多相同逐渐减小周期性变化金属性减弱,非金属性增强还原性减弱,氧化性增强碱性减弱,酸性增强逐渐增强按周期元素数增加相同依次递增逐渐增大基本相同非金属性减弱,金属性增强氧化性减弱,还原性增强酸性减弱,碱性增强逐渐减弱(三)周期表的应用寻找催化剂寻找半导体寻找农药(四)、性质、结构、位置之间的关系原子结构元素性质元素在表中位置告诉你原子序数,应能推测原子结构、元素在周期表中位置、元素金属性、非金属性。原子序数= 核电荷数周期数= 电子层数主族序数=最外层电子数电子层数最外层电子数金属性、非金属性强弱(主族)最外层电子数 = 最高正价 最外层电子数-8 = 负价(四)、位置、结构、性质三者之间的关系:练习金属性最强的元素(不包括放射性元素)是 ;
最活泼的非金属元素是 ;
最高价氧化物对应水化物的酸性最强的元素是 ;
最高价氧化物对应水化物的碱性最强的元素(不包括放射性元素)是 。CsFClCs第三周期第IVA族的元素原子序数是:
Na元素的原子序数为11,相邻的同族元素的原子序数是:
短周期元素中,族序数=周期序数的元素有:
族序数等于周期序数2倍的元素有:
周期序数=族序数2倍的有: 练习与思考:14 3、19 H、Be 、 Al C S Li、Ca 思考:
1、同一周期阴、阳离子的电子层数一样吗?
2、X+和Y-的电子层结构相同,那么它们的离子结构是和X还是Y原子所在周期的稀有气体相同?X和Y的相对位置如何?下列各表中数字(表示原子序数)所表示的元素与它们在周期表中位置相符的一组是
练习与思考:D练习 A、B、C是周期表中相邻的三种元素,其中A、B是同周期,B、C是同主族。此三种元素原子最外层电子数之和为17,质子数之和为31,则A、B、C分别为什么元素?观察,可得A是氮元素
B是氧元素
C是硫元素1 A、B、C为短周期元素,在周期表中所处位置如下图所示。A、C两元素的原子核外电子数之和等于B原子的质子数。B原子核内质子数和中子数相等。
(1)写出A、B、C三种元素的名称 、 、 。
(2)B位于元素周期表第 周期,第 族。
(3)C的原子结构示意图为 。
(4)比较B、C的的原子半径,B C,写出A的气态氢化物与B的最高价氧化物对应水化物反应的化学方程式 。氮硫氟3VIA> 2NH3 + H2SO4 = (NH4)2SO4
16.下表为元素周期表中的一部分, 表中列出10种元素在周期表中的位置, 按要求回答下列各题(1)化学性质最不活泼的元素符号是________,金属性最强的单质与水反应的化学方程式是____________________________________。
(2)①③⑤三种元素最高价氧化物的水化物中碱性最强的物质的化学式是_____________。
(3)元素①形成的稳定的氧化物在呼吸面具中供氧时的化学方程式是 ,该化合物的焰色反应为_________色。
(4)②③⑤三种元素形成的离子, 离子半径由大到小的顺序是_____>_____>_____。Ar2K+2H2O=2KOH+H2↑NaOH 2Na2O2+2CO2=Na2CO3+O2黄Al3+Mg2+K+16.下表为元素周期表中的一部分, 表中列出10种元素在周期表中的位置, 按要求回答下列各题(5)元素⑧的单质和石灰乳作用可制成有漂白和消毒作用的漂白粉, 用化学方程式表示漂白粉在潮湿空气中起漂白作用的原理 。
(6)医学证明, 人体缺钙易患多种疾病, 特别是儿童和中老年人应经常补钙, 在各种补钙制剂中钙元素呈_____________态(填游离态或化合态)。
(7)在元素①③⑤中化学性质最活泼的元素是___________, 设计简单的化学实验证明你的结论 。
(8)在元素⑧和⑨中, 化学性质较活泼的元素是___________, 至少从三种不同角度证明你的结论。
A.__________________________________________
B.__________________________________________
C.___________________________________________
(5)CO2+Ca(ClO)2+H2O=CaCO3↓+2HClO化合Na比较它们从水中置换出氢的难易Cl比较与氢化合的难易比较气态氢化物的稳定性比较其最高价氧化物对应水化物的酸性强弱
处于同周期的相邻两种元素A和B,A的最高价氧化物的水化物的碱性比B弱,A处于B的 边(左或右);B的原子半径比A ;若B的最外层有2个电子,则A最外层有 个电子。
处于同周期的相邻两种元素A和B,A的最高价氧化物的水化物的酸性比B弱,A处于B的 边(左或右);B的原子半径比A ;若B的最外层有3个电子,则A最外层有 个电子。右大3左小2作业:课本P11 4、5(只写答案)
6、11、(抄题并做题)
世纪金榜 10---11的课时基础自测
复习:1、整理元素周期表周期(自左往右)、主族(自上而下)原子半径、元素金属性非金属性、最高价氧化物的水化物酸碱性、非金属元素氢化物稳定性变化规律。
2、元素周期表位--构---性关系。Na
11钠H
1氢He
2氦Li
3锂Be
4铍B
5硼C
6碳N
7氮O
8氧F
9氟Ne
10氖Mg
12镁Al
13铝Si
14硅P
15磷S
16硫Cl
17氯Ar
18氩K
19钾Ca
20钙12341~18号元素的排列表NaCsKLiRb
具有相同的电子层数而又按原子序数递增的顺序排列的一系列元素,称为一个周期。周期数为其电子层数。短周期:
长周期:
不完全周期:周期第一、二、三周期第四、五、六周期第七周期返回子菜单三长三短一不全765418
8
2M
L
k38
2L
K22K1周期的结构不完全周期一、元素周期表的结构1、周期(横行)
——具有相同电子层数的元素按照原子序数递增的顺序排列的一个横行称为一个周期。
一 二 三 四 五 六 七288181832短周期长周期不完全周期(结构:三短、三长、一不全)元素周期表的结构(族)族(纵行)
1.主族 由短周期元素和长周期元素共同构成的族。 表示方法:在族序数后面标一“A”字。ⅠA、ⅡA、ⅢA、… 主族序数=最外层电子数
2.副族:完全由长周期元素构成的族。 表示方法:在族序数后标“B”字。如ⅠB、ⅡB、ⅢB、…
第VⅢ族:
0族:(“八、九、十” 三个纵行)稀有气体元素七主七副零八族IAIIAIIIAIVAV
AVIAVIIA0主族副族八族零族族的结构2、族(纵行)
思考:1、为什么我们将稀有气体元素称为零族元素?
——它们很稳定,它们的化合价通常情况下为0。
结构:(七主、七副、零八族)主族副族零族 Ⅷ族长、短周期
元素长周期
元素稀有气体
元素8、9、10纵行ⅠA,ⅡA等 ⅠB,ⅡB等 0 Ⅷ77112。元素周期表的编排原则横行(周期):将电子层数相同的元素,
按核电荷数递增的顺序从左到右排列。纵行(族):将最外层电子数相同的元素,
按核电荷数递增的顺序从上到下排列。原子序数 =核电荷数
=质子数
=核外电子数(电中性原子) 短周期
short periods 长周期
long periods 不完全周期
uncompleted period 第7周期:26种元素三长三短一不全周期数 = 电子层数 族
Groups
or
Families主族:副族:ⅠA , ⅡA , ⅢA , ⅣA ,ⅤA , ⅥA , ⅦA 第VIII 族:稀有气体元素 零族:共七个主族ⅢB , ⅣB ,ⅤB , ⅥB , ⅦB ,ⅠB , ⅡB 共七个副族包含三列七主七副零八族主族序数=最外层电子数3、结构:1、周期:周期数 = 电子层数三长三短一不全2、族:七主七副零八族主族序数=最外层电子数族顺序:ⅠA ⅡA ⅢB ⅣB ⅤB ⅥB ⅦB Ⅷ ⅠB ⅡB ⅢA ⅣA ⅤA ⅥA ⅦA 0 ⅠAⅡ AⅢ BⅣBⅤ BⅥ BⅦ BⅧⅠ BⅡ BⅢ AⅣ AⅤ AⅥ AⅦ A0周期序数 = 电子层数 主族序数 = 最外层电子数 同周期元素电子层数相等 同主族元素最外层电子数相等 23332第三周期第ⅥA 族第三周期第ⅠA 族第三周期第ⅢA 族第二周期0族56138+5+6+1+3—-3-2—元素原子结构与其在周期表中位置关系16S练习 推算原子序数为6,13,34,53,88,82的
元素在周期表中的位置。 第6号元素: 6-2=4 第二周期第ⅣA 族。 第13号元素: 13-10=3 第三周期第ⅢA 族。 第34号元素: 34-18=16 第四周期第ⅥA 族。 第53号元素: 53-36=17 第五周期第ⅦA 族。 第88号元素: 88-86 =2 第七周期第ⅡA 族。2
8
8
18
18
32
元素金属性和非金属性判断依据元素金属性强弱的判断依据:
单质跟水或酸起反应置换出氢的难易;
元素氧化物的水化物——氢氧化物的碱性强弱。
元素非金属性强弱的判断依据:
氧化物的水化物的酸性强弱;
单质与氢气生成气态氢化物的难易。(二) .元素的性质和元素周期表的位置关系1.同周期元素的性质变化规律同一
周期最 外 层 电 子 数 逐 渐 增 多原 子 半 径 逐 渐 减 小(稀有气体除外)金 属 性 逐 渐 减 弱,非 金 属 性 逐 渐 增 强电子层数相同化合价+1+2+3+4-4+5-3+6-2+7-10最高氧化物R对应
水化
物碱性酸性气态氢化物稳定性R2OROR2O3RO2R2O5RO3R2O7对应水化物
化学式ROHR(OH)2R(OH)3H2RO3HRO3H3RO4H4RO4H2RO4HRO4递 增递 增递 减RH4RH3H2RHR金 属 性减 弱,非 金 属 性增 强2、同主族元素性质的变化规律同一主族(电子层数相同)电
子
层
数
依
次
增
多原
子
半
径
依
次
增
大单
质
还
原
性
增
强金
属
性
?
增
强原
子
半
径
增
大电
子
层
数
依
次
增
多单
质
氧
化
性
减
弱气
态
氢
化
物
稳
定
性
递
减非
金
属
性
减
弱原
子
半
径氧化
还原
性金属性
非金属
性高价氧
化对应
水化物
酸碱性气态
氢化
物稳
定性递
增单
质
还
原
性
增
氧
化
性
递
减金
属
性
递
增
非
金
属
性
递
减碱
性
递
增
酸
性
递
减递
减元素金属性与非金属性的递变金属性逐渐增强非金属性逐渐增强金属性逐渐增强非金属性逐渐增强B
Al Si
Ge As
Sb Te
Po At 半径由大变小半径由小变大非 金 属 性 递 增金 属 性 递 增金 属 最 强 1B Al SiGe As Sb Te 2 3 4 5 6 7ⅠAⅡAⅢAⅣAⅤAⅥAⅦA 0 Po At非金属性逐渐增强 金属性逐渐增强金属性逐渐增强 非金属性逐渐增强2、元素性质与其在周期表中位置的 关系。(1)从原子结构的角度预测金属性与非金属性的递变规律
A、同一周期,从左到右,金属性逐渐减弱,非金属性逐渐增强。
B、同一主族,从上到下,金属性逐渐增强,非金属性逐渐减弱。
(2)举例证明
思考:周期表中什么元素的金属性最强?什么元素的非金属性最强,为什么?
——根据递变规律,周期表左下方的钫金属性最强,右上方的氟非金属性最强。同周期、同主族元素的递变规律依次增大逐渐增多相同逐渐减小周期性变化金属性减弱,非金属性增强碱性减弱,酸性增强逐渐增强按周期元素数增加相同依次递增逐渐增大基本相同非金属性减弱,金属性增强酸性减弱,碱性增强逐渐减弱同周期、同主族元素的递变规律依次增大逐渐增多相同逐渐减小周期性变化金属性减弱,非金属性增强还原性减弱,氧化性增强碱性减弱,酸性增强逐渐增强按周期元素数增加相同依次递增逐渐增大基本相同非金属性减弱,金属性增强氧化性减弱,还原性增强酸性减弱,碱性增强逐渐减弱(三)周期表的应用寻找催化剂寻找半导体寻找农药(四)、性质、结构、位置之间的关系原子结构元素性质元素在表中位置告诉你原子序数,应能推测原子结构、元素在周期表中位置、元素金属性、非金属性。原子序数= 核电荷数周期数= 电子层数主族序数=最外层电子数电子层数最外层电子数金属性、非金属性强弱(主族)最外层电子数 = 最高正价 最外层电子数-8 = 负价(四)、位置、结构、性质三者之间的关系:练习金属性最强的元素(不包括放射性元素)是 ;
最活泼的非金属元素是 ;
最高价氧化物对应水化物的酸性最强的元素是 ;
最高价氧化物对应水化物的碱性最强的元素(不包括放射性元素)是 。CsFClCs第三周期第IVA族的元素原子序数是:
Na元素的原子序数为11,相邻的同族元素的原子序数是:
短周期元素中,族序数=周期序数的元素有:
族序数等于周期序数2倍的元素有:
周期序数=族序数2倍的有: 练习与思考:14 3、19 H、Be 、 Al C S Li、Ca 思考:
1、同一周期阴、阳离子的电子层数一样吗?
2、X+和Y-的电子层结构相同,那么它们的离子结构是和X还是Y原子所在周期的稀有气体相同?X和Y的相对位置如何?下列各表中数字(表示原子序数)所表示的元素与它们在周期表中位置相符的一组是
练习与思考:D练习 A、B、C是周期表中相邻的三种元素,其中A、B是同周期,B、C是同主族。此三种元素原子最外层电子数之和为17,质子数之和为31,则A、B、C分别为什么元素?观察,可得A是氮元素
B是氧元素
C是硫元素1 A、B、C为短周期元素,在周期表中所处位置如下图所示。A、C两元素的原子核外电子数之和等于B原子的质子数。B原子核内质子数和中子数相等。
(1)写出A、B、C三种元素的名称 、 、 。
(2)B位于元素周期表第 周期,第 族。
(3)C的原子结构示意图为 。
(4)比较B、C的的原子半径,B C,写出A的气态氢化物与B的最高价氧化物对应水化物反应的化学方程式 。氮硫氟3VIA> 2NH3 + H2SO4 = (NH4)2SO4
16.下表为元素周期表中的一部分, 表中列出10种元素在周期表中的位置, 按要求回答下列各题(1)化学性质最不活泼的元素符号是________,金属性最强的单质与水反应的化学方程式是____________________________________。
(2)①③⑤三种元素最高价氧化物的水化物中碱性最强的物质的化学式是_____________。
(3)元素①形成的稳定的氧化物在呼吸面具中供氧时的化学方程式是 ,该化合物的焰色反应为_________色。
(4)②③⑤三种元素形成的离子, 离子半径由大到小的顺序是_____>_____>_____。Ar2K+2H2O=2KOH+H2↑NaOH 2Na2O2+2CO2=Na2CO3+O2黄Al3+Mg2+K+16.下表为元素周期表中的一部分, 表中列出10种元素在周期表中的位置, 按要求回答下列各题(5)元素⑧的单质和石灰乳作用可制成有漂白和消毒作用的漂白粉, 用化学方程式表示漂白粉在潮湿空气中起漂白作用的原理 。
(6)医学证明, 人体缺钙易患多种疾病, 特别是儿童和中老年人应经常补钙, 在各种补钙制剂中钙元素呈_____________态(填游离态或化合态)。
(7)在元素①③⑤中化学性质最活泼的元素是___________, 设计简单的化学实验证明你的结论 。
(8)在元素⑧和⑨中, 化学性质较活泼的元素是___________, 至少从三种不同角度证明你的结论。
A.__________________________________________
B.__________________________________________
C.___________________________________________
(5)CO2+Ca(ClO)2+H2O=CaCO3↓+2HClO化合Na比较它们从水中置换出氢的难易Cl比较与氢化合的难易比较气态氢化物的稳定性比较其最高价氧化物对应水化物的酸性强弱
处于同周期的相邻两种元素A和B,A的最高价氧化物的水化物的碱性比B弱,A处于B的 边(左或右);B的原子半径比A ;若B的最外层有2个电子,则A最外层有 个电子。
处于同周期的相邻两种元素A和B,A的最高价氧化物的水化物的酸性比B弱,A处于B的 边(左或右);B的原子半径比A ;若B的最外层有3个电子,则A最外层有 个电子。右大3左小2作业:课本P11 4、5(只写答案)
6、11、(抄题并做题)
世纪金榜 10---11的课时基础自测
复习:1、整理元素周期表周期(自左往右)、主族(自上而下)原子半径、元素金属性非金属性、最高价氧化物的水化物酸碱性、非金属元素氢化物稳定性变化规律。
2、元素周期表位--构---性关系。Na
11钠H
1氢He
2氦Li
3锂Be
4铍B
5硼C
6碳N
7氮O
8氧F
9氟Ne
10氖Mg
12镁Al
13铝Si
14硅P
15磷S
16硫Cl
17氯Ar
18氩K
19钾Ca
20钙12341~18号元素的排列表NaCsKLiRb
