化学计算专题-物质的量、气体摩尔体积、燃烧及关于方程式的计算
文档属性
| 名称 | 化学计算专题-物质的量、气体摩尔体积、燃烧及关于方程式的计算 |  | |
| 格式 | rar | ||
| 文件大小 | 82.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2008-03-06 22:29:00 | ||
图片预览




文档简介
化学计算专题
——物质的量、气体摩尔体积、燃烧及关于方程式的计算
[考点扫描]
1.有关物质的量的计算
2.有关气体摩尔体积的计算
3.利用化学方程式的计算
4.有关燃烧热的简单计算
[知识指津]
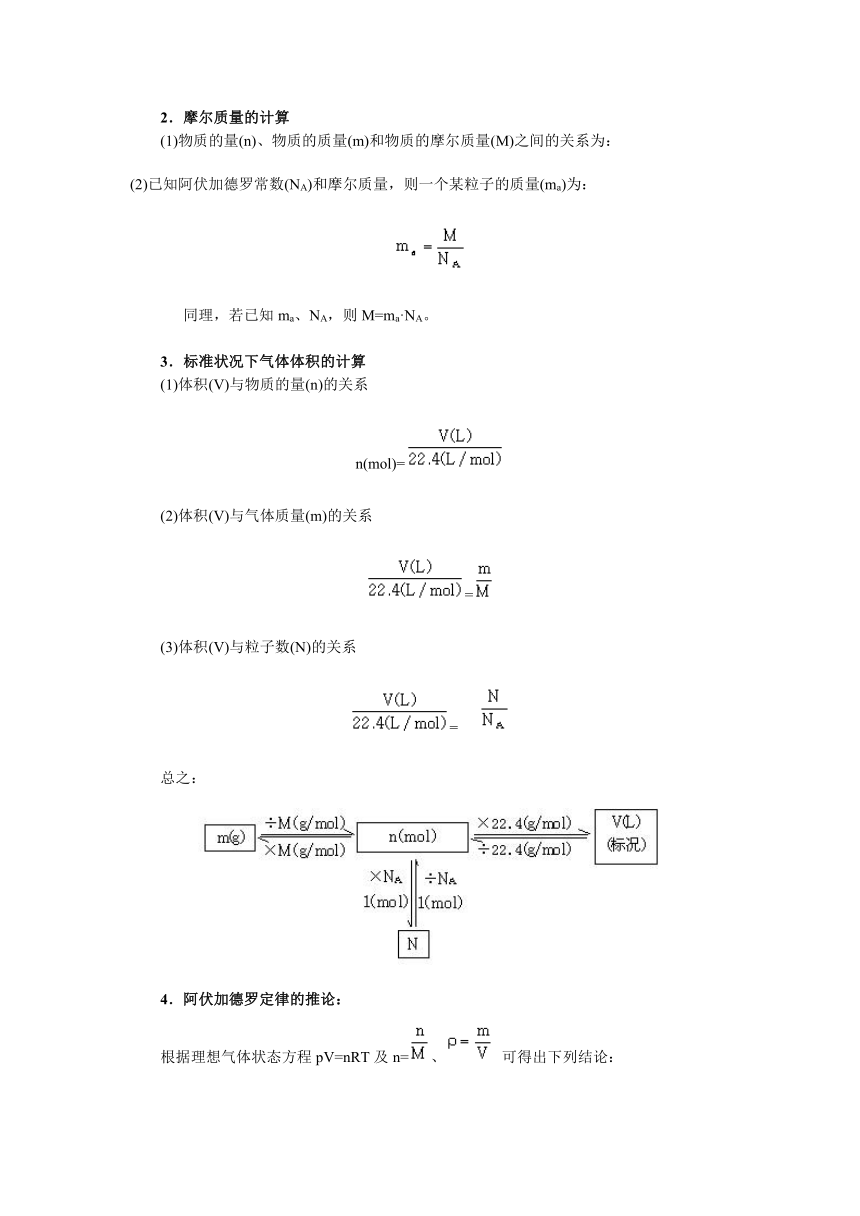
1.本章知识网络
2.摩尔质量的计算
(1)物质的量(n)、物质的质量(m)和物质的摩尔质量(M)之间的关系为:
(2)已知阿伏加德罗常数(NA)和摩尔质量,则一个某粒子的质量(ma)为:
同理,若已知ma、NA,则M=ma·NA。
3.标准状况下气体体积的计算
(1)体积(V)与物质的量(n)的关系
n(mol)=
(2)体积(V)与气体质量(m)的关系
=
(3)体积(V)与粒子数(N)的关系
=
总之:
4.阿伏加德罗定律的推论:
根据理想气体状态方程pV=nRT及n=、 可得出下列结论:
①同温同压下,气体的分子数与其体积成正比:T、p相同=
②温度、体积相同的气体,压强与其分子数成正比:T、V相同=
③分子数相等,压强相同的气体,体积与其温度成正比:n、p相同=
④分子数相等,温度相同的气体,压强与其体积成反比:n、T相同=
⑤同温同压下,气体的密度与其相对分子质量(实际是摩尔质量)成正比:T、p相同=
⑥同温同压下,体积相同的气体,相对分子质量与其质量成正比:T、P、V相同=
⑦同温同压下,等质量的气体相对分子质量与其体积成反比:T、P、m相同=
5.气体摩尔体积的计算
(标准状况下Vm=22.4L/mol)
6.关于物质的量浓度的计算
(1)基本关系式的计算公式:cB=,cB物质的量浓度,nB溶质的物质的量,V溶液的体积(L)
(2)与溶液质量分数的换算:c=
c表示物质的量浓度,表示溶液的密度,W表示溶液的质量分数,M表示溶质的摩尔质量。
(3)溶液稀释(浓缩)的计算:c1V1=c2V2(稀释定律)
稀释前后溶质的物质的量不变,用于物质的量浓度溶液稀释。
(4)气体溶于水的物质的量浓度的计算:
气体溶于水,所得溶液的体积跟水的体积不相同,溶液的体积也不等于气体的体积和水的体积的加和,必须依据溶液质量和密度来计算水溶液的体积(V=m/)。例如在标准状况下,1体积水中溶解V体积气体X,所得溶液的密度为,溶质的摩尔质量为M,计算c(X)。计算时可令1L水中溶解VL气体X。计算步骤为:
先求溶液的质量:
m(液)=1000mL×1g/mL+×M
再求溶液的体积:
V(液)= = ×10-3L/mL
最后求物质的量浓度:
c(X)==
[范例点击]
[例1] NA为阿伏加德罗常数,下列叙述正确的是( )
A.80g硝酸铵含有氮原子数为2NA
B.1L1mol·L-1的盐酸溶液中,所含氯化氢分天数为NA
C.标准状况下11.2L四氯化碳所含分子数为0.5NA
D.在铜与硫的反应中,1mol铜失去的电子数为2NA
[答案] A
[解析]
80g硝酸铵即为1molNH4NO3,含2molN;B项中盐酸溶液不存氯化氢分子,C项中标准状况下四氯化碳是液体,而不是气体。D项中铜与硫的反应产生硫化亚铜,1mol钢只失去1mole-。故B、C、D各项都是错误的叙述,仅是A项叙述正确。
[例2] 若某原子的摩尔质量是Mg/mol,则一个该原子的真实质量是( )
A.Mg
B.g
C.g
D.g
[答案] C
[解析]
摩尔质量指的是1摩尔物质的质量,即6.02×1023个粒子的质量,因此一个该原子的真实质量可用表示。
[例3] 若50滴水正好是mmL,则1滴水所含的分子数是( )
A.m×50×18×6.02×1023
B.×6.02×1023
C.×6.02×1023
D.
[答案] C、D
[解析]
由已知,1滴水的体积为mL,又因为H2O的密度为1g/cm3,故1滴水的质量即为g,相当于mol,所含的分子数为:×6.02×1023。
[答案] B
[例4] 如果ag某气体中含有的分子数为b,则cg该气体在标准状况下是(式中NA为阿伏加德罗常数)( )
A.
B.
C.
D.
[答案] A
[解析]
由题知为一个分子的质量,而×NA,即为1mol该气体质量,c÷为气体的物质的量(即为),所以体积为 L。
[例5] 下列有关气体体积的叙述中,正确的是( )
A.一定温度和压强下,各种气态物质体积的大小,由构成气体的分子大小决定
B.一定温度和压强下,各种气态物质体积的大小,由构成气体的分子数决定
C.不同的气体,若体积不同,则它们所含的分子数也不同
D.气体摩尔体积是指1mol任何气体所占的体积约为22.4L
E.一定温度和压强下,各种气体的物质的量决定了它们的体积
[答案] B、E
[解析]
A.气态物质体积与构成气体的分子大小无关,C.比较气体的体积一定要在相同状况下,D.气体摩尔体积是指在标准状况下,1mol任何气体所占的体积约为22.4L。
[例6] 在0℃和1.01x105Pa下;下列各组气体混合后得到的混合气体,其平均相对分子质量可能为40的是( )
A.N2和O2
B.CO2和O2
C.SO2
D.HI和Cl2
[答案] B、D
[解析]
HI与Cl2混合,两者发生反应:2HI+Cl2=2HCl+I2(固),因为HCl相对分子质量为36.5,只要Cl2或HI任一种气体过量(二者相对分子质量均大于40),其相对分子质量可能为40。
[例7] 在烧瓶中充满干燥标况下HCl与N2的混合气体,已知其相对分子质量是34.8,进行喷泉实验后所得溶液的物质的量浓度为( )
A.0.022mol/L
B.0.045mol/L
C.0.8mol/L
D.0.1mol/L
[答案] B
[解析]
无论HCl与N2以怎样的体积混合,当进行喷泉实验时,只有HCl所占那部分体积能被溶液所占据(N2不溶于水),故可看成是1体积HCl溶于水中形成1体积溶液。
则:C(HCl)==0.045mol/L
[例8] 300mL某浓度的NaOH溶液中含有60g溶质。现欲配制1mol·L-1的NaOH溶液,应取原溶液与蒸馏水的体积比约为( )
A.1:4
B.1:5
C.2:1
D.2:3
[答案] A
[解析]
依题意,原NaOH溶液的浓度是C(NaOH)==5mol·L-1,设原溶液与水混合时体积不变,则以体积比1:4稀释即为试题所要求的溶液。
[答案] A
[配套练习]
一、选择题(本题共10个小题,每题3分共30分,每题只有一个选项正确)
1.下列物质中,含原子个数最多的是( )
A.0.45mol氧气
B.4℃时10mL水
C.标准状况下5.6L甲烷
D.10g氖气
[答案] C
2.同温同压下,某气体对空气的密度为2,该气体是( )
A.CH4
B.C2H4
C.C2H2
D.C4H10
[答案] D
[解析]
P、T相同=或M2=M2·D(D为相对密度)=29×2=58。
3.300mL某浓度的NaOH溶液中含有60g溶质。现欲配制1mol·L-1NaOH溶液,应取原溶液与蒸馏水的体积比约为( )
A.1:4
B.1:5
C.2:1
D.2:3
[答案] A
[解析]
本题要求体积比,可设原溶液与蒸馏水的体积分别为x、y,由题意知:未告诉密度,即混合时的体积变化可忽略不计。
因此据物质的量浓度的计算式可有:=1mol·L-1,整理得x:y=1:4。
4.下列说法(NA表示阿伏加德罗常数)正确的是( )
A.在常温常压下,11.21LCl2含有的分子数为0.5NA
B.在常温常压下,1mol氦气含有的原子数为NA
C.32g氧气含有的原子数目为NA
D.在同温同压下,相同体积的任何气体单质所含的原子数目相同
[答案] B
[解析]
0.5NA个Cl2分子0.5molCl2标准状况下11.2LCl2,A不对;1molHeNA个He,与温度压强无关,B正确,32gO21molO2分子2molO原子2NA个O原子。C不正确。D据阿伏加德罗定律及注意到气体单质有叁、双、单原子分子之分,可知应是“分子数目相同”D不对。
5.20g密度为dg/mL的硝酸钙溶液里含有1gCa2+,则NO3-离子的浓度是( )
A.d/400mol/L
B.mol/L
C.2.5dmol/L
D.1.25mol/L
[答案] C
[解析]
20g硝酸钙溶液含NO3-的物质的量为(×2)mol,其体积为L,故[NO3-]==2.5dmol/L。
6.在体积为VL的密闭窖器中通入amolNO和bmolO2,反应后氮原子数和氧原子数之比为(已知2NO+O2=2NO2)( )
A.
B.
C.
D.
[答案] C
[解析]
此题看起来应属于过量计算,而a和b又不是确定的数值,所以应讨论计算。实质上,此题考查点在于,化学反应是原子的重新组合,反应前后原子数不会发生改变即原子守恒。所以反应前后的N、O原子个数比一样。
n(N)=mol n(O)=(a+2b)mol 即:=
7.用100g溶剂中所含溶质的物质的量来表示的溶液浓度叫做质量摩尔浓度,其单位是mol/kg,5mol/kg的硫酸的密度是1.2894g/cm3,则其物质的量浓度是( )
A.3.56mol/L
B.5.23mol/L
B.4.33mol/L
D.5.00mol/L
[答案]
依题意:=4.33(mol/L)
8.若NA为阿伏加德罗常数,则下列叙述正确的是( )
A.0.1mol乙醇中含有C-H键的数目为0.6NA
B.标准状况下,VL戊烷所含分子数为(V/22.4)NA
C.常温、常压下,0.2mol的SiO2所含分子数为0.2NA
D.31g白磷(P4)中含有(3/2)NA个P-P键
[答案] D
[解析]
A项中考查了乙醇的结构H--O-H,虽然每lmol乙醇中含有6molH,但其中有1molH为羟基H,故0.1mol中只含C—H键0.5NA;B项中要求分子个数,必须先求VL的物质的量,但由于戊烷标况下为液态,因此不可与22.4L/mol换算成V升体积的物质的量,因此不对;C项中,由于SiO2是原子晶体,不存在分子,故不能求分子个数;D项中首先明确白磷的结构为正四面体结构,每摩尔分子中含有6molP-P键,故=molP4 ∴6×= molP-P键,故D项正确。
9.在标准状况下,如果2.8L氧气含n个氧分子,则阿伏加德罗常数为( )
A.
B.
C.16n
D.8n
[答案] D
[解析]
应用数学表达式:物质的量= ∴阿伏加德罗常数= = =8nmol ∴应选D。
10.有五瓶溶液分别是:①10mL0.60mol·L-1NaOH水溶液,②20mL0.50mol·L-1H2SO4水溶液,③30mL0.40mol·L-1HCl水溶液,④40mL0.30mol·L-1HAc水溶液,⑤50mL0.20mol·L-1蔗糖水溶液。以上各瓶溶液所含离子、分子总数的大小顺序是( )
A.①>②>③>④>⑤
B.②>①>③>④>⑤
C.②>③>④>①>⑤
D.⑤>④>③>②>①
[答案] D
[解析]
对于NaOH溶液来说,由于NaOH完全电离,其中溶质离子的物质的量是0.60mol·L-1×2×0.01L=0.012mol;溶剂H2O的物质的量为=0.55mol;相比之下,溶剂分子占了绝大部分。其他4瓶溶液中,溶剂的物质的量更大,而且依次增大。因此,只要比较溶剂的量的大小,即可得出离子、分子总数的排列顺序。
二、选择题(本题共8个小题,每小题3分共24分,每题中有1-2个选项正确。)
11.常温常压下,分别将等物质的量的H2S、SO2充入密闭容器,最后容器内压强为混合反应前压强的( )
A.1/4
B.3/4
C.1/2
D.1/3
[答案] A
[解析]
T、V相同,P1/P2=n1/n2,设反应前压强为1大气压,两种气体各为1mol。2H2S+SO2=3S↓+2H2O,则余SO20.5摩,1/P2=2/0.5,∴P2=0.25,故答案为A。
12.下列有关使用托盘天平的叙述,不正确的是(填写标号)( )
A.称量前先调节托盘天平的零点
B.称量时左盘放被称量物,右盘放砝码
C.潮湿的或具有腐蚀性的药品,必须放在玻璃器皿里称量,其他固体药品可直接放在天平托盘上称量
D.用托盘天平可以准确称量至0.01g
[答案] C、D
[解析]
本题考查了托盘天平的使用方法及使用注意事项。使用天平时,无论称量何种性质的物品,都不能直接放在托盘称量,故C错。同时,天平为粗略称量物品质量的仪器其准确度为0.1g,读数时,不带估读数字,故D也错误。选C、D。
13.在一个密闭容器中盛有11gX气体(X的摩尔质量为44g·mol-1时,压强为1×104Pa)如果在相同温度下,把更多的气体X充入容器,使容器内压强增至5×104Pa,这时容器内气体X的分子数约变为( )
A.3.3×1025
B.3.3×1024
C.7.5×l023
D.7.5×1022
[答案] C
[解析]
本题考查学生对阿伏加德罗定律及其推论的理解和应用,属中等难度题目。推论指出:在一定温度和体积下,气体的压强比等于物质的量比,也等于其分子数比。在起始条件下气体的物质的量容易求出,即11g/44g·mol-1=0.45mol,则终态的物质的量为:×0.25mol=1.25mol,个数为1.25mol×6.02×1023mol-1=7.5×1023,答案为C。
14.假如12C相对原子质量为24,以0.024千克12C所含的12C原子数为阿伏加德罗常数。下列数值肯定不变的是( )
A.氧气的溶解度 B.气体摩尔体积
C.一定质量气体的体积 D.市售浓H2SO4的物质的量浓度
E.阿伏加德罗常数 F.O2相对分子质量
G.氧元素的相对原子质量 H.跟2mLH2相化合的O2质量、物质的量
I.一定温度下NaCl在1mL水中溶解的质量、物质的量
[答案] A、C
[解析]
此题作为“客观因素”的氧气的溶解度、一定质量的气体积、跟2mLH2相化合的O2的质量、溶解在1mL水中的NaCl的质量、一定T和P下气体的密度不会改变;而相对原子质量变为原标准的2倍,即摩尔质量变为原来的2倍,质量一定(客观因素),则物质的量将会变小了1,引起气体摩尔体积变为原来的2倍,物质的量浓度变为原来的,故选A、C。
15.将0.2molMnO2和50mL12mol·L-1盐酸混合后缓缓加热(HCl无损失),反应完全后向余下的溶液中加入足量的AgNO3溶液,下列判断生成AgCl沉淀的物质的量正确的是( )
A.等于0.3mol
B.大于0.3mol
C.大于0.3mol,小于0.6mol
D.以上结论都不正确
[答案] C
[解析]
n(HCl)=50×10-3L×12mol·L-1=0.6mol
MnO2 + 4HCl(浓) MnCl2 + Cl2↑ + 2H2O
1mol 4mol 1mol
0.2mol 0.6mol 0.15mol
n(Cl-)最大值为0.6mol,而HCl与MnO2完全反应要生成0.15molCl2且随着反应的进行,盐酸浓度下降,反应自行停止,故生成Cl2的量要小于0.15mol,故选C。
16.在常温常压下,某容器真空时质量为201.0克,当它盛满CH4时质量为203.4克,而盛满某气体Y时质量为205.5g,则Y气体可能是( )
A.O2
B.N2
C.C2H6
D.NO
[答案] C、D
[解析]
根据阿伏加德罗定律可知:同温同压下,同体积的气体中所占的分子数相同。所以同体积的不同气体的摩尔质量之比等于其质量之比。
M(CH4):M(Y)W(CH4):W(Y)
=(203.4-201.0):(205.5-201.0)=2.4:4.5
M(Y)== =30g/mol
C2H6、NO的摩尔质量均为30g/mol,故选C、D。
17.把aL硫酸铵和硝酸铵混合液分为两等份,一份需用bmol烧碱刚好把氨气全部赶出,另一份与BaCl2溶液反应恰好消耗cmolBaCl2。则原溶液中NO3-的物质的量浓度是( )
A. mol·L-1
B. mol·L-1
C. mol·L-1
D. mol·L-1
[答案] D
[解析]
每一份中n(NH4+)=bmol n(SO42-)=cmol
根据溶液呈电中性则有:
bmol=2cmol+n(NO3-)
∴n(NO3-)=(b-2c)mol
∴原溶液中:C(NO3-)= mol,选D。
18.空气和二氧化碳按体积比5:1混合,将混合气体与足量的红热焦炭充分反应。设空气中氮气和氧气的体积比为4:1,不计其他成分,且体积都是在伺温、同压下测定的,则反应后的气体中一氧化碳的体积分数是( )
A.29%
B.43%
C.50%
D.100%
[答案] C
[解析]
根据气体定律可知,在同温、同压下气体的体积之比等于气体的物质的量之比。例如:
2C+O2=2CO(C过量时,最终生成CO)
化学计量数之比2:1:2
物质的量之比2:1:2
气体体积之比1:2
从题设中可知,1体积空气中O2占1/5体积,N2占4/5体积,因而可设共有5L空气,其中的1LO2参加反应。由2C+O2=2CO,生成2LCO,余4LN2。按题意CO2为1L,它与红热焦炭反应,CO2+C=2CO,得到2LCO。所以反应后气体中有4LCO和4LN2,CO的体积分数是50%。
三、填空题(15分)
19.(1)在标准状况下,1体积水大约溶解500体积的HCl气体,所得溶液的密度为 g·cm-3,所得盐酸的质量分数为______________________,物质的量浓度为______________________。
(2)若用盛满HCl气体的烧瓶(标况下)做喷泉实验,所得溶液的密度为dg·cm-3,此时所得盐酸的质量分数为______________________,物质的量浓度为______________________。
[答案]
(1)44.9% 12.3 mol·L-1
(2)% 0.045mol·L-1
20.将一定体积的CO2通入VLNaOH溶液中,已知NaOH完全反应。在反应后向溶液中加入足量石灰水,得到mg沉淀。
(1)能否用上述数据确定参加反应的CO2的体积(标准状况)?______________________(“能”或“不能”),若能,列式表示为______________________;若不能,理由是______________________。
(2)能否用以上数据确定NaOH溶液的物质的量浓度?______________________(“能”或“不能”)。若在上述CO2与NaOH反应后的溶液中不加入石灰水而是加入足量CaCl2溶液,结果得到了ng沉淀。设原NaOH溶液的物质的量浓度为C,则①当n=m时,C=______________________;②当n=0时,C=______________________;③当n [答案]
(1)能;V(CO2)=×22.4L/mol
(2)不能;当n=m时C= mol/L或C= mol/L;当n=0时,n= mol/L;当n [答案] 2:3
四、实验题(9分)
21.某样晶是碳酸钠与碳酸氢钠的固体混合物。拟用下图装置将一定质量的样品跟稀硫酸反应,用测量生成二氧化碳气体体积的方法计算出样品中组分的质量分数。为较准确测出二氧化碳气体的体积,实验结束前加热反应混合物,不溶于溶液中的二氧化碳逸出(加热时产生的少量水蒸气忽略不计)。设在实验时的条件下,1mol气体体积为24.5L。
(1)用托盘天平称取样品wg。若所用天平游码标尺最大量程为5g,则与此天平配套的砝码中最小的砝码的质量是(填写标号)______________________。
A.1g
B.2g
C.5g
D.10g
(2)对A装置进行气密性检查最简单的方法是______________________。
(3)已知所用硫酸的浓度为0.5mol/L,A中试管的规格是20mm(内径)×200mm(长度),则在称取样品时,w的值应大于______________________g,测定气体所用量筒的规格,合适的是(填写标号)______________________。
A.50mL
B.100mL
C.25mL
D.500mL
[答案]
(1)C
(2)夹紧止水夹,在分液斗中加入较多的水后,开启分液漏斗的活塞,过一会儿,分液漏斗中液面不再下降,说明A装置气密性好,否则气密性不好。
(3)1.1;D。
22.某课外科技小组要测量CO2的相对分子质量,设计了如下实验:
(1)取一个配上合适胶塞的洁净干燥的锥形瓶称量其质量为m1g。
(2)向锥形瓶中通入干燥CO2气,塞好胶塞,称量;再重复收集,称量,至两次称量结构基本相同,得到质量m3。
已知实验时的温度为t(℃),压强p(kPa),水的密度水(g·L-1),空气平均分子量29.0,密度(空气)(g·L-1)。试回答下面问题:
(1)本实验的原理是(具体说明)____________________________________________。
(2)步骤(2)中为什么要重复操作至两次测量结果基本相同______________________。
(3)锥形瓶的容积是______________________;锥形瓶内空气质量是______________________;锥形瓶内CO2气质量是______________________;实验测得CO2的相对分子质量表达式为______________________。
[答案]
(1)阿伏加德罗定律。即同温同压下,同体积的气体,质量比等于摩尔质量之比,=
(2)定量实验一定要做平行实验,以证明实验结果准确可靠。此实验重复操作是证明瓶内空气全被排出,并充满了CO2气。
(3)V瓶= (因瓶内空气与水的质量相差悬殊,m3-m1近似看成水的质量。)m空气=V· = ·空气,m(CO2)=m2-m1+·空气·(m2-m1)表示瓶内CO2和空气质量差,再加上空气的质量,恰好为CO2气体的质量;M(CO2)= ·29(根据同T同p同V的气体=这一气态方程的推论,由于m(CO2)和m(空气)已经算出,则可计算出M(CO2)。
五、计算题(13分)
23.取50.0mLNa2CO3和Na2SO4的混合溶液,加入过量BaCl2溶液后得到14.51g白色沉淀,用过量的稀硝酸处理后沉淀量减少到4.66g,并有气体放出。试计算:
(1)原混合溶液中Na2CO3和Na2SO4的物质的量浓度;
(2)产生的气体在标准状况下的体积。
[答案] (略)
[解析]
本题涉及的反应有
Na2CO3+BaCl2=BaCO3↓+2NaCl
Na2SO4+BaCl2=BaSO4↓+2NaCl
BaCO3+2HNO3=Ba(NO3)2+CO2↑+H2O
下列物质的物质的量有等同关系:
Na2CO3~BaCO3~CO2;Na2SO4~BaSO4
由:n(Na2CO3)= =0.05(mol)
c(Na2CO3)= =1(mol·L-1)
V(CO2)=0.05×22.4=1.12(L)
c(Na2SO4)= =0.4(mol·L-1)
24.将一定量的CO2气体通入500mL某NaOH溶液,充分反应后,将溶液在低温下蒸发,得到不含结晶水的白色固体A。取三份质量不同的该白色固体A分别与50mL相同浓度的盐酸反应,得到气体的体积(标准状况)与固体A的质量关系如下表所示。
组 别 1 2 3
盐酸的体积(mL) 50 50 50
固体A的质量(g) 3.80 6.20 7.20
气体体积(mL) 896 1344 1344
(1)上表中第_____组数据表明加入的50mL盐酸反应后有剩余,其理由是_____________________________。
(2)请通过计算、讨论、判断固体A是什么物质,其成分的质量百分含量为多少?
[答案]
(1)1,1→2,固体的量增加,说明在1中有酸剩余
(2)固体为Na2CO3和NaHCO3的混合物Na2CO3%=55.79%,NaHCO3%=44.21%
[解析]
应用第1组数据计算最合理从气体CO2=0.04mol入手作假设分析
假设CO2全部是由Na2CO3转变来的,则Na2CO3的质量=0.04×106=4.24(g)
假设CO2全部是由NaHCO3转变来的,则NaHCO3的质量=0.04×84=3.36(g)
而实际固体的质量为3.80g,介于3.36g~4.24g之间,
所以,固体为Na2CO3和NaHCO3的混合物==95 1:1(物质的量比)
因此,各物质的质量百分含量Na2CO3%=×100%=55.79%,NaHCO3%=44.21%。
——物质的量、气体摩尔体积、燃烧及关于方程式的计算
[考点扫描]
1.有关物质的量的计算
2.有关气体摩尔体积的计算
3.利用化学方程式的计算
4.有关燃烧热的简单计算
[知识指津]
1.本章知识网络
2.摩尔质量的计算
(1)物质的量(n)、物质的质量(m)和物质的摩尔质量(M)之间的关系为:
(2)已知阿伏加德罗常数(NA)和摩尔质量,则一个某粒子的质量(ma)为:
同理,若已知ma、NA,则M=ma·NA。
3.标准状况下气体体积的计算
(1)体积(V)与物质的量(n)的关系
n(mol)=
(2)体积(V)与气体质量(m)的关系
=
(3)体积(V)与粒子数(N)的关系
=
总之:
4.阿伏加德罗定律的推论:
根据理想气体状态方程pV=nRT及n=、 可得出下列结论:
①同温同压下,气体的分子数与其体积成正比:T、p相同=
②温度、体积相同的气体,压强与其分子数成正比:T、V相同=
③分子数相等,压强相同的气体,体积与其温度成正比:n、p相同=
④分子数相等,温度相同的气体,压强与其体积成反比:n、T相同=
⑤同温同压下,气体的密度与其相对分子质量(实际是摩尔质量)成正比:T、p相同=
⑥同温同压下,体积相同的气体,相对分子质量与其质量成正比:T、P、V相同=
⑦同温同压下,等质量的气体相对分子质量与其体积成反比:T、P、m相同=
5.气体摩尔体积的计算
(标准状况下Vm=22.4L/mol)
6.关于物质的量浓度的计算
(1)基本关系式的计算公式:cB=,cB物质的量浓度,nB溶质的物质的量,V溶液的体积(L)
(2)与溶液质量分数的换算:c=
c表示物质的量浓度,表示溶液的密度,W表示溶液的质量分数,M表示溶质的摩尔质量。
(3)溶液稀释(浓缩)的计算:c1V1=c2V2(稀释定律)
稀释前后溶质的物质的量不变,用于物质的量浓度溶液稀释。
(4)气体溶于水的物质的量浓度的计算:
气体溶于水,所得溶液的体积跟水的体积不相同,溶液的体积也不等于气体的体积和水的体积的加和,必须依据溶液质量和密度来计算水溶液的体积(V=m/)。例如在标准状况下,1体积水中溶解V体积气体X,所得溶液的密度为,溶质的摩尔质量为M,计算c(X)。计算时可令1L水中溶解VL气体X。计算步骤为:
先求溶液的质量:
m(液)=1000mL×1g/mL+×M
再求溶液的体积:
V(液)= = ×10-3L/mL
最后求物质的量浓度:
c(X)==
[范例点击]
[例1] NA为阿伏加德罗常数,下列叙述正确的是( )
A.80g硝酸铵含有氮原子数为2NA
B.1L1mol·L-1的盐酸溶液中,所含氯化氢分天数为NA
C.标准状况下11.2L四氯化碳所含分子数为0.5NA
D.在铜与硫的反应中,1mol铜失去的电子数为2NA
[答案] A
[解析]
80g硝酸铵即为1molNH4NO3,含2molN;B项中盐酸溶液不存氯化氢分子,C项中标准状况下四氯化碳是液体,而不是气体。D项中铜与硫的反应产生硫化亚铜,1mol钢只失去1mole-。故B、C、D各项都是错误的叙述,仅是A项叙述正确。
[例2] 若某原子的摩尔质量是Mg/mol,则一个该原子的真实质量是( )
A.Mg
B.g
C.g
D.g
[答案] C
[解析]
摩尔质量指的是1摩尔物质的质量,即6.02×1023个粒子的质量,因此一个该原子的真实质量可用表示。
[例3] 若50滴水正好是mmL,则1滴水所含的分子数是( )
A.m×50×18×6.02×1023
B.×6.02×1023
C.×6.02×1023
D.
[答案] C、D
[解析]
由已知,1滴水的体积为mL,又因为H2O的密度为1g/cm3,故1滴水的质量即为g,相当于mol,所含的分子数为:×6.02×1023。
[答案] B
[例4] 如果ag某气体中含有的分子数为b,则cg该气体在标准状况下是(式中NA为阿伏加德罗常数)( )
A.
B.
C.
D.
[答案] A
[解析]
由题知为一个分子的质量,而×NA,即为1mol该气体质量,c÷为气体的物质的量(即为),所以体积为 L。
[例5] 下列有关气体体积的叙述中,正确的是( )
A.一定温度和压强下,各种气态物质体积的大小,由构成气体的分子大小决定
B.一定温度和压强下,各种气态物质体积的大小,由构成气体的分子数决定
C.不同的气体,若体积不同,则它们所含的分子数也不同
D.气体摩尔体积是指1mol任何气体所占的体积约为22.4L
E.一定温度和压强下,各种气体的物质的量决定了它们的体积
[答案] B、E
[解析]
A.气态物质体积与构成气体的分子大小无关,C.比较气体的体积一定要在相同状况下,D.气体摩尔体积是指在标准状况下,1mol任何气体所占的体积约为22.4L。
[例6] 在0℃和1.01x105Pa下;下列各组气体混合后得到的混合气体,其平均相对分子质量可能为40的是( )
A.N2和O2
B.CO2和O2
C.SO2
D.HI和Cl2
[答案] B、D
[解析]
HI与Cl2混合,两者发生反应:2HI+Cl2=2HCl+I2(固),因为HCl相对分子质量为36.5,只要Cl2或HI任一种气体过量(二者相对分子质量均大于40),其相对分子质量可能为40。
[例7] 在烧瓶中充满干燥标况下HCl与N2的混合气体,已知其相对分子质量是34.8,进行喷泉实验后所得溶液的物质的量浓度为( )
A.0.022mol/L
B.0.045mol/L
C.0.8mol/L
D.0.1mol/L
[答案] B
[解析]
无论HCl与N2以怎样的体积混合,当进行喷泉实验时,只有HCl所占那部分体积能被溶液所占据(N2不溶于水),故可看成是1体积HCl溶于水中形成1体积溶液。
则:C(HCl)==0.045mol/L
[例8] 300mL某浓度的NaOH溶液中含有60g溶质。现欲配制1mol·L-1的NaOH溶液,应取原溶液与蒸馏水的体积比约为( )
A.1:4
B.1:5
C.2:1
D.2:3
[答案] A
[解析]
依题意,原NaOH溶液的浓度是C(NaOH)==5mol·L-1,设原溶液与水混合时体积不变,则以体积比1:4稀释即为试题所要求的溶液。
[答案] A
[配套练习]
一、选择题(本题共10个小题,每题3分共30分,每题只有一个选项正确)
1.下列物质中,含原子个数最多的是( )
A.0.45mol氧气
B.4℃时10mL水
C.标准状况下5.6L甲烷
D.10g氖气
[答案] C
2.同温同压下,某气体对空气的密度为2,该气体是( )
A.CH4
B.C2H4
C.C2H2
D.C4H10
[答案] D
[解析]
P、T相同=或M2=M2·D(D为相对密度)=29×2=58。
3.300mL某浓度的NaOH溶液中含有60g溶质。现欲配制1mol·L-1NaOH溶液,应取原溶液与蒸馏水的体积比约为( )
A.1:4
B.1:5
C.2:1
D.2:3
[答案] A
[解析]
本题要求体积比,可设原溶液与蒸馏水的体积分别为x、y,由题意知:未告诉密度,即混合时的体积变化可忽略不计。
因此据物质的量浓度的计算式可有:=1mol·L-1,整理得x:y=1:4。
4.下列说法(NA表示阿伏加德罗常数)正确的是( )
A.在常温常压下,11.21LCl2含有的分子数为0.5NA
B.在常温常压下,1mol氦气含有的原子数为NA
C.32g氧气含有的原子数目为NA
D.在同温同压下,相同体积的任何气体单质所含的原子数目相同
[答案] B
[解析]
0.5NA个Cl2分子0.5molCl2标准状况下11.2LCl2,A不对;1molHeNA个He,与温度压强无关,B正确,32gO21molO2分子2molO原子2NA个O原子。C不正确。D据阿伏加德罗定律及注意到气体单质有叁、双、单原子分子之分,可知应是“分子数目相同”D不对。
5.20g密度为dg/mL的硝酸钙溶液里含有1gCa2+,则NO3-离子的浓度是( )
A.d/400mol/L
B.mol/L
C.2.5dmol/L
D.1.25mol/L
[答案] C
[解析]
20g硝酸钙溶液含NO3-的物质的量为(×2)mol,其体积为L,故[NO3-]==2.5dmol/L。
6.在体积为VL的密闭窖器中通入amolNO和bmolO2,反应后氮原子数和氧原子数之比为(已知2NO+O2=2NO2)( )
A.
B.
C.
D.
[答案] C
[解析]
此题看起来应属于过量计算,而a和b又不是确定的数值,所以应讨论计算。实质上,此题考查点在于,化学反应是原子的重新组合,反应前后原子数不会发生改变即原子守恒。所以反应前后的N、O原子个数比一样。
n(N)=mol n(O)=(a+2b)mol 即:=
7.用100g溶剂中所含溶质的物质的量来表示的溶液浓度叫做质量摩尔浓度,其单位是mol/kg,5mol/kg的硫酸的密度是1.2894g/cm3,则其物质的量浓度是( )
A.3.56mol/L
B.5.23mol/L
B.4.33mol/L
D.5.00mol/L
[答案]
依题意:=4.33(mol/L)
8.若NA为阿伏加德罗常数,则下列叙述正确的是( )
A.0.1mol乙醇中含有C-H键的数目为0.6NA
B.标准状况下,VL戊烷所含分子数为(V/22.4)NA
C.常温、常压下,0.2mol的SiO2所含分子数为0.2NA
D.31g白磷(P4)中含有(3/2)NA个P-P键
[答案] D
[解析]
A项中考查了乙醇的结构H--O-H,虽然每lmol乙醇中含有6molH,但其中有1molH为羟基H,故0.1mol中只含C—H键0.5NA;B项中要求分子个数,必须先求VL的物质的量,但由于戊烷标况下为液态,因此不可与22.4L/mol换算成V升体积的物质的量,因此不对;C项中,由于SiO2是原子晶体,不存在分子,故不能求分子个数;D项中首先明确白磷的结构为正四面体结构,每摩尔分子中含有6molP-P键,故=molP4 ∴6×= molP-P键,故D项正确。
9.在标准状况下,如果2.8L氧气含n个氧分子,则阿伏加德罗常数为( )
A.
B.
C.16n
D.8n
[答案] D
[解析]
应用数学表达式:物质的量= ∴阿伏加德罗常数= = =8nmol ∴应选D。
10.有五瓶溶液分别是:①10mL0.60mol·L-1NaOH水溶液,②20mL0.50mol·L-1H2SO4水溶液,③30mL0.40mol·L-1HCl水溶液,④40mL0.30mol·L-1HAc水溶液,⑤50mL0.20mol·L-1蔗糖水溶液。以上各瓶溶液所含离子、分子总数的大小顺序是( )
A.①>②>③>④>⑤
B.②>①>③>④>⑤
C.②>③>④>①>⑤
D.⑤>④>③>②>①
[答案] D
[解析]
对于NaOH溶液来说,由于NaOH完全电离,其中溶质离子的物质的量是0.60mol·L-1×2×0.01L=0.012mol;溶剂H2O的物质的量为=0.55mol;相比之下,溶剂分子占了绝大部分。其他4瓶溶液中,溶剂的物质的量更大,而且依次增大。因此,只要比较溶剂的量的大小,即可得出离子、分子总数的排列顺序。
二、选择题(本题共8个小题,每小题3分共24分,每题中有1-2个选项正确。)
11.常温常压下,分别将等物质的量的H2S、SO2充入密闭容器,最后容器内压强为混合反应前压强的( )
A.1/4
B.3/4
C.1/2
D.1/3
[答案] A
[解析]
T、V相同,P1/P2=n1/n2,设反应前压强为1大气压,两种气体各为1mol。2H2S+SO2=3S↓+2H2O,则余SO20.5摩,1/P2=2/0.5,∴P2=0.25,故答案为A。
12.下列有关使用托盘天平的叙述,不正确的是(填写标号)( )
A.称量前先调节托盘天平的零点
B.称量时左盘放被称量物,右盘放砝码
C.潮湿的或具有腐蚀性的药品,必须放在玻璃器皿里称量,其他固体药品可直接放在天平托盘上称量
D.用托盘天平可以准确称量至0.01g
[答案] C、D
[解析]
本题考查了托盘天平的使用方法及使用注意事项。使用天平时,无论称量何种性质的物品,都不能直接放在托盘称量,故C错。同时,天平为粗略称量物品质量的仪器其准确度为0.1g,读数时,不带估读数字,故D也错误。选C、D。
13.在一个密闭容器中盛有11gX气体(X的摩尔质量为44g·mol-1时,压强为1×104Pa)如果在相同温度下,把更多的气体X充入容器,使容器内压强增至5×104Pa,这时容器内气体X的分子数约变为( )
A.3.3×1025
B.3.3×1024
C.7.5×l023
D.7.5×1022
[答案] C
[解析]
本题考查学生对阿伏加德罗定律及其推论的理解和应用,属中等难度题目。推论指出:在一定温度和体积下,气体的压强比等于物质的量比,也等于其分子数比。在起始条件下气体的物质的量容易求出,即11g/44g·mol-1=0.45mol,则终态的物质的量为:×0.25mol=1.25mol,个数为1.25mol×6.02×1023mol-1=7.5×1023,答案为C。
14.假如12C相对原子质量为24,以0.024千克12C所含的12C原子数为阿伏加德罗常数。下列数值肯定不变的是( )
A.氧气的溶解度 B.气体摩尔体积
C.一定质量气体的体积 D.市售浓H2SO4的物质的量浓度
E.阿伏加德罗常数 F.O2相对分子质量
G.氧元素的相对原子质量 H.跟2mLH2相化合的O2质量、物质的量
I.一定温度下NaCl在1mL水中溶解的质量、物质的量
[答案] A、C
[解析]
此题作为“客观因素”的氧气的溶解度、一定质量的气体积、跟2mLH2相化合的O2的质量、溶解在1mL水中的NaCl的质量、一定T和P下气体的密度不会改变;而相对原子质量变为原标准的2倍,即摩尔质量变为原来的2倍,质量一定(客观因素),则物质的量将会变小了1,引起气体摩尔体积变为原来的2倍,物质的量浓度变为原来的,故选A、C。
15.将0.2molMnO2和50mL12mol·L-1盐酸混合后缓缓加热(HCl无损失),反应完全后向余下的溶液中加入足量的AgNO3溶液,下列判断生成AgCl沉淀的物质的量正确的是( )
A.等于0.3mol
B.大于0.3mol
C.大于0.3mol,小于0.6mol
D.以上结论都不正确
[答案] C
[解析]
n(HCl)=50×10-3L×12mol·L-1=0.6mol
MnO2 + 4HCl(浓) MnCl2 + Cl2↑ + 2H2O
1mol 4mol 1mol
0.2mol 0.6mol 0.15mol
n(Cl-)最大值为0.6mol,而HCl与MnO2完全反应要生成0.15molCl2且随着反应的进行,盐酸浓度下降,反应自行停止,故生成Cl2的量要小于0.15mol,故选C。
16.在常温常压下,某容器真空时质量为201.0克,当它盛满CH4时质量为203.4克,而盛满某气体Y时质量为205.5g,则Y气体可能是( )
A.O2
B.N2
C.C2H6
D.NO
[答案] C、D
[解析]
根据阿伏加德罗定律可知:同温同压下,同体积的气体中所占的分子数相同。所以同体积的不同气体的摩尔质量之比等于其质量之比。
M(CH4):M(Y)W(CH4):W(Y)
=(203.4-201.0):(205.5-201.0)=2.4:4.5
M(Y)== =30g/mol
C2H6、NO的摩尔质量均为30g/mol,故选C、D。
17.把aL硫酸铵和硝酸铵混合液分为两等份,一份需用bmol烧碱刚好把氨气全部赶出,另一份与BaCl2溶液反应恰好消耗cmolBaCl2。则原溶液中NO3-的物质的量浓度是( )
A. mol·L-1
B. mol·L-1
C. mol·L-1
D. mol·L-1
[答案] D
[解析]
每一份中n(NH4+)=bmol n(SO42-)=cmol
根据溶液呈电中性则有:
bmol=2cmol+n(NO3-)
∴n(NO3-)=(b-2c)mol
∴原溶液中:C(NO3-)= mol,选D。
18.空气和二氧化碳按体积比5:1混合,将混合气体与足量的红热焦炭充分反应。设空气中氮气和氧气的体积比为4:1,不计其他成分,且体积都是在伺温、同压下测定的,则反应后的气体中一氧化碳的体积分数是( )
A.29%
B.43%
C.50%
D.100%
[答案] C
[解析]
根据气体定律可知,在同温、同压下气体的体积之比等于气体的物质的量之比。例如:
2C+O2=2CO(C过量时,最终生成CO)
化学计量数之比2:1:2
物质的量之比2:1:2
气体体积之比1:2
从题设中可知,1体积空气中O2占1/5体积,N2占4/5体积,因而可设共有5L空气,其中的1LO2参加反应。由2C+O2=2CO,生成2LCO,余4LN2。按题意CO2为1L,它与红热焦炭反应,CO2+C=2CO,得到2LCO。所以反应后气体中有4LCO和4LN2,CO的体积分数是50%。
三、填空题(15分)
19.(1)在标准状况下,1体积水大约溶解500体积的HCl气体,所得溶液的密度为 g·cm-3,所得盐酸的质量分数为______________________,物质的量浓度为______________________。
(2)若用盛满HCl气体的烧瓶(标况下)做喷泉实验,所得溶液的密度为dg·cm-3,此时所得盐酸的质量分数为______________________,物质的量浓度为______________________。
[答案]
(1)44.9% 12.3 mol·L-1
(2)% 0.045mol·L-1
20.将一定体积的CO2通入VLNaOH溶液中,已知NaOH完全反应。在反应后向溶液中加入足量石灰水,得到mg沉淀。
(1)能否用上述数据确定参加反应的CO2的体积(标准状况)?______________________(“能”或“不能”),若能,列式表示为______________________;若不能,理由是______________________。
(2)能否用以上数据确定NaOH溶液的物质的量浓度?______________________(“能”或“不能”)。若在上述CO2与NaOH反应后的溶液中不加入石灰水而是加入足量CaCl2溶液,结果得到了ng沉淀。设原NaOH溶液的物质的量浓度为C,则①当n=m时,C=______________________;②当n=0时,C=______________________;③当n
(1)能;V(CO2)=×22.4L/mol
(2)不能;当n=m时C= mol/L或C= mol/L;当n=0时,n= mol/L;当n
四、实验题(9分)
21.某样晶是碳酸钠与碳酸氢钠的固体混合物。拟用下图装置将一定质量的样品跟稀硫酸反应,用测量生成二氧化碳气体体积的方法计算出样品中组分的质量分数。为较准确测出二氧化碳气体的体积,实验结束前加热反应混合物,不溶于溶液中的二氧化碳逸出(加热时产生的少量水蒸气忽略不计)。设在实验时的条件下,1mol气体体积为24.5L。
(1)用托盘天平称取样品wg。若所用天平游码标尺最大量程为5g,则与此天平配套的砝码中最小的砝码的质量是(填写标号)______________________。
A.1g
B.2g
C.5g
D.10g
(2)对A装置进行气密性检查最简单的方法是______________________。
(3)已知所用硫酸的浓度为0.5mol/L,A中试管的规格是20mm(内径)×200mm(长度),则在称取样品时,w的值应大于______________________g,测定气体所用量筒的规格,合适的是(填写标号)______________________。
A.50mL
B.100mL
C.25mL
D.500mL
[答案]
(1)C
(2)夹紧止水夹,在分液斗中加入较多的水后,开启分液漏斗的活塞,过一会儿,分液漏斗中液面不再下降,说明A装置气密性好,否则气密性不好。
(3)1.1;D。
22.某课外科技小组要测量CO2的相对分子质量,设计了如下实验:
(1)取一个配上合适胶塞的洁净干燥的锥形瓶称量其质量为m1g。
(2)向锥形瓶中通入干燥CO2气,塞好胶塞,称量;再重复收集,称量,至两次称量结构基本相同,得到质量m3。
已知实验时的温度为t(℃),压强p(kPa),水的密度水(g·L-1),空气平均分子量29.0,密度(空气)(g·L-1)。试回答下面问题:
(1)本实验的原理是(具体说明)____________________________________________。
(2)步骤(2)中为什么要重复操作至两次测量结果基本相同______________________。
(3)锥形瓶的容积是______________________;锥形瓶内空气质量是______________________;锥形瓶内CO2气质量是______________________;实验测得CO2的相对分子质量表达式为______________________。
[答案]
(1)阿伏加德罗定律。即同温同压下,同体积的气体,质量比等于摩尔质量之比,=
(2)定量实验一定要做平行实验,以证明实验结果准确可靠。此实验重复操作是证明瓶内空气全被排出,并充满了CO2气。
(3)V瓶= (因瓶内空气与水的质量相差悬殊,m3-m1近似看成水的质量。)m空气=V· = ·空气,m(CO2)=m2-m1+·空气·(m2-m1)表示瓶内CO2和空气质量差,再加上空气的质量,恰好为CO2气体的质量;M(CO2)= ·29(根据同T同p同V的气体=这一气态方程的推论,由于m(CO2)和m(空气)已经算出,则可计算出M(CO2)。
五、计算题(13分)
23.取50.0mLNa2CO3和Na2SO4的混合溶液,加入过量BaCl2溶液后得到14.51g白色沉淀,用过量的稀硝酸处理后沉淀量减少到4.66g,并有气体放出。试计算:
(1)原混合溶液中Na2CO3和Na2SO4的物质的量浓度;
(2)产生的气体在标准状况下的体积。
[答案] (略)
[解析]
本题涉及的反应有
Na2CO3+BaCl2=BaCO3↓+2NaCl
Na2SO4+BaCl2=BaSO4↓+2NaCl
BaCO3+2HNO3=Ba(NO3)2+CO2↑+H2O
下列物质的物质的量有等同关系:
Na2CO3~BaCO3~CO2;Na2SO4~BaSO4
由:n(Na2CO3)= =0.05(mol)
c(Na2CO3)= =1(mol·L-1)
V(CO2)=0.05×22.4=1.12(L)
c(Na2SO4)= =0.4(mol·L-1)
24.将一定量的CO2气体通入500mL某NaOH溶液,充分反应后,将溶液在低温下蒸发,得到不含结晶水的白色固体A。取三份质量不同的该白色固体A分别与50mL相同浓度的盐酸反应,得到气体的体积(标准状况)与固体A的质量关系如下表所示。
组 别 1 2 3
盐酸的体积(mL) 50 50 50
固体A的质量(g) 3.80 6.20 7.20
气体体积(mL) 896 1344 1344
(1)上表中第_____组数据表明加入的50mL盐酸反应后有剩余,其理由是_____________________________。
(2)请通过计算、讨论、判断固体A是什么物质,其成分的质量百分含量为多少?
[答案]
(1)1,1→2,固体的量增加,说明在1中有酸剩余
(2)固体为Na2CO3和NaHCO3的混合物Na2CO3%=55.79%,NaHCO3%=44.21%
[解析]
应用第1组数据计算最合理从气体CO2=0.04mol入手作假设分析
假设CO2全部是由Na2CO3转变来的,则Na2CO3的质量=0.04×106=4.24(g)
假设CO2全部是由NaHCO3转变来的,则NaHCO3的质量=0.04×84=3.36(g)
而实际固体的质量为3.80g,介于3.36g~4.24g之间,
所以,固体为Na2CO3和NaHCO3的混合物==95 1:1(物质的量比)
因此,各物质的质量百分含量Na2CO3%=×100%=55.79%,NaHCO3%=44.21%。
同课章节目录
