化学反应中的热效应
图片预览











文档简介
课件52张PPT。专题1 化学反应与能量变化第一单元 化学反应中的热效应化学反应的焓变化学反应的反应热:
化学反应过程中,所吸收或放出的热量常见的放热反应: 所有的燃烧反应
所有的中和反应
活泼金属与水、酸的反应
多数的化合反应
以下特殊的化合反应是吸热反应:常见的吸热反应:
所有的电离过程
所有的水解反应
多数的分解反应C+H2O= H2+ CO
H2+CuO=Cu +H2O一、焓变
1、概念:在恒温、恒压下,化学反应过程中吸
收或放出的热量称为反应的焓变。
2、符号:△H
单位:kJ/mol
3、规定
放热: △H<0 Q>0
吸热: △H>0 Q<0
二、热化学方程式:
1、概念:能够表示反应热的化学方程式叫做热化学方程式。热化学方程式与化学方程式有什么不同?
如何正确书写热化学方程式?
热化学方程式有什么意义?第2页的交流与讨论热化学方程式与化学方程式的差别:
1、△H只用在热化学方程式中,并写在右边4、与参加反应的物质的物质的量有关。同一化
学反应中,热化学方程式中物质的化学计量
数不同, △H也不同。化学计量数加倍,
△H也要加倍。3、热化学方程式中的化学计量数可以是整数,
也可以是分数。2、热化学方程式中必须注明物质的聚集状态
气态(g)、液态(l)、固态(s)5、书写热化学方程式时应注明反应的温度
和压强。如果不注明温度和压强,则表
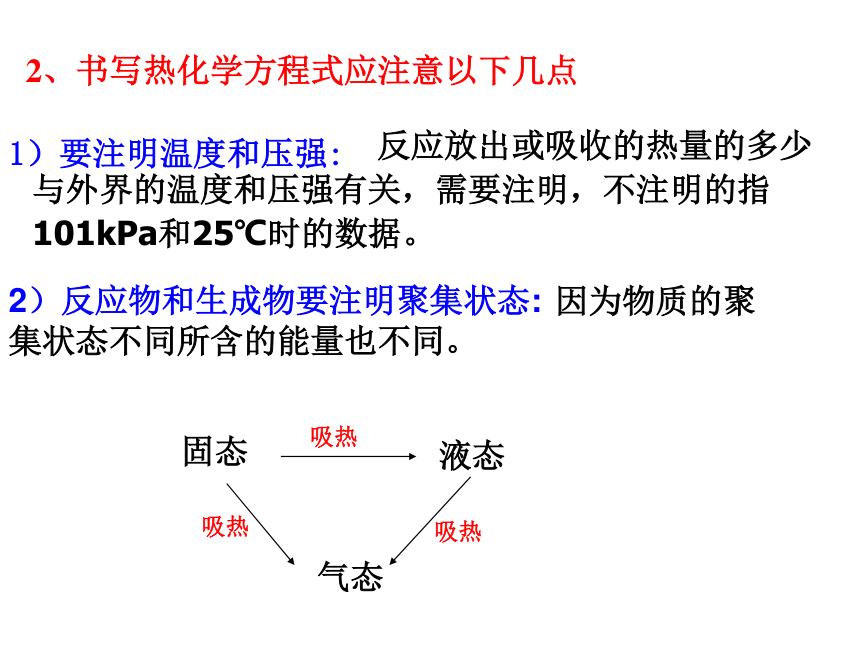
示是在250C、101KPa条件下的反应热。第3页的交流与讨论 反应放出或吸收的热量的多少与外界的温度和压强有关,需要注明,不注明的指101kPa和25℃时的数据。 因为物质的聚集状态不同所含的能量也不同。 固态
液态吸热气态吸热吸热1)要注明温度和压强:2)反应物和生成物要注明聚集状态: 2、书写热化学方程式应注意以下几点 H2(g)+ O2(g)=H2O(l);△H=-285.8KJ/mol
H2(g)+ O2(g)=H2O(g);△H=-241.8KJ/mol ∴H2O(l)═H2O(g);△H=+44KJ/mol 3)热化学方程式中各物质前的化学计量数表示物质的量不表示分子数。H2(g)+Cl2(g)=2HCl(g);△H=-184.6KJ/mol H2(g)+ Cl2(g)=HCl(g);△H=-92.3KJ/mol 2H2(g)+O2(g)=2H2O(l);△H=-571.6KJ/mol H2(g)+ O2(g)=H2O(l);△H=-285.8KJ/mol4) △H的表示:
热化学方程式中的△H的“+”与“-”一定要注明, “+”代表吸热, “-”代表放热
无论热化学方程式中化学计量数为多少,△H的单位总是KJ/mol,但△H的数值与反应式中的系数成比例3、热化学方程式表示的意义 1)表示什么物质参加反应,结果生成什么物质2)反应物和生成物之间的质量比、物质的量比3)反应物完全变成生成物后所放出或吸收的热量。质→量→能H2(g)+ O2(g)=H2O(g);△H=-241.8KJ/mol 一个化学反应是吸收能量还是放出能量,取决于
反应物的总能量与生成物的总能量的相对大小。△H=E生总能量-E反总能量
吸热反应: △H>0 E生总能量>E反总能量
放热反应: △H<0 E反总能量>E生总能量化学反应过程中为什么会有能量的变化呢?化学反应本质上是分子中的旧键断裂形成原子,原子间重新组合形成新键,进而形成新的分子的过程.旧键的断裂会吸收热量,而新键的形成会放出热量,反应是放出还是吸收能量取决于两者之间的相对大小.化学反应中,化学键的断裂和形成是反应过程中
有能量变化的本质原因。
△H=E反总键能-E生总键能第5页的问题解决2、下列变化中,属于吸热反应的是( )
A.氮气与氢气合成氨
B.酸碱中和
C.二氧化硫与氧气反应生成三氧化硫
D.焦炭与高温水蒸气反应
D[练习]
1、下列变化中,属于放热反应的是( )
A.Ba(OH)2·8H2O与NH4Cl的反应
B.点燃的镁条在二氧化碳中继续燃烧
C.灼热的碳与二氧化碳的反应
D.氯化铝的水解B3. 下列叙述中正确的是( )
A.在稀溶液中1mol酸和1mol碱完全反应所放出的热量,叫做中和热
B.在101kPa时1mol物质燃烧时的反应热叫做该物质的标准燃烧热
C.热化学方程式中,各物质前的化学计量数不表示分子个数
D.如果反应物所具有的总能量小于生成物所 具有的总能量,则发生的反应是放热反应。 C4.下列反应属于吸热反应的是 ( )
A. C6H12O6(葡萄糖aq)+6O2 6CO2+6H2O
B. CH3COOH+KOH CH3COOK+H2O
C. A+B C+D; △H<0
D.破坏生成物全部化学键所需能量小于破坏
反应物全部化学键所需能量 酶DAC6.分析右面的能量变化示意图,下列热化学方程式正确的是 ( )
A.2A(g)+ B(g)=2C(g);△H=a(a>0)
B.2A(g)+ B(g)=2C(g);△H=a(a<0)
C.2A + B=2 C;△H=a(a<0)
D.2C=2A +B;△H=a(a>0)
B7、化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)出的能量。已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能(kJ·mol?1):P—P:198 P—O:360 O=O:498则反应P4(白磷)+3O2= P4O6
的反应热△H为 ( )
A.-1638 kJ·mol?1
B.+1638 kJ·mol?1
C.-126 kJ·mol?1
D.+126 kJ·mol?1A反应热的测量与计算专题1 化学反应与能量变化第一单元 化学反应中的热效应反应热的测量与计算获得化学反应热的主要途径:
1、实验直接测定
2、间接计算获得
(1)根据盖斯定律计算
(2)根据公式△H=E反总键能-E生总键能 计算根据第6页中的“活动与探究”思考:
1、测定反应热时,量热计直接测定的数据是
焓变吗?如果不是直接测定的是什么?
2、实验中的反应原理是什么?
3、要获得比较精确的数据,该实验应该注意
什么问题?一、反应热的测定
1、量热计直接测定的是体系的温度变化2、HCl与NaOH反应的反应热测定原理:1mol 1mol -akJ
0.025mol 0.025mol -bkJ由实验可以测定出b值,然后便可换算出a中和热:在稀溶液中,酸和碱发生中和反应生
成1mol水时所放出的热量由于电离过程是吸热的,而弱酸、弱碱都较难电离,
所以,强酸与弱碱、强碱与弱酸、弱酸与弱碱反
应生成1mol水时所放出的热量都小于57.3 kJ。3、测定反应热时一定要采取较好的绝热措施,
动作要快,以减小实验误差。强酸和强碱在稀溶液中的中和热可表示为:
H+(aq)+OH-(aq)=H2O(l) △H= -57.3k kJ·mol?1,
又知道溶液中的反应有:
CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l) △H=-Q1kJ·mol?1
H2SO4(浓)+NaOH(aq)=Na2SO4(aq)+H2O(l) △H= -Q2 kJ·mol?1
HNO3(aq)+KOH(aq)=KNO3(aq)+H2O(l) △H= -Q3 kJ·mol?1,
则Q1、Q2、Q3的关系正确的是 ( )
Q1 = Q2 = Q3 B.Q2 > Q1 > Q3
C. Q2 > Q3 > Q1 D. Q2 = Q3 > Q1C二、盖斯定律
1、概念:一个化学反应,不论是一步完成,还是
分步完成,其总的热效应是完全相同的。盖斯定律表明:一个化学反应的焓变仅与反应的起始状态和反应的最终状态有关,而与反应的途径无关。第7页例题△H=△H1+△H2①C(s)+1/2O2(g)==CO(g) ΔH1=?
②CO(g)+1/2O2(g)== CO2(g) ΔH2=-283.0kJ/mol
③C(s)+O2(g)==CO2(g) ΔH3=-393.5kJ/mol
① + ② = ③ ,
则 ΔH1 + ΔH2 =ΔH3
所以, ΔH1 =ΔH3- ΔH2 =-393.5kJ/mol+ 283.0kJ/mol=-110.5kJ/mol应用了什么规律?如何测定C(s)+1/2O2(g)==CO(g)的反应热△H12、计算
(1)若一个反应的焓变△H=a kJ·mol?1,则其逆反
应的焓变△H= -a kJ·mol?1
(2)若一个化学反应方程式可由另外几个反应
的化学方程式相加减而得到,则该反应的
焓变亦可以由这几个反应的焓变相加减而得到。第8页的问题解决【例题1】已知
① CO(g) + 1/2 O2(g) ====CO2(g)
ΔH1= -283.0 kJ/mol
② H2(g) + 1/2 O2(g) ====H2O(l) ΔH2= -285.8 kJ/mol
③C2H5OH(l) + 3 O2(g) ==== 2 CO2(g) + 3 H2O(l)
ΔH3=-1370 kJ/mol
试计算④2CO(g)+ 4 H2(g)==== H2O(l)+ C2H5OH(l) 的ΔH ?????
【解】:根据盖斯定律,反应④不论是一步完成还是分几步完成,其反应热效应都是相同的。下面就看看反应④能不能由①②③三个反应通过加减乘除组合而成,也就是说,看看反应④能不能分成①②③几步完成。①×2 + ②×4 - ③ = ④ ?? 所以,ΔH=ΔH1×2 +ΔH2×4 -ΔH3 ?????=-283.2×2 -285.8×4 +1370 =-339.2 kJ/mol 你知道神六的火箭燃料是什么吗?例2:某次发射火箭,用N2H4(肼)在NO2中燃烧,生成N2、液态H2O。已知:
N2(g)+2O2(g)==2NO2(g) △H1=+67.2kJ/mol
N2H4(g)+O2(g)==N2(g)+2H2O(l) △H2=-534kJ/mol
假如都在相同状态下,请写出发射火箭反应的热化学方程式。
2 N2H4(g)+ 2NO2(g)== 3N2(g)+4H2O(l) △H=-1135.2kJ/mol 例3、 已知25℃、101kPa下,石墨、金刚石燃烧的热化学方程式分别为:
据此判断,下列说法正确的是( )
A. 由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的低
B. 由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的高
C. 由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的低
D. 由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的高D能源的充分利用1、你所了解的传统能源有哪些?新能源又有哪些?2、能源又可以分为一次能源和二次能源。一次能源
是指直接取自自然界,没有加工转换的各种能量
和资源;二次能源是指由一次能源经过加工转换
后得到的能源。根据这种分类法,请将上面提到
的能源重新分类?思考:在许多场合将煤块直接燃烧,这种燃烧方式
存在什么缺陷?采用这种方式燃烧煤,煤与空气的接触面积不够,
内部煤的燃烧效率偏低,浪费了能源。另外,直接
燃烧煤会使其中的硫转化为二氧化硫,引起大气的
污染。有哪些可以提高煤的燃烧效率的方法吗?目前常用的方法主要有三种:
(1)将煤制成蜂窝状,以增加与空气的接触面积
(2)通过一定的方法将煤转化为液体燃料(如甲醇)
(3)通过一定的方法将煤转化为气体燃料(如煤气)完成第9页的“交流与讨论”,提出你的观点。虽然将煤转化为水煤气再燃烧与直接燃烧煤所获得
的能量是一样的,而且将煤转化为水煤气会增加消
耗。但将煤转化为水煤气至少有两个优点:
一是将固体煤转化为气体,极大地提高了燃烧效率;
二是通过转化除去了硫,避免了SO2气体的产生。除了将煤制成蜂窝状外,日常生活中还常采用
如下措施节能:
(1)在农村燃烧秸秆时,常使用鼓风机(或
风箱),通过鼓入足量的空气,使秸秆
充分燃烧
(2)在使用煤气或天然气作燃料时,常通过
调节煤气的进风口,通入足量的空气,
保证气体的充分燃烧思考:如果在燃料燃烧时通入过量的空气,对
充分利用能源有没有影响?通入过量的空气,会导致空气带走过多的
热量,使燃料的利用效率下降。在生产和生活中,还需要充分利用燃料燃烧所放
出的热量,例如:火力发电厂会产生大量的余热,
电厂的附近常建有一些其他工厂(如水泥厂)用
电厂的余热进行生产。标准燃烧热定义:在101kPa时,l mol物质完全燃烧的反应热.衡量燃料燃烧放出热量大小的物理量热值定义:在101kPa时,l g物质完全燃烧的反应热.所以,不同量的同一物质完全燃烧,放出的热量可能不同,但标准燃烧热是一定的。小结:标准燃烧热和中和热的区别与联系1mol反应物完全燃烧时放出的热量;不同反应物,标准燃烧热不同。生成1mol水时放出的热量;强酸与强碱的中和热都约为57.3kJ/mol 。放热反应?H<0;单位:kJ/mol 1mol可燃物生成1mol水概念辨析:1.下列各组物质的标准燃烧热相等的是:( )
A.碳和一氧化碳 B.1mol碳和2mol碳
C.1mol乙炔和2mol碳 D.淀粉和纤维素B—285.8 kJ/mol-297 kJ·mol-1S (s)+O2(g)=SO2 (g) ;△H=-297kJ·mol-13、有关标准燃烧热的计算例:10g硫磺在氧气中完全燃烧生成气态SO2,放出的热量能使500gH2O温度由18℃升至62.4℃,则硫磺的标准燃烧热为 ,热化学方程式为 。
(已知每克水温度每升高1 ℃所需热量为4.18J)由于传统能源逐渐枯竭,因此,开发新能源显得十分重要。氢能是一种重要的新能源,请讨论下列问题;
1、根据第9页表1—3计算H2、CH4及C2H2的热值
2、讨论H2作为能源有何优点,目前在利用氢能
方面主要存在什么问题? H2、CH4及C2H2的热值分别为142.9kJ·g-1、
55.6kJ·g-1、50kJ·g-1。
说明H2作为能源具有热值高的特点。另外,
用H2作为能源还具有无污染的特点。目前在应用氢能方面最重要的问题是H2的制取。求混合物的组成
在一定条件下,氢气和丙烷燃烧的
化学方程式为:
2H2(g)+ O2(g) = 2H2O( l )ΔH =- 571.6 kJ/mol
C3H8(g)+5O2(g)= 3CO2(g)+4H2O(l)
ΔH =- 2220 kJ/mol
5mol 氢气和丙烷的混合气完全燃烧时放热
3847kJ 则氢气和甲烷的体积比为 ( )
(A) 1:3 (B) 3:1 (C) 1:4 (D) 1:1
B练习
1.按照盖斯定律,结合下述反应方程式,回答问题,已知:
(1)NH3(g)+HCl(g)=NH4Cl(s) △H1=-176kJ/mol
(2)NH3(g)+H2O(l)=NH3· H2O(aq) △H2=-35.1kJ/mol
(3)HCl(g) +H2O(l)=HCl(aq) △H3=-72.3kJ/mol
(4)NH3(aq)+ HCl(aq)=NH4Cl(aq) △H4=-52.3kJ/mol
(5)NH4Cl(s)+2H2O(l)= NH4Cl(aq) △H5=?
则第(5)个方程式中的反应热△H是________。
根据盖斯定律和上述反应方程式得:
(4)+ (3)+ (2)- (1)= (5),即△H5 = +16.3kJ/mol50ml0.50mol·L-1盐酸与50mL0.55mol·L-1NaOH溶液在
如下图所示的装置中进行中和反应。通过测定反应过程
中放出的热量可计算中和热。回答下列问题:
(1)从实验装置上看,图中伤缺少的一种玻璃仪器
是 。
(2)烧杯间填满碎纸条的作用是 。
。
(3)若大烧杯上不盖硬纸板,求得的中和热数值
(填“偏大”“偏小”或“无影响”)。
(4)实验中改用60mL0.50mol·L-1盐酸跟50mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”或“不相等”),所求中和热 (填“相等”或“不相等”),简述理由:
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热数值会 ;用50mL0.50mol/LNaOH溶液进行上述实验,测得的中和热数值会 (填“偏大”“偏小”或“无影响”)。
化学反应过程中,所吸收或放出的热量常见的放热反应: 所有的燃烧反应
所有的中和反应
活泼金属与水、酸的反应
多数的化合反应
以下特殊的化合反应是吸热反应:常见的吸热反应:
所有的电离过程
所有的水解反应
多数的分解反应C+H2O= H2+ CO
H2+CuO=Cu +H2O一、焓变
1、概念:在恒温、恒压下,化学反应过程中吸
收或放出的热量称为反应的焓变。
2、符号:△H
单位:kJ/mol
3、规定
放热: △H<0 Q>0
吸热: △H>0 Q<0
二、热化学方程式:
1、概念:能够表示反应热的化学方程式叫做热化学方程式。热化学方程式与化学方程式有什么不同?
如何正确书写热化学方程式?
热化学方程式有什么意义?第2页的交流与讨论热化学方程式与化学方程式的差别:
1、△H只用在热化学方程式中,并写在右边4、与参加反应的物质的物质的量有关。同一化
学反应中,热化学方程式中物质的化学计量
数不同, △H也不同。化学计量数加倍,
△H也要加倍。3、热化学方程式中的化学计量数可以是整数,
也可以是分数。2、热化学方程式中必须注明物质的聚集状态
气态(g)、液态(l)、固态(s)5、书写热化学方程式时应注明反应的温度
和压强。如果不注明温度和压强,则表
示是在250C、101KPa条件下的反应热。第3页的交流与讨论 反应放出或吸收的热量的多少与外界的温度和压强有关,需要注明,不注明的指101kPa和25℃时的数据。 因为物质的聚集状态不同所含的能量也不同。 固态
液态吸热气态吸热吸热1)要注明温度和压强:2)反应物和生成物要注明聚集状态: 2、书写热化学方程式应注意以下几点 H2(g)+ O2(g)=H2O(l);△H=-285.8KJ/mol
H2(g)+ O2(g)=H2O(g);△H=-241.8KJ/mol ∴H2O(l)═H2O(g);△H=+44KJ/mol 3)热化学方程式中各物质前的化学计量数表示物质的量不表示分子数。H2(g)+Cl2(g)=2HCl(g);△H=-184.6KJ/mol H2(g)+ Cl2(g)=HCl(g);△H=-92.3KJ/mol 2H2(g)+O2(g)=2H2O(l);△H=-571.6KJ/mol H2(g)+ O2(g)=H2O(l);△H=-285.8KJ/mol4) △H的表示:
热化学方程式中的△H的“+”与“-”一定要注明, “+”代表吸热, “-”代表放热
无论热化学方程式中化学计量数为多少,△H的单位总是KJ/mol,但△H的数值与反应式中的系数成比例3、热化学方程式表示的意义 1)表示什么物质参加反应,结果生成什么物质2)反应物和生成物之间的质量比、物质的量比3)反应物完全变成生成物后所放出或吸收的热量。质→量→能H2(g)+ O2(g)=H2O(g);△H=-241.8KJ/mol 一个化学反应是吸收能量还是放出能量,取决于
反应物的总能量与生成物的总能量的相对大小。△H=E生总能量-E反总能量
吸热反应: △H>0 E生总能量>E反总能量
放热反应: △H<0 E反总能量>E生总能量化学反应过程中为什么会有能量的变化呢?化学反应本质上是分子中的旧键断裂形成原子,原子间重新组合形成新键,进而形成新的分子的过程.旧键的断裂会吸收热量,而新键的形成会放出热量,反应是放出还是吸收能量取决于两者之间的相对大小.化学反应中,化学键的断裂和形成是反应过程中
有能量变化的本质原因。
△H=E反总键能-E生总键能第5页的问题解决2、下列变化中,属于吸热反应的是( )
A.氮气与氢气合成氨
B.酸碱中和
C.二氧化硫与氧气反应生成三氧化硫
D.焦炭与高温水蒸气反应
D[练习]
1、下列变化中,属于放热反应的是( )
A.Ba(OH)2·8H2O与NH4Cl的反应
B.点燃的镁条在二氧化碳中继续燃烧
C.灼热的碳与二氧化碳的反应
D.氯化铝的水解B3. 下列叙述中正确的是( )
A.在稀溶液中1mol酸和1mol碱完全反应所放出的热量,叫做中和热
B.在101kPa时1mol物质燃烧时的反应热叫做该物质的标准燃烧热
C.热化学方程式中,各物质前的化学计量数不表示分子个数
D.如果反应物所具有的总能量小于生成物所 具有的总能量,则发生的反应是放热反应。 C4.下列反应属于吸热反应的是 ( )
A. C6H12O6(葡萄糖aq)+6O2 6CO2+6H2O
B. CH3COOH+KOH CH3COOK+H2O
C. A+B C+D; △H<0
D.破坏生成物全部化学键所需能量小于破坏
反应物全部化学键所需能量 酶DAC6.分析右面的能量变化示意图,下列热化学方程式正确的是 ( )
A.2A(g)+ B(g)=2C(g);△H=a(a>0)
B.2A(g)+ B(g)=2C(g);△H=a(a<0)
C.2A + B=2 C;△H=a(a<0)
D.2C=2A +B;△H=a(a>0)
B7、化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)出的能量。已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能(kJ·mol?1):P—P:198 P—O:360 O=O:498则反应P4(白磷)+3O2= P4O6
的反应热△H为 ( )
A.-1638 kJ·mol?1
B.+1638 kJ·mol?1
C.-126 kJ·mol?1
D.+126 kJ·mol?1A反应热的测量与计算专题1 化学反应与能量变化第一单元 化学反应中的热效应反应热的测量与计算获得化学反应热的主要途径:
1、实验直接测定
2、间接计算获得
(1)根据盖斯定律计算
(2)根据公式△H=E反总键能-E生总键能 计算根据第6页中的“活动与探究”思考:
1、测定反应热时,量热计直接测定的数据是
焓变吗?如果不是直接测定的是什么?
2、实验中的反应原理是什么?
3、要获得比较精确的数据,该实验应该注意
什么问题?一、反应热的测定
1、量热计直接测定的是体系的温度变化2、HCl与NaOH反应的反应热测定原理:1mol 1mol -akJ
0.025mol 0.025mol -bkJ由实验可以测定出b值,然后便可换算出a中和热:在稀溶液中,酸和碱发生中和反应生
成1mol水时所放出的热量由于电离过程是吸热的,而弱酸、弱碱都较难电离,
所以,强酸与弱碱、强碱与弱酸、弱酸与弱碱反
应生成1mol水时所放出的热量都小于57.3 kJ。3、测定反应热时一定要采取较好的绝热措施,
动作要快,以减小实验误差。强酸和强碱在稀溶液中的中和热可表示为:
H+(aq)+OH-(aq)=H2O(l) △H= -57.3k kJ·mol?1,
又知道溶液中的反应有:
CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l) △H=-Q1kJ·mol?1
H2SO4(浓)+NaOH(aq)=Na2SO4(aq)+H2O(l) △H= -Q2 kJ·mol?1
HNO3(aq)+KOH(aq)=KNO3(aq)+H2O(l) △H= -Q3 kJ·mol?1,
则Q1、Q2、Q3的关系正确的是 ( )
Q1 = Q2 = Q3 B.Q2 > Q1 > Q3
C. Q2 > Q3 > Q1 D. Q2 = Q3 > Q1C二、盖斯定律
1、概念:一个化学反应,不论是一步完成,还是
分步完成,其总的热效应是完全相同的。盖斯定律表明:一个化学反应的焓变仅与反应的起始状态和反应的最终状态有关,而与反应的途径无关。第7页例题△H=△H1+△H2①C(s)+1/2O2(g)==CO(g) ΔH1=?
②CO(g)+1/2O2(g)== CO2(g) ΔH2=-283.0kJ/mol
③C(s)+O2(g)==CO2(g) ΔH3=-393.5kJ/mol
① + ② = ③ ,
则 ΔH1 + ΔH2 =ΔH3
所以, ΔH1 =ΔH3- ΔH2 =-393.5kJ/mol+ 283.0kJ/mol=-110.5kJ/mol应用了什么规律?如何测定C(s)+1/2O2(g)==CO(g)的反应热△H12、计算
(1)若一个反应的焓变△H=a kJ·mol?1,则其逆反
应的焓变△H= -a kJ·mol?1
(2)若一个化学反应方程式可由另外几个反应
的化学方程式相加减而得到,则该反应的
焓变亦可以由这几个反应的焓变相加减而得到。第8页的问题解决【例题1】已知
① CO(g) + 1/2 O2(g) ====CO2(g)
ΔH1= -283.0 kJ/mol
② H2(g) + 1/2 O2(g) ====H2O(l) ΔH2= -285.8 kJ/mol
③C2H5OH(l) + 3 O2(g) ==== 2 CO2(g) + 3 H2O(l)
ΔH3=-1370 kJ/mol
试计算④2CO(g)+ 4 H2(g)==== H2O(l)+ C2H5OH(l) 的ΔH ?????
【解】:根据盖斯定律,反应④不论是一步完成还是分几步完成,其反应热效应都是相同的。下面就看看反应④能不能由①②③三个反应通过加减乘除组合而成,也就是说,看看反应④能不能分成①②③几步完成。①×2 + ②×4 - ③ = ④ ?? 所以,ΔH=ΔH1×2 +ΔH2×4 -ΔH3 ?????=-283.2×2 -285.8×4 +1370 =-339.2 kJ/mol 你知道神六的火箭燃料是什么吗?例2:某次发射火箭,用N2H4(肼)在NO2中燃烧,生成N2、液态H2O。已知:
N2(g)+2O2(g)==2NO2(g) △H1=+67.2kJ/mol
N2H4(g)+O2(g)==N2(g)+2H2O(l) △H2=-534kJ/mol
假如都在相同状态下,请写出发射火箭反应的热化学方程式。
2 N2H4(g)+ 2NO2(g)== 3N2(g)+4H2O(l) △H=-1135.2kJ/mol 例3、 已知25℃、101kPa下,石墨、金刚石燃烧的热化学方程式分别为:
据此判断,下列说法正确的是( )
A. 由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的低
B. 由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的高
C. 由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的低
D. 由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的高D能源的充分利用1、你所了解的传统能源有哪些?新能源又有哪些?2、能源又可以分为一次能源和二次能源。一次能源
是指直接取自自然界,没有加工转换的各种能量
和资源;二次能源是指由一次能源经过加工转换
后得到的能源。根据这种分类法,请将上面提到
的能源重新分类?思考:在许多场合将煤块直接燃烧,这种燃烧方式
存在什么缺陷?采用这种方式燃烧煤,煤与空气的接触面积不够,
内部煤的燃烧效率偏低,浪费了能源。另外,直接
燃烧煤会使其中的硫转化为二氧化硫,引起大气的
污染。有哪些可以提高煤的燃烧效率的方法吗?目前常用的方法主要有三种:
(1)将煤制成蜂窝状,以增加与空气的接触面积
(2)通过一定的方法将煤转化为液体燃料(如甲醇)
(3)通过一定的方法将煤转化为气体燃料(如煤气)完成第9页的“交流与讨论”,提出你的观点。虽然将煤转化为水煤气再燃烧与直接燃烧煤所获得
的能量是一样的,而且将煤转化为水煤气会增加消
耗。但将煤转化为水煤气至少有两个优点:
一是将固体煤转化为气体,极大地提高了燃烧效率;
二是通过转化除去了硫,避免了SO2气体的产生。除了将煤制成蜂窝状外,日常生活中还常采用
如下措施节能:
(1)在农村燃烧秸秆时,常使用鼓风机(或
风箱),通过鼓入足量的空气,使秸秆
充分燃烧
(2)在使用煤气或天然气作燃料时,常通过
调节煤气的进风口,通入足量的空气,
保证气体的充分燃烧思考:如果在燃料燃烧时通入过量的空气,对
充分利用能源有没有影响?通入过量的空气,会导致空气带走过多的
热量,使燃料的利用效率下降。在生产和生活中,还需要充分利用燃料燃烧所放
出的热量,例如:火力发电厂会产生大量的余热,
电厂的附近常建有一些其他工厂(如水泥厂)用
电厂的余热进行生产。标准燃烧热定义:在101kPa时,l mol物质完全燃烧的反应热.衡量燃料燃烧放出热量大小的物理量热值定义:在101kPa时,l g物质完全燃烧的反应热.所以,不同量的同一物质完全燃烧,放出的热量可能不同,但标准燃烧热是一定的。小结:标准燃烧热和中和热的区别与联系1mol反应物完全燃烧时放出的热量;不同反应物,标准燃烧热不同。生成1mol水时放出的热量;强酸与强碱的中和热都约为57.3kJ/mol 。放热反应?H<0;单位:kJ/mol 1mol可燃物生成1mol水概念辨析:1.下列各组物质的标准燃烧热相等的是:( )
A.碳和一氧化碳 B.1mol碳和2mol碳
C.1mol乙炔和2mol碳 D.淀粉和纤维素B—285.8 kJ/mol-297 kJ·mol-1S (s)+O2(g)=SO2 (g) ;△H=-297kJ·mol-13、有关标准燃烧热的计算例:10g硫磺在氧气中完全燃烧生成气态SO2,放出的热量能使500gH2O温度由18℃升至62.4℃,则硫磺的标准燃烧热为 ,热化学方程式为 。
(已知每克水温度每升高1 ℃所需热量为4.18J)由于传统能源逐渐枯竭,因此,开发新能源显得十分重要。氢能是一种重要的新能源,请讨论下列问题;
1、根据第9页表1—3计算H2、CH4及C2H2的热值
2、讨论H2作为能源有何优点,目前在利用氢能
方面主要存在什么问题? H2、CH4及C2H2的热值分别为142.9kJ·g-1、
55.6kJ·g-1、50kJ·g-1。
说明H2作为能源具有热值高的特点。另外,
用H2作为能源还具有无污染的特点。目前在应用氢能方面最重要的问题是H2的制取。求混合物的组成
在一定条件下,氢气和丙烷燃烧的
化学方程式为:
2H2(g)+ O2(g) = 2H2O( l )ΔH =- 571.6 kJ/mol
C3H8(g)+5O2(g)= 3CO2(g)+4H2O(l)
ΔH =- 2220 kJ/mol
5mol 氢气和丙烷的混合气完全燃烧时放热
3847kJ 则氢气和甲烷的体积比为 ( )
(A) 1:3 (B) 3:1 (C) 1:4 (D) 1:1
B练习
1.按照盖斯定律,结合下述反应方程式,回答问题,已知:
(1)NH3(g)+HCl(g)=NH4Cl(s) △H1=-176kJ/mol
(2)NH3(g)+H2O(l)=NH3· H2O(aq) △H2=-35.1kJ/mol
(3)HCl(g) +H2O(l)=HCl(aq) △H3=-72.3kJ/mol
(4)NH3(aq)+ HCl(aq)=NH4Cl(aq) △H4=-52.3kJ/mol
(5)NH4Cl(s)+2H2O(l)= NH4Cl(aq) △H5=?
则第(5)个方程式中的反应热△H是________。
根据盖斯定律和上述反应方程式得:
(4)+ (3)+ (2)- (1)= (5),即△H5 = +16.3kJ/mol50ml0.50mol·L-1盐酸与50mL0.55mol·L-1NaOH溶液在
如下图所示的装置中进行中和反应。通过测定反应过程
中放出的热量可计算中和热。回答下列问题:
(1)从实验装置上看,图中伤缺少的一种玻璃仪器
是 。
(2)烧杯间填满碎纸条的作用是 。
。
(3)若大烧杯上不盖硬纸板,求得的中和热数值
(填“偏大”“偏小”或“无影响”)。
(4)实验中改用60mL0.50mol·L-1盐酸跟50mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”或“不相等”),所求中和热 (填“相等”或“不相等”),简述理由:
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热数值会 ;用50mL0.50mol/LNaOH溶液进行上述实验,测得的中和热数值会 (填“偏大”“偏小”或“无影响”)。
