共价键(浙江省舟山市)
图片预览


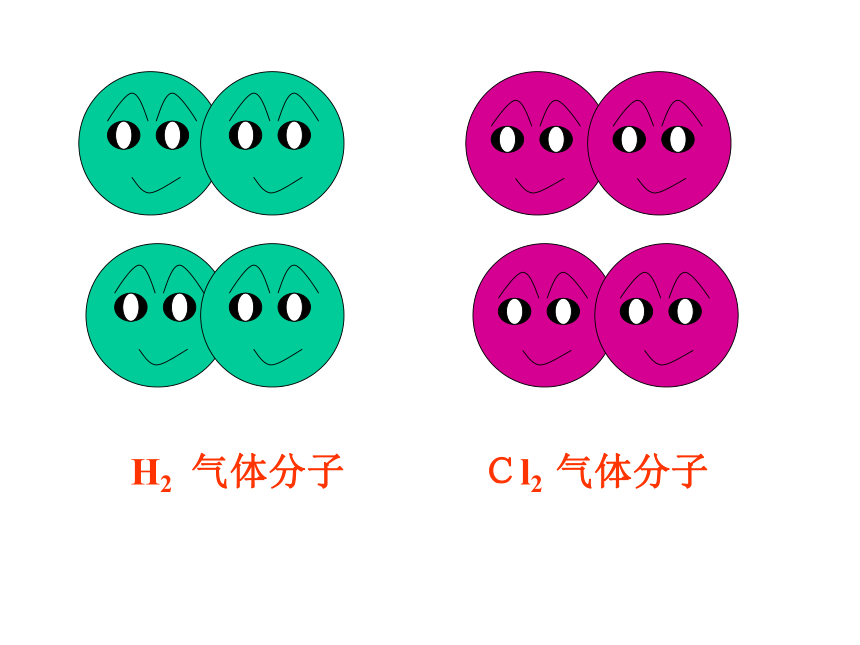

文档简介
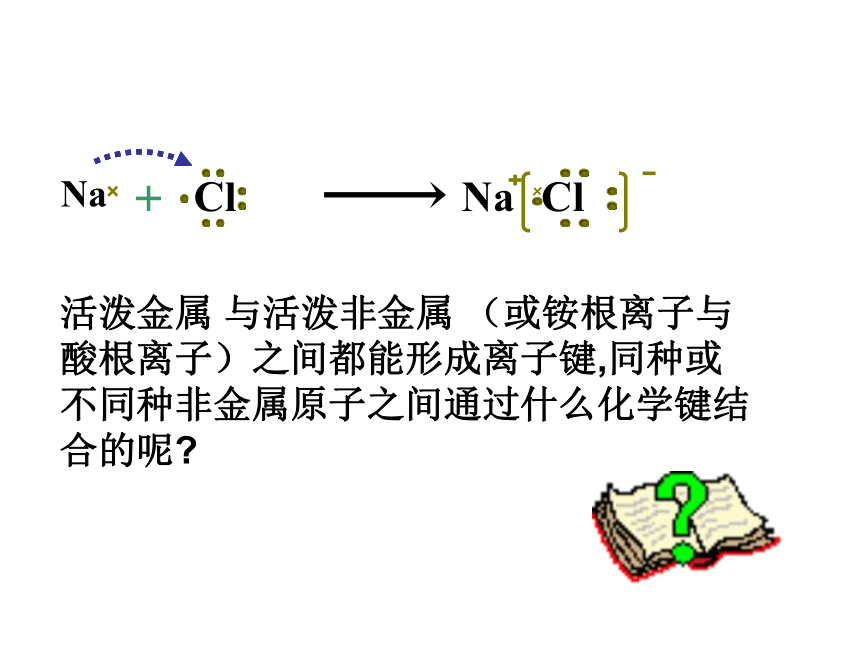
课件27张PPT。第二单元 微粒之间的相互作用力一、化学键化学键—— 这种相邻的两个或多个原子之间强烈的相互作用。离子键共价键(一)离子键金属键带相反电荷的阴阳离子结合的相互作用
活泼金属 与活泼非金属 (或铵根离子与酸根离子)之间都能形成离子键,同种或不同种非金属原子之间通过什么化学键结合的呢?
活泼的金属元素和活泼非金属元素化合
时形成离子键。请思考,非金属元素之间化
合时,能形成离子键吗?为什么? 不能,因非金属元素的原子均有获得电
子的倾向。 非金属元素的原子间可通过共用电子对
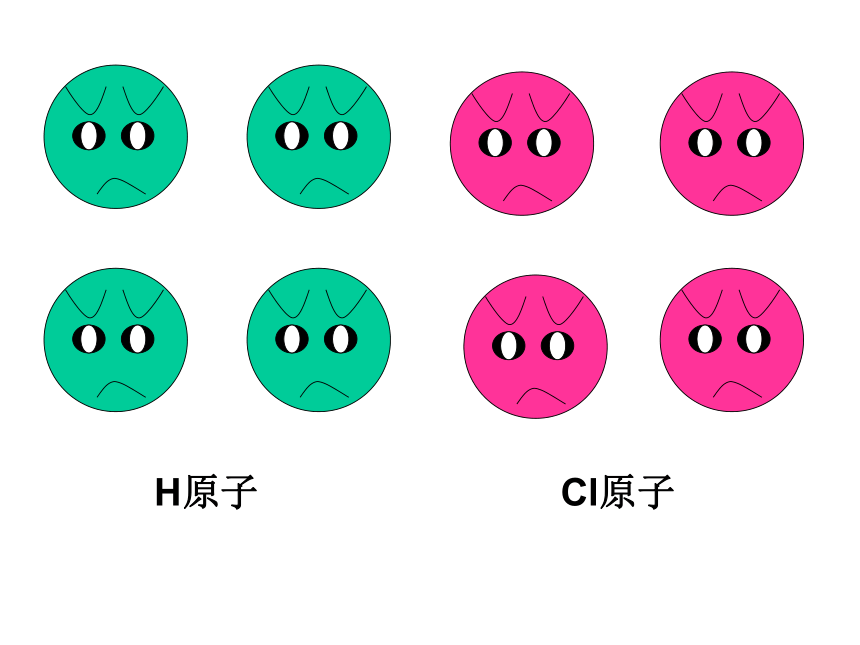
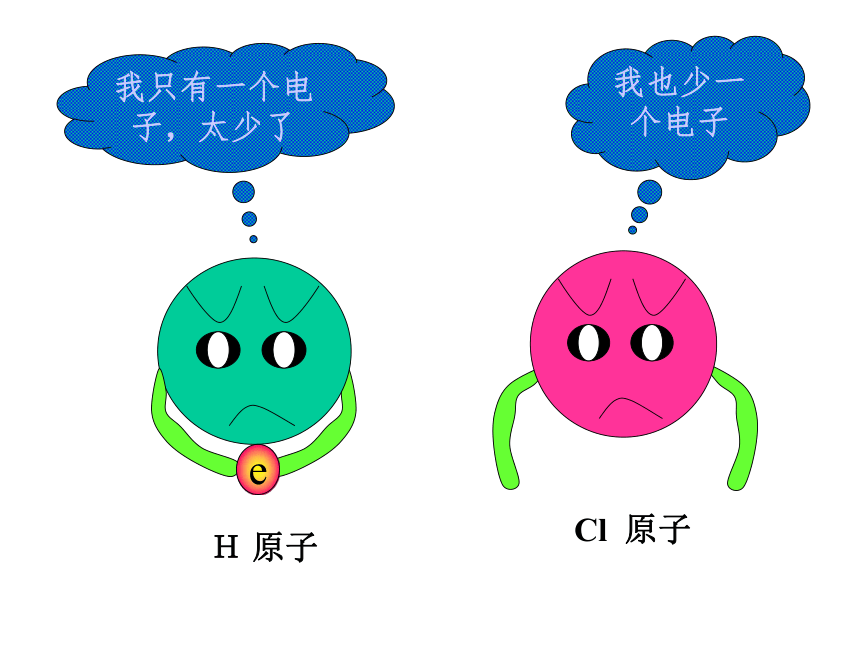
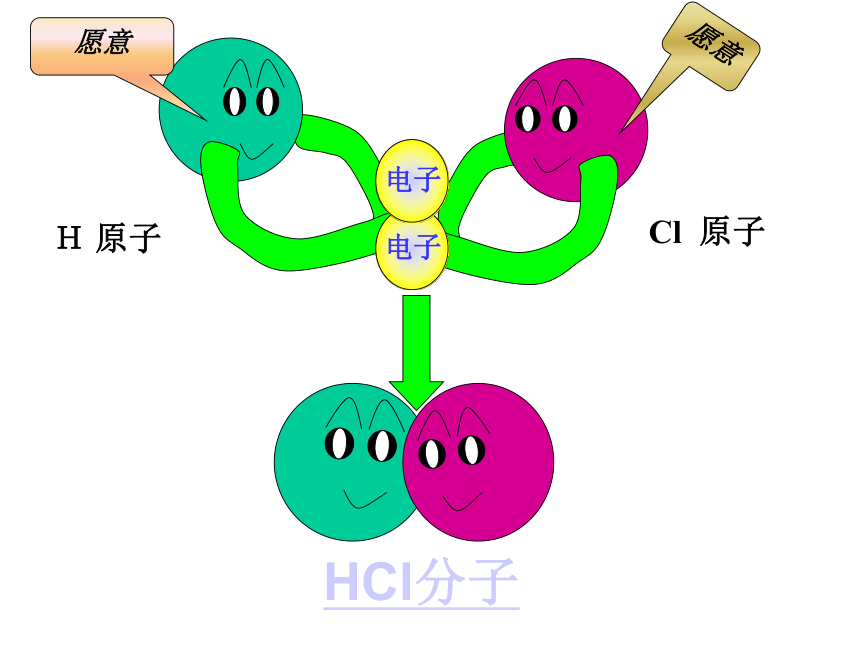
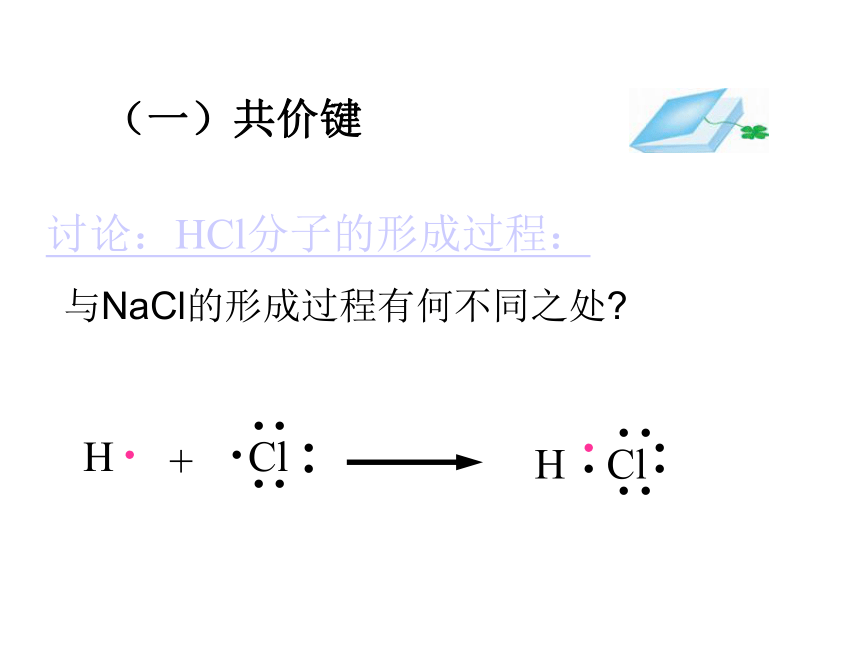
的方法使双方最外电子层均达到稳定结构。讨论Cl2 气体分子H2 气体分子H原子Cl原子我只有一个电子,太少了我也少一个电子eH 原子Cl 原子愿意愿意H 原子Cl 原子HCl分子(一)共价键讨论:HCl分子的形成过程:与NaCl的形成过程有何不同之处?二、共价键:原子之间通过共用电子对所形成的相互作用,
叫做共价键共价分子的电子式写法:1、共价化合物的电子式不标电荷。
2、原子最外层电子达到稳定结构。
如:HCl分子电子对偏向Cl二、共价键共价化合物的形成过程(或单质)注意事项:①不用箭头表示电子的偏移;
②相同原子不能合并在一起;
③没有形成离子.HClH2OF2+→+→练习:用电子式表示H2S和Br2的形成过程.HF CO2
H2O CH4(1) 电子式H2 Cl2 N2 H H··(三) 共价键的表示方法定义:原子之间通过共用电子对所形成的相互作用,叫做共价键。成键微粒:原子相互作用:共用电子对成键元素:同种或不同种非金属元素含有共价键的化合物不一定是共价化合物共价键 氢氧化钠晶体中,钠离子与氢氧根离子以
离子键结合;在氢氧根离子中,氢与氧以共价
键结合。请用电子式表示氢氧化钠。 [ ] +- 过氧化钠晶体中,过氧根离子 (O2 ) 2-与钠
离子以离子键结合;在过氧根离子中,两个氧
原子以共价键结合。请用电子式表示过氧化钠。[ ]++2- 氢分子的形成: H · 氯化氢分子的形成:· H+→H ·+→ 原子之间通过共用电子对所形成的相互作用,叫做共价键。共用电子对不偏移,成键原子不显电性 共用电子对偏向氯原子,共价键特点:共价键特点:H﹣H(结构式)H﹣Cl(结构式)氯原子带部分负电荷,氢原子带部分正电荷。(3)物质分子的几种表示方法:从有关离子键和化合键的讨论中,我们可以看到,原子结合成
分子时原子之间存在着相互作用。这种相互作用不仅存在于直
接相邻的原子之间,而且也存在于分子内非直接相邻的原子之
间。前一种相互作用比较强烈,破坏它要消耗比较大的能量,
是使原子相互联结形成分子的主要因素。这种相邻的原子之间
强烈的相互作用叫做化学键。化学键讨论:用化学键的观点来分析化学反应的本质是什么?一个化学反应的的过程,本质上就是旧化学键断裂和新化学键形成的过程。(二) 共价键与离子键的比较:共价键和离子键的比较 阴阳离子
原子
静电作用共用电子对
活泼金属元素与活泼非金属元素(通常)同种或不同非金属元素(通常)发生电子得失
没有发生电子得失而是形成共用电子对
小结:本节重点
共价键:
原子之间通过共用电子对所形成的相互作用
成键微粒:原子
成键本质:共用电子对
成键元素:同种元素或同类元素
电子式以及结构式的书写
化学反应的本质:旧化学键的断裂和新化学键的生成。 随堂练习
1、下列物质中,含有共价键的化合物是( )
A、NaOH B、CaCl2
C、 H2O D、H2 AC2、下列属于共价化合物的是( )
A、Cl2 B、P2O5
C、CaF2 D、KOHB指出下列化合物所含化学键类型:NaBr、H2S、NaOH、SO2、NH4NO3
属于离子化合物的有 属属于共价化合物的有 .
并判断对错:
1、含有共价键的化合物一定是共价化合物。
2、共价化合物只含共价键。
3、含有离子键的化合物一定是离子化合物。
4、离子化合物只含离子键。
5、只含有共价键的物质一定是共价化合物。
6、氦气是共价化合物。 稀有气体元素结构稳定,是单原子分子,没有形成共价键错(NaOH)对对错对错(NaOH)NaBr、NaOH、NH4NO3H2S 、SO2随堂练习下列物质中,属于共价化合物的是( )
A. 氧化钙 B. 氮气 C. 氧化钠 D.硫化氢
(二) 写出下列物质的电子式和结构式
1.氮气____,_____ 2.二氧化碳____,_____
3.氨气_____,______4.甲烷_____,_____7。几种重要的物质的电子式:NaOHNa2O2NH4ClH2O2共价键的强弱共价键的强弱主要取决与成键原子的半径,成键原子半径越大,则共价键越弱。 (四) 思考: 形成键 → 放出能量
断裂键 → 吸收能量化学反应本质:旧键的断裂,新键的形成
H2与Cl2是如何生成HCl气体的, 化学反应的本质是什么?
活泼金属 与活泼非金属 (或铵根离子与酸根离子)之间都能形成离子键,同种或不同种非金属原子之间通过什么化学键结合的呢?
活泼的金属元素和活泼非金属元素化合
时形成离子键。请思考,非金属元素之间化
合时,能形成离子键吗?为什么? 不能,因非金属元素的原子均有获得电
子的倾向。 非金属元素的原子间可通过共用电子对
的方法使双方最外电子层均达到稳定结构。讨论Cl2 气体分子H2 气体分子H原子Cl原子我只有一个电子,太少了我也少一个电子eH 原子Cl 原子愿意愿意H 原子Cl 原子HCl分子(一)共价键讨论:HCl分子的形成过程:与NaCl的形成过程有何不同之处?二、共价键:原子之间通过共用电子对所形成的相互作用,
叫做共价键共价分子的电子式写法:1、共价化合物的电子式不标电荷。
2、原子最外层电子达到稳定结构。
如:HCl分子电子对偏向Cl二、共价键共价化合物的形成过程(或单质)注意事项:①不用箭头表示电子的偏移;
②相同原子不能合并在一起;
③没有形成离子.HClH2OF2+→+→练习:用电子式表示H2S和Br2的形成过程.HF CO2
H2O CH4(1) 电子式H2 Cl2 N2 H H··(三) 共价键的表示方法定义:原子之间通过共用电子对所形成的相互作用,叫做共价键。成键微粒:原子相互作用:共用电子对成键元素:同种或不同种非金属元素含有共价键的化合物不一定是共价化合物共价键 氢氧化钠晶体中,钠离子与氢氧根离子以
离子键结合;在氢氧根离子中,氢与氧以共价
键结合。请用电子式表示氢氧化钠。 [ ] +- 过氧化钠晶体中,过氧根离子 (O2 ) 2-与钠
离子以离子键结合;在过氧根离子中,两个氧
原子以共价键结合。请用电子式表示过氧化钠。[ ]++2- 氢分子的形成: H · 氯化氢分子的形成:· H+→H ·+→ 原子之间通过共用电子对所形成的相互作用,叫做共价键。共用电子对不偏移,成键原子不显电性 共用电子对偏向氯原子,共价键特点:共价键特点:H﹣H(结构式)H﹣Cl(结构式)氯原子带部分负电荷,氢原子带部分正电荷。(3)物质分子的几种表示方法:从有关离子键和化合键的讨论中,我们可以看到,原子结合成
分子时原子之间存在着相互作用。这种相互作用不仅存在于直
接相邻的原子之间,而且也存在于分子内非直接相邻的原子之
间。前一种相互作用比较强烈,破坏它要消耗比较大的能量,
是使原子相互联结形成分子的主要因素。这种相邻的原子之间
强烈的相互作用叫做化学键。化学键讨论:用化学键的观点来分析化学反应的本质是什么?一个化学反应的的过程,本质上就是旧化学键断裂和新化学键形成的过程。(二) 共价键与离子键的比较:共价键和离子键的比较 阴阳离子
原子
静电作用共用电子对
活泼金属元素与活泼非金属元素(通常)同种或不同非金属元素(通常)发生电子得失
没有发生电子得失而是形成共用电子对
小结:本节重点
共价键:
原子之间通过共用电子对所形成的相互作用
成键微粒:原子
成键本质:共用电子对
成键元素:同种元素或同类元素
电子式以及结构式的书写
化学反应的本质:旧化学键的断裂和新化学键的生成。 随堂练习
1、下列物质中,含有共价键的化合物是( )
A、NaOH B、CaCl2
C、 H2O D、H2 AC2、下列属于共价化合物的是( )
A、Cl2 B、P2O5
C、CaF2 D、KOHB指出下列化合物所含化学键类型:NaBr、H2S、NaOH、SO2、NH4NO3
属于离子化合物的有 属属于共价化合物的有 .
并判断对错:
1、含有共价键的化合物一定是共价化合物。
2、共价化合物只含共价键。
3、含有离子键的化合物一定是离子化合物。
4、离子化合物只含离子键。
5、只含有共价键的物质一定是共价化合物。
6、氦气是共价化合物。 稀有气体元素结构稳定,是单原子分子,没有形成共价键错(NaOH)对对错对错(NaOH)NaBr、NaOH、NH4NO3H2S 、SO2随堂练习下列物质中,属于共价化合物的是( )
A. 氧化钙 B. 氮气 C. 氧化钠 D.硫化氢
(二) 写出下列物质的电子式和结构式
1.氮气____,_____ 2.二氧化碳____,_____
3.氨气_____,______4.甲烷_____,_____7。几种重要的物质的电子式:NaOHNa2O2NH4ClH2O2共价键的强弱共价键的强弱主要取决与成键原子的半径,成键原子半径越大,则共价键越弱。 (四) 思考: 形成键 → 放出能量
断裂键 → 吸收能量化学反应本质:旧键的断裂,新键的形成
H2与Cl2是如何生成HCl气体的, 化学反应的本质是什么?
