分子间作用力(浙江省舟山市)
图片预览






文档简介
课件16张PPT。第二单元 微粒之间的相互作用力分子间作用力 我们知道,分子内相邻原子之间存在着强烈的相互作用。那么,分子之间是否也有相互作用呢?
干冰升华、硫晶体熔化、液氯汽化都要吸收能量。物质从固态转变为液态或气态,从液态转变为气态,为什么要吸收能量?在降低温度、增加压强时,Cl2、CO2等气体能够从气态凝结成液态或固态。这些现象给我们什么启示?三、分子间作用力(1)存在:分子间1、概念:分子间存在着将分子聚集在一起
的作用力称为分子间作用力。又称范德华力(2)大小:比化学键弱得多。2、意义:影响物质的熔沸点和溶解性等物理性质3、化学键与分子间作用力的比较原子间
离子间强烈化学性质分子间较弱物理性质 物质中微粒间的作用力的类型与物质性质有密切关系。请与同学讨论下列问题,加深对物质结构与性质关系的认识。
1.氯化钠在熔化状态或水溶液中具有导电性,而液态氯化氢却不具有导电性。这是为什么?
2.干冰受热汽化转化为二氧化碳气体,而二氧化碳气体在加热条件下却不易被分解。这是为什么?氢键氢键的定义:半径小,吸引电子能力强的原子与H核之间的静电吸引作用。通常,氢键可以看成是一种比较强的分子间作用力。氢键的形成条件:半径小、吸引电子能力强的原子(N、O、F)与H核。
氢键对物质性质的影响:氢键会使物质的熔、沸点升高
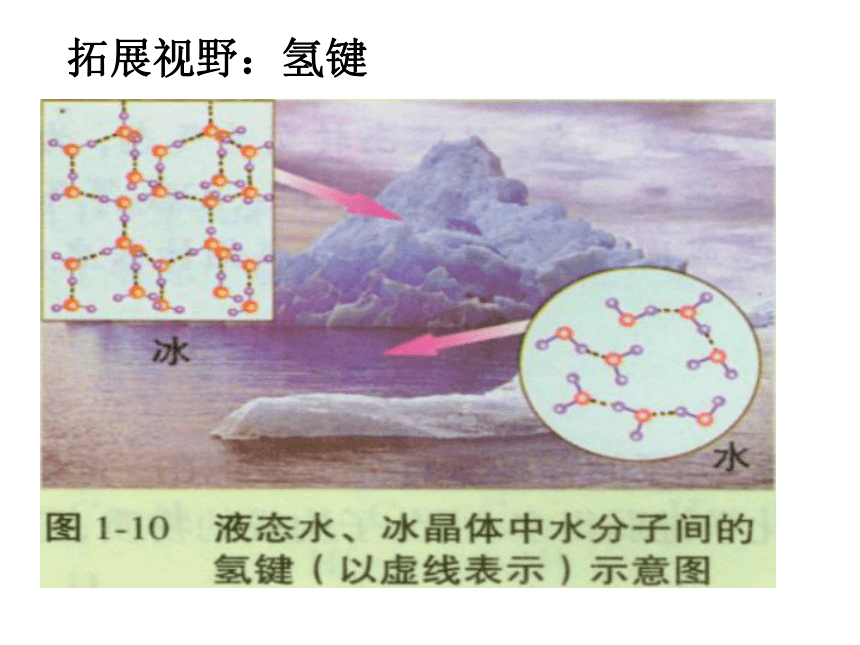
拓展视野:氢键3、化学键与分子间作用力的比较原子间
离子间强烈化学性质分子间较弱物理性质物理性质较强固态、液态
水分子间1、下列化合物分子中只有共价键的是:
A)BaCl2 B)NaOH
C)(NH4)2SO4 D)H2SO4练习2、共价键、离子键和分子间作用力是构成物质微粒间的不同的作用方式,下列物质中只含有上述一种作用的是
A.干冰 B.氯化钠
C.氢氧化钠 D.碘 DB3、 判断物质在下列变化中克服的微粒之间的作用力.(1)水的汽化
(2)甲烷在高温下分解成炭和氢气
(3)氯化镁熔化
(4)干冰升华练习1:(96上海)2.下列过程中,共价键被破坏的是( ).
(A)碘升华 (B)溴蒸气被木炭吸附
(C)酒精溶于水 (D)HCl气体溶于水练习2:(99全国7) 下列各分子中所有原子都满足最外层为8电子结构的是 A.BeCl2 B.PCl3 C.PCl5 D.N2 3、下列各分子中,所有原子都满足最外层为8电子结构的是
A H2O B BF3 C CCl4 D PCl 4、共价键、离子键和分子间作用力是构成物质的微粒间的不同作用方式,下列物质中,只含有上述一种作用的是: ( )
A. 干冰 B. 氯化钠 C. 氢氧化钠 D. 碘 5、已知氯化铝易溶于苯和乙醚,其熔点为190℃,则下列结论错误的是 ( )
A、氯化铝是电解质
B、氯化铝是共价化合物
C、可用电解熔融氯化铝的办法制取金属铝
D、氯化铝为离子化合物练习6、已知氯化铝的熔点为190℃(2.02×105Pa),但它在180℃即开始升华。
(1)氯化铝是_____________(填“离子化合物”或“共价化合物”)。
(2)在500K和1.01×105Pa时,它的蒸气密度(换算成标准状况时)为11.92g·L—1,且已知它的结构中有配位键,氯化铝的化学式为_____________,结构式为________________。(在共价键中,如果电子对是由一个原子A单方面提供而跟另一个原子B共用的共价键叫配位键。配位键表示为“A→B”的形式。)
(3)设计一个可靠的实验,判别氯化铝是离子化合物还是共价化合物。你设计的实验是_______
___________________________________。在其熔融状态下,试验其是否导电,若不导电则证明氯化铝是共价化合物。 3。影响因素(1)分子的组成和结构。(2)相对分子质量的大小。(3)组成相似的分子,极性分子的沸点大于
非极性分子的沸点。4。影响物质溶解性大小的因素溶质、溶剂分子的极性。“相似相溶规律”:极性分子组成的溶质,易溶于极性分子组成的溶剂;非极性分子组成的溶质,易溶于非极性分子组成的溶剂。练习4:课本5、6
干冰升华、硫晶体熔化、液氯汽化都要吸收能量。物质从固态转变为液态或气态,从液态转变为气态,为什么要吸收能量?在降低温度、增加压强时,Cl2、CO2等气体能够从气态凝结成液态或固态。这些现象给我们什么启示?三、分子间作用力(1)存在:分子间1、概念:分子间存在着将分子聚集在一起
的作用力称为分子间作用力。又称范德华力(2)大小:比化学键弱得多。2、意义:影响物质的熔沸点和溶解性等物理性质3、化学键与分子间作用力的比较原子间
离子间强烈化学性质分子间较弱物理性质 物质中微粒间的作用力的类型与物质性质有密切关系。请与同学讨论下列问题,加深对物质结构与性质关系的认识。
1.氯化钠在熔化状态或水溶液中具有导电性,而液态氯化氢却不具有导电性。这是为什么?
2.干冰受热汽化转化为二氧化碳气体,而二氧化碳气体在加热条件下却不易被分解。这是为什么?氢键氢键的定义:半径小,吸引电子能力强的原子与H核之间的静电吸引作用。通常,氢键可以看成是一种比较强的分子间作用力。氢键的形成条件:半径小、吸引电子能力强的原子(N、O、F)与H核。
氢键对物质性质的影响:氢键会使物质的熔、沸点升高
拓展视野:氢键3、化学键与分子间作用力的比较原子间
离子间强烈化学性质分子间较弱物理性质物理性质较强固态、液态
水分子间1、下列化合物分子中只有共价键的是:
A)BaCl2 B)NaOH
C)(NH4)2SO4 D)H2SO4练习2、共价键、离子键和分子间作用力是构成物质微粒间的不同的作用方式,下列物质中只含有上述一种作用的是
A.干冰 B.氯化钠
C.氢氧化钠 D.碘 DB3、 判断物质在下列变化中克服的微粒之间的作用力.(1)水的汽化
(2)甲烷在高温下分解成炭和氢气
(3)氯化镁熔化
(4)干冰升华练习1:(96上海)2.下列过程中,共价键被破坏的是( ).
(A)碘升华 (B)溴蒸气被木炭吸附
(C)酒精溶于水 (D)HCl气体溶于水练习2:(99全国7) 下列各分子中所有原子都满足最外层为8电子结构的是 A.BeCl2 B.PCl3 C.PCl5 D.N2 3、下列各分子中,所有原子都满足最外层为8电子结构的是
A H2O B BF3 C CCl4 D PCl 4、共价键、离子键和分子间作用力是构成物质的微粒间的不同作用方式,下列物质中,只含有上述一种作用的是: ( )
A. 干冰 B. 氯化钠 C. 氢氧化钠 D. 碘 5、已知氯化铝易溶于苯和乙醚,其熔点为190℃,则下列结论错误的是 ( )
A、氯化铝是电解质
B、氯化铝是共价化合物
C、可用电解熔融氯化铝的办法制取金属铝
D、氯化铝为离子化合物练习6、已知氯化铝的熔点为190℃(2.02×105Pa),但它在180℃即开始升华。
(1)氯化铝是_____________(填“离子化合物”或“共价化合物”)。
(2)在500K和1.01×105Pa时,它的蒸气密度(换算成标准状况时)为11.92g·L—1,且已知它的结构中有配位键,氯化铝的化学式为_____________,结构式为________________。(在共价键中,如果电子对是由一个原子A单方面提供而跟另一个原子B共用的共价键叫配位键。配位键表示为“A→B”的形式。)
(3)设计一个可靠的实验,判别氯化铝是离子化合物还是共价化合物。你设计的实验是_______
___________________________________。在其熔融状态下,试验其是否导电,若不导电则证明氯化铝是共价化合物。 3。影响因素(1)分子的组成和结构。(2)相对分子质量的大小。(3)组成相似的分子,极性分子的沸点大于
非极性分子的沸点。4。影响物质溶解性大小的因素溶质、溶剂分子的极性。“相似相溶规律”:极性分子组成的溶质,易溶于极性分子组成的溶剂;非极性分子组成的溶质,易溶于非极性分子组成的溶剂。练习4:课本5、6
