高一化学第一章到第四章网络图谱
图片预览

文档简介
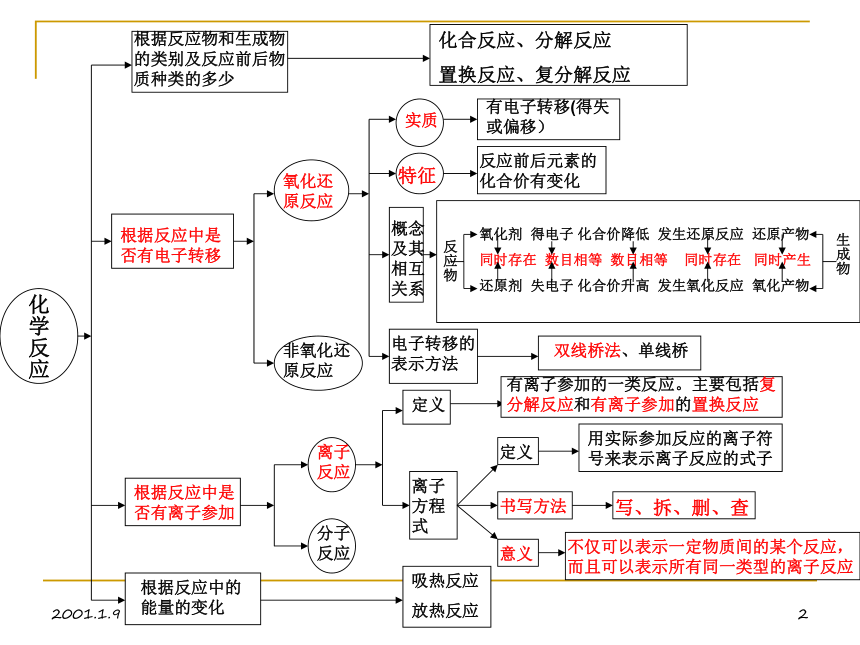
课件6张PPT。高一化学知识网络图制作人:李晓春2001.1.91化学反应根据反应物和生成物的类别及反应前后物质种类的多少化合反应、分解反应
置换反应、复分解反应根据反应中是否有电子转移根据反应中是否有离子参加根据反应中的能量的变化氧化还原反应非氧化还原反应实质有电子转移(得失或偏移)特征反应前后元素的化合价有变化概念及其相互关系氧化剂 得电子 化合价降低 发生还原反应 还原产物
同时存在 数目相等 数目相等 同时存在 同时产生
还原剂 失电子 化合价升高 发生氧化反应 氧化产物反应物生成物电子转移的表示方法双线桥法、单线桥离子反应分子反应定义离子方程式定义书写方法意义用实际参加反应的离子符号来表示离子反应的式子有离子参加的一类反应。主要包括复分解反应和有离子参加的置换反应写、拆、删、查不仅可以表示一定物质间的某个反应,而且可以表示所有同一类型的离子反应吸热反应
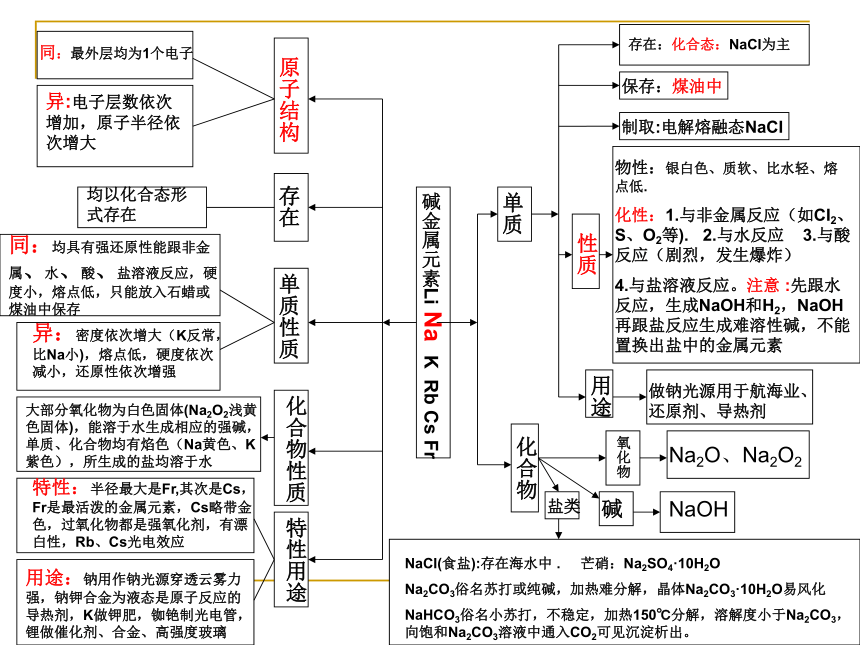
放热反应2001.1.91碱金属元素Li Na K Rb Cs Fr单质化合物存在:化合态:NaCI为主保存:煤油中制取:电解熔融态NaCI 性质用途氧化物碱原子结构存在单质性质化合物性质特性用途NaOH做钠光源用于航海业、还原剂、导热剂Na2O、Na2O2同:最外层均为1个电子异:电子层数依次增加,原子半径依次增大均以化合态形式存在同:均具有强还原性能跟非金属、水、酸、盐溶液反应,硬度小,熔点低,只能放入石蜡或煤油中保存异:密度依次增大(K反常,比Na小),熔点低,硬度依次减小,还原性依次增强大部分氧化物为白色固体(Na2O2浅黄色固体),能溶于水生成相应的强碱,单质、化合物均有焰色(Na黄色、K紫色),所生成的盐均溶于水特性:半径最大是Fr,其次是Cs,Fr是最活泼的金属元素,Cs略带金色,过氧化物都是强氧化剂,有漂白性,Rb、Cs光电效应用途:钠用作钠光源穿透云雾力强,钠钾合金为液态是原子反应的导热剂,K做钾肥,铷铯制光电管,锂做催化剂、合金、高强度玻璃NaCI(食盐):存在海水中 . 芒硝:Na2SO4·10H2O
Na2CO3俗名苏打或纯碱,加热难分解,晶体Na2CO3·10H2O易风化
NaHCO3俗名小苏打,不稳定,加热150℃分解,溶解度小于Na2CO3,向饱和Na2CO3溶液中通入CO2可见沉淀析出。盐类物性:银白色、质软、比水轻、熔点低.
化性:1.与非金属反应(如CI2、S、O2等). 2.与水反应 3.与酸反应(剧烈,发生爆炸)
4.与盐溶液反应。注意 :先跟水反应,生成NaOH和H2,NaOH再跟盐反应生成难溶性碱,不能置换出盐中的金属元素2001.1.91常用计量及其定律(1)物质的量(2)阿伏加德罗常数(3)气体摩尔体积(4)摩尔质量(5)物质的量浓度有关概念计量关系nNmV0CB÷Vm,o×Vm,o÷NA×NA×M÷M÷V×V重要定理阿伏加德罗定理及推论
第三章 知识网络图 2001.1.91第四章 知 识 网 络 系 统Cl2H2SO4 CuCl2
S
Br2H2SSO2+H2OKBr电
解Cu
点
燃H2点燃或光照MnO2△HCl浓硫酸,△NaOHNaClAgNO3AgClAgNO3光
照Cl2+AgNa点燃电解饱和NaClPCl3,PCl5H2OHClOCa(OH)2Ca(ClO)2HCICO2+H2O光照O2FeCI3NaCI+NaCIO+H2O制造氯仿等有机溶剂和农药Fe点燃NaOH溶液P点燃2001.1.91卤族元素(F CI Br I)原子结构元素性质单质性质化合物性质有关特性同异同异同异最外层均为7个电子原子半径依次增大。随原子序数递增,从上至下电子层数增加均为活泼非金属元素,最低价为-1价,最高价为+7价(F除外)随原子序数递增,获电子依次减弱,非金属性依次减弱均为氧化剂,易获得1个电子随原子序数递增颜色逐渐加深,密度依次增大,熔、沸点依次升高。在水中的溶解性依次减小,反应变难。与氢化合能力依次减弱,氧化性依次减弱随原子核电荷数递增氢化物稳定性减弱,其水溶液酸性增强。最高价氧化物的水化物酸性依次减弱。CI-、Br-、I-还原性依次增强。1.F2遇水生成HF并放出O2,制HF应在铅皿中进行。2.新制氯水有漂白性。3.溴易挥发,少量液溴保存用水液封,碘易升华,使淀粉溶液变蓝。4.AgF、CaX2可溶,CaF2、AgX难溶。5.AgF无感光性,AgX有感光性。6.HF的溶液是一种弱酸,剧毒,能腐蚀玻璃。7.CI2、Br2、I2易溶于有机溶剂。8.HBr、HI只能用浓H3PO4或H2SO4制取。2001.1.91
置换反应、复分解反应根据反应中是否有电子转移根据反应中是否有离子参加根据反应中的能量的变化氧化还原反应非氧化还原反应实质有电子转移(得失或偏移)特征反应前后元素的化合价有变化概念及其相互关系氧化剂 得电子 化合价降低 发生还原反应 还原产物
同时存在 数目相等 数目相等 同时存在 同时产生
还原剂 失电子 化合价升高 发生氧化反应 氧化产物反应物生成物电子转移的表示方法双线桥法、单线桥离子反应分子反应定义离子方程式定义书写方法意义用实际参加反应的离子符号来表示离子反应的式子有离子参加的一类反应。主要包括复分解反应和有离子参加的置换反应写、拆、删、查不仅可以表示一定物质间的某个反应,而且可以表示所有同一类型的离子反应吸热反应
放热反应2001.1.91碱金属元素Li Na K Rb Cs Fr单质化合物存在:化合态:NaCI为主保存:煤油中制取:电解熔融态NaCI 性质用途氧化物碱原子结构存在单质性质化合物性质特性用途NaOH做钠光源用于航海业、还原剂、导热剂Na2O、Na2O2同:最外层均为1个电子异:电子层数依次增加,原子半径依次增大均以化合态形式存在同:均具有强还原性能跟非金属、水、酸、盐溶液反应,硬度小,熔点低,只能放入石蜡或煤油中保存异:密度依次增大(K反常,比Na小),熔点低,硬度依次减小,还原性依次增强大部分氧化物为白色固体(Na2O2浅黄色固体),能溶于水生成相应的强碱,单质、化合物均有焰色(Na黄色、K紫色),所生成的盐均溶于水特性:半径最大是Fr,其次是Cs,Fr是最活泼的金属元素,Cs略带金色,过氧化物都是强氧化剂,有漂白性,Rb、Cs光电效应用途:钠用作钠光源穿透云雾力强,钠钾合金为液态是原子反应的导热剂,K做钾肥,铷铯制光电管,锂做催化剂、合金、高强度玻璃NaCI(食盐):存在海水中 . 芒硝:Na2SO4·10H2O
Na2CO3俗名苏打或纯碱,加热难分解,晶体Na2CO3·10H2O易风化
NaHCO3俗名小苏打,不稳定,加热150℃分解,溶解度小于Na2CO3,向饱和Na2CO3溶液中通入CO2可见沉淀析出。盐类物性:银白色、质软、比水轻、熔点低.
化性:1.与非金属反应(如CI2、S、O2等). 2.与水反应 3.与酸反应(剧烈,发生爆炸)
4.与盐溶液反应。注意 :先跟水反应,生成NaOH和H2,NaOH再跟盐反应生成难溶性碱,不能置换出盐中的金属元素2001.1.91常用计量及其定律(1)物质的量(2)阿伏加德罗常数(3)气体摩尔体积(4)摩尔质量(5)物质的量浓度有关概念计量关系nNmV0CB÷Vm,o×Vm,o÷NA×NA×M÷M÷V×V重要定理阿伏加德罗定理及推论
第三章 知识网络图 2001.1.91第四章 知 识 网 络 系 统Cl2H2SO4 CuCl2
S
Br2H2SSO2+H2OKBr电
解Cu
点
燃H2点燃或光照MnO2△HCl浓硫酸,△NaOHNaClAgNO3AgClAgNO3光
照Cl2+AgNa点燃电解饱和NaClPCl3,PCl5H2OHClOCa(OH)2Ca(ClO)2HCICO2+H2O光照O2FeCI3NaCI+NaCIO+H2O制造氯仿等有机溶剂和农药Fe点燃NaOH溶液P点燃2001.1.91卤族元素(F CI Br I)原子结构元素性质单质性质化合物性质有关特性同异同异同异最外层均为7个电子原子半径依次增大。随原子序数递增,从上至下电子层数增加均为活泼非金属元素,最低价为-1价,最高价为+7价(F除外)随原子序数递增,获电子依次减弱,非金属性依次减弱均为氧化剂,易获得1个电子随原子序数递增颜色逐渐加深,密度依次增大,熔、沸点依次升高。在水中的溶解性依次减小,反应变难。与氢化合能力依次减弱,氧化性依次减弱随原子核电荷数递增氢化物稳定性减弱,其水溶液酸性增强。最高价氧化物的水化物酸性依次减弱。CI-、Br-、I-还原性依次增强。1.F2遇水生成HF并放出O2,制HF应在铅皿中进行。2.新制氯水有漂白性。3.溴易挥发,少量液溴保存用水液封,碘易升华,使淀粉溶液变蓝。4.AgF、CaX2可溶,CaF2、AgX难溶。5.AgF无感光性,AgX有感光性。6.HF的溶液是一种弱酸,剧毒,能腐蚀玻璃。7.CI2、Br2、I2易溶于有机溶剂。8.HBr、HI只能用浓H3PO4或H2SO4制取。2001.1.91
同课章节目录
