几种重要的金属化合物(全国)三.铁的重要化合物
文档属性
| 名称 | 几种重要的金属化合物(全国)三.铁的重要化合物 |  | |
| 格式 | rar | ||
| 文件大小 | 597.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2008-03-18 12:12:00 | ||
图片预览







文档简介
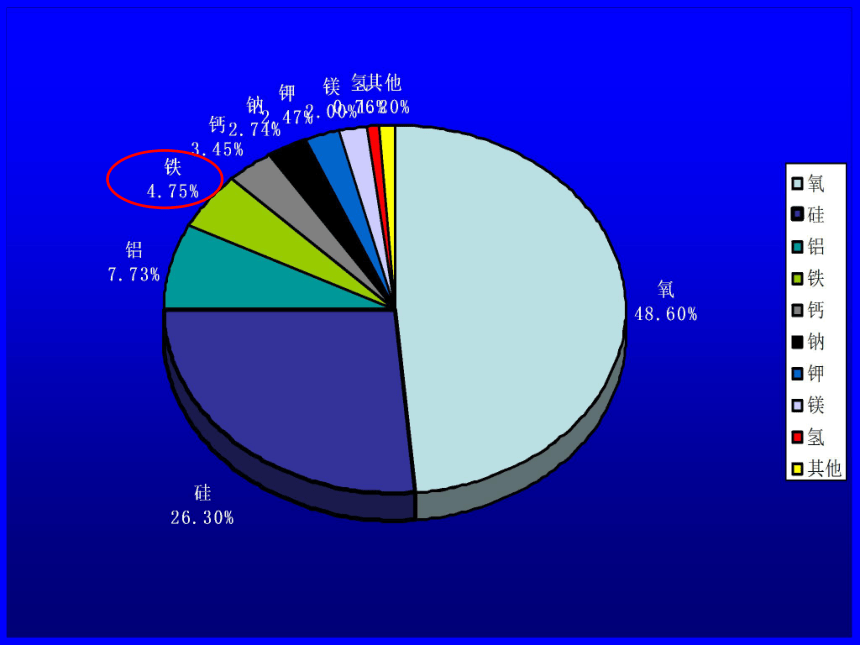
课件23张PPT。朱门酒肉臭,路有冻死骨。氧化铁第二节 几种重要的金属化合物
第三章 金属及其化合物
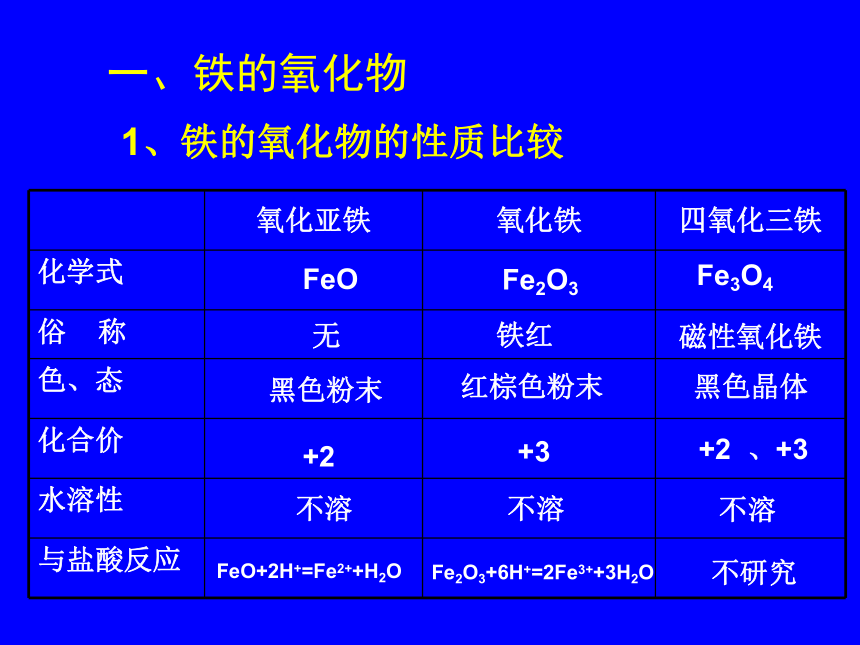
授课教师:苑守峰指导教师:李振顺----------三.铁的重要化合物一、铁的氧化物1、铁的氧化物的性质比较Fe3O4
无 黑色粉末+2不溶FeO+2H+=Fe2++H2OFe2O3+6H+=2Fe3++3H2OFeOFe2O3磁性氧化铁铁红黑色晶体红棕色粉末+2 、+3+3不溶不溶不研究2、 铁的氧化物的用途Ⅱ.作为冶炼金属的原料
Fe2O3+3CO===2Fe+3CO2Ⅰ.氧化铁常用于制造红色油漆和涂料氧化铁作外墙涂料 高温练习1:请同学们用双线桥法表示该反应方程式中电子转移情况,并指出氧化剂和还原剂?实验1两支洁净的试管各取2mLFeCl3、FeSO4溶液,然后向两支试管分别加入NaOH溶液观察现象。二、铁的氢氧化物
思考1 为什么会产生这样的现象呢?试管1:
Fe(OH)3红褐色试管2:Fe(OH)2转变为Fe(OH)3的过程FeSO4+2NaOH=Fe(OH)2↓+Na2SO4
4Fe(OH)2+O2+2H2O=4Fe(OH)3→→ 白色沉淀灰绿色红褐色实验1两支洁净的试管各取2mLFeCl3、FeSO4溶液,然后向两支试管分别滴加NaOH溶液观察现象。产生红褐色沉淀先生成白色的沉淀,迅速变成灰绿色,最后变成红褐色Fe3++3OH-==Fe(OH)3 ↓Fe2++2OH-=Fe(OH)2 ↓4Fe(OH)2+O2+2H2O=4Fe(OH)3二、铁的氢氧化物
方法1.先把水加热煮沸除去溶有的氧气,即用加热过的水配制溶液
方法2. 在液面以下用滴管加入药品试剂并且用油液封住液面,防止再溶进氧气氧化新制备的Fe(OH)2思考2:实验室制备Fe(OH)2 时怎样避免氧气的氧化?思考3.如何设计制取Fe(OH)2的实验装置?三、铁盐和亚铁盐1、常见的铁盐和亚铁盐铁盐:FeCl3 、 Fe2(SO4)3 、 Fe(NO3)3亚铁盐: FeCl2 、Fe(SO4)2 、Fe(NO3)2颜色:黄色(三价铁离子的颜色)颜色:浅绿色(二价铁离子的颜色)2. Fe3+离子的检验实验2: 向FeCl3和FeCl2溶液中分别滴入KSCN 溶液观察现象溶液呈血红色溶液颜色无变化(1)观察颜色:Fe 2+ Fe3+ .浅绿色黄色(2)KSCN法:滴入KSCN溶液,呈_____ 的溶液中含有Fe 3+ 血红色 (3)碱液法:
分别加入碱液(或氨水),
生成 沉淀的溶液中含有 Fe3+,
先生成 沉淀,又迅速转变为 色,
最后 变为 沉淀的溶液中含有Fe2+红褐色白色 灰绿红褐色 通过本节课的学习如何鉴别 FeCl3溶液和FeCl2溶液?思考4:3、科学探究----Fe3+的氧化性实验3:向FeCl3溶液中加入少量Fe粉,振荡。再滴入几滴KSCN溶液现象:2FeCl3 + Fe == 3FeCl2反应方程式:(氧化剂)(还原剂)离子方程式:溶液不显血红色溶液中不含Fe3+2Fe3++ Fe == 3Fe2+思考5:实验室制备FeCl2时为什么要加入铁粉?
原因:防止二价铁离子氧化成三价铁离子结论:实验3:向以上所得到的FeCl2和KSCN的混合溶液中滴加氯水(Cl2)现 象: 溶液变成血红色结 论:原溶液中的Fe2+转变成Fe3+
方程式:2FeCl2 + Cl2 == 2FeCl3离子方程式2Fe2+ + Cl2 == 2Fe3+ +2Cl-(还原剂)(氧化剂)思考6:
怎样证明某溶液中只有二价铁离子而不含三价铁离子小结
一.铁的氧化物
二.铁的氢氧化物
三.铁离子及亚铁离子的检验课堂练习:1.将下列四种化合物溶于稀盐酸,滴加硫氰化钾溶液没有颜色变化的是: ( )
A. FeS B. Fe2O3
C. FeCl3 D. Fe2(SO4)3A课堂练习: 2. 硫酸亚铁溶液含有杂质硫酸铜和硫酸铁,为除去杂质,提纯硫酸亚铁,应该加入下列哪种物质 ( )
A.锌粉 B. 镁粉?
C.铁粉 D. 铝粉C3、可用两种方法制得白色的Fe(OH)2沉淀。
方法一:用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时,为防止氧化,还需加入 。(2)除去蒸馏水中的O2常采用 方法。
(3)用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液,这种操作的理由 Fe加热煮沸4.在图2装置中用 NaOH溶液、铁屑、
稀H2SO4等试剂制备。 (1)在试管Ⅰ里加入的试剂是 。
(2)在试管Ⅱ里加入的试剂是 。
(3)为了制得白色Fe(OH)2沉淀,在试管Ⅰ和Ⅱ中加入
试剂,打开止水夹,塞紧塞子后的实验步骤
是 。
(4)这样生成的Fe(OH)2沉淀能较长时间保持白色,
其理由 。 ?? 稀硫酸氢氧化钠 小结:还原剂+氧化剂(Cl2)+还原剂(Fe)氧化剂FeFe2+Fe3+123456弱氧化剂:H+、Cu2+、S、I2、Fe3+等 强氧化剂:Cl2、Br2、HNO3等Cl2、Br2、HNO3、O2等Zn、Fe、Cu、HI等Zn、H2、Al、C等 Zn、CO、Al等铁三角
第三章 金属及其化合物
授课教师:苑守峰指导教师:李振顺----------三.铁的重要化合物一、铁的氧化物1、铁的氧化物的性质比较Fe3O4
无 黑色粉末+2不溶FeO+2H+=Fe2++H2OFe2O3+6H+=2Fe3++3H2OFeOFe2O3磁性氧化铁铁红黑色晶体红棕色粉末+2 、+3+3不溶不溶不研究2、 铁的氧化物的用途Ⅱ.作为冶炼金属的原料
Fe2O3+3CO===2Fe+3CO2Ⅰ.氧化铁常用于制造红色油漆和涂料氧化铁作外墙涂料 高温练习1:请同学们用双线桥法表示该反应方程式中电子转移情况,并指出氧化剂和还原剂?实验1两支洁净的试管各取2mLFeCl3、FeSO4溶液,然后向两支试管分别加入NaOH溶液观察现象。二、铁的氢氧化物
思考1 为什么会产生这样的现象呢?试管1:
Fe(OH)3红褐色试管2:Fe(OH)2转变为Fe(OH)3的过程FeSO4+2NaOH=Fe(OH)2↓+Na2SO4
4Fe(OH)2+O2+2H2O=4Fe(OH)3→→ 白色沉淀灰绿色红褐色实验1两支洁净的试管各取2mLFeCl3、FeSO4溶液,然后向两支试管分别滴加NaOH溶液观察现象。产生红褐色沉淀先生成白色的沉淀,迅速变成灰绿色,最后变成红褐色Fe3++3OH-==Fe(OH)3 ↓Fe2++2OH-=Fe(OH)2 ↓4Fe(OH)2+O2+2H2O=4Fe(OH)3二、铁的氢氧化物
方法1.先把水加热煮沸除去溶有的氧气,即用加热过的水配制溶液
方法2. 在液面以下用滴管加入药品试剂并且用油液封住液面,防止再溶进氧气氧化新制备的Fe(OH)2思考2:实验室制备Fe(OH)2 时怎样避免氧气的氧化?思考3.如何设计制取Fe(OH)2的实验装置?三、铁盐和亚铁盐1、常见的铁盐和亚铁盐铁盐:FeCl3 、 Fe2(SO4)3 、 Fe(NO3)3亚铁盐: FeCl2 、Fe(SO4)2 、Fe(NO3)2颜色:黄色(三价铁离子的颜色)颜色:浅绿色(二价铁离子的颜色)2. Fe3+离子的检验实验2: 向FeCl3和FeCl2溶液中分别滴入KSCN 溶液观察现象溶液呈血红色溶液颜色无变化(1)观察颜色:Fe 2+ Fe3+ .浅绿色黄色(2)KSCN法:滴入KSCN溶液,呈_____ 的溶液中含有Fe 3+ 血红色 (3)碱液法:
分别加入碱液(或氨水),
生成 沉淀的溶液中含有 Fe3+,
先生成 沉淀,又迅速转变为 色,
最后 变为 沉淀的溶液中含有Fe2+红褐色白色 灰绿红褐色 通过本节课的学习如何鉴别 FeCl3溶液和FeCl2溶液?思考4:3、科学探究----Fe3+的氧化性实验3:向FeCl3溶液中加入少量Fe粉,振荡。再滴入几滴KSCN溶液现象:2FeCl3 + Fe == 3FeCl2反应方程式:(氧化剂)(还原剂)离子方程式:溶液不显血红色溶液中不含Fe3+2Fe3++ Fe == 3Fe2+思考5:实验室制备FeCl2时为什么要加入铁粉?
原因:防止二价铁离子氧化成三价铁离子结论:实验3:向以上所得到的FeCl2和KSCN的混合溶液中滴加氯水(Cl2)现 象: 溶液变成血红色结 论:原溶液中的Fe2+转变成Fe3+
方程式:2FeCl2 + Cl2 == 2FeCl3离子方程式2Fe2+ + Cl2 == 2Fe3+ +2Cl-(还原剂)(氧化剂)思考6:
怎样证明某溶液中只有二价铁离子而不含三价铁离子小结
一.铁的氧化物
二.铁的氢氧化物
三.铁离子及亚铁离子的检验课堂练习:1.将下列四种化合物溶于稀盐酸,滴加硫氰化钾溶液没有颜色变化的是: ( )
A. FeS B. Fe2O3
C. FeCl3 D. Fe2(SO4)3A课堂练习: 2. 硫酸亚铁溶液含有杂质硫酸铜和硫酸铁,为除去杂质,提纯硫酸亚铁,应该加入下列哪种物质 ( )
A.锌粉 B. 镁粉?
C.铁粉 D. 铝粉C3、可用两种方法制得白色的Fe(OH)2沉淀。
方法一:用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时,为防止氧化,还需加入 。(2)除去蒸馏水中的O2常采用 方法。
(3)用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液,这种操作的理由 Fe加热煮沸4.在图2装置中用 NaOH溶液、铁屑、
稀H2SO4等试剂制备。 (1)在试管Ⅰ里加入的试剂是 。
(2)在试管Ⅱ里加入的试剂是 。
(3)为了制得白色Fe(OH)2沉淀,在试管Ⅰ和Ⅱ中加入
试剂,打开止水夹,塞紧塞子后的实验步骤
是 。
(4)这样生成的Fe(OH)2沉淀能较长时间保持白色,
其理由 。 ?? 稀硫酸氢氧化钠 小结:还原剂+氧化剂(Cl2)+还原剂(Fe)氧化剂FeFe2+Fe3+123456弱氧化剂:H+、Cu2+、S、I2、Fe3+等 强氧化剂:Cl2、Br2、HNO3等Cl2、Br2、HNO3、O2等Zn、Fe、Cu、HI等Zn、H2、Al、C等 Zn、CO、Al等铁三角
