钠的重要化合物
图片预览





文档简介
课件19张PPT。第二节 几种重要的金属化合物一、钠的重要化合物
1、氧化钠和过氧化钠
回顾:1、氧化钠和过氧化钠的颜色、状态
2、分别写出氧化钙、氧化钠与水反应的化学
方程式 CaO+H2O=Ca(OH)2Na2O+H2O=2NaOH氧化钠和过氧化钠的比较漂白剂 供氧剂等淡黄色 固体较稳定2Na2O2+2H2O=4NaOH+O2↑2Na2O2+2CO2=2Na2CO3+O2 ↑Na2O2 -1价 Na2O -2价白色 固体不稳定Na2O+H2O=2NaOHNa2O+CO2=Na2CO3可制烧碱 Na2O2 + 2Na === 2Na2O过氧化物碱性氧化物[思考] ???1.根据Na2O2性质,想一想Na2O2应如何保存??2.把Na2O2投入到FeSO4溶液中,会观察到哪些现象? 为什么?2.碳酸钠和碳酸氢钠纯碱或苏打小苏打Na2CO3.xH2O
X=1、7、10无白色粉末白色晶体碳酸钠比碳酸氢钠易溶于水Na2CO3 = 2Na+ + CO3 2— NaHCO3 = Na+ + HCO3—均为碱性,碳酸钠比碳酸氢钠碱性强演示化 学 性 质 初中已经学过了有关碳酸盐的性质,
那碳酸钠可能有什么样的化学性质?碳
酸氢钠呢?碳酸钠和碳酸氢钠的性质是
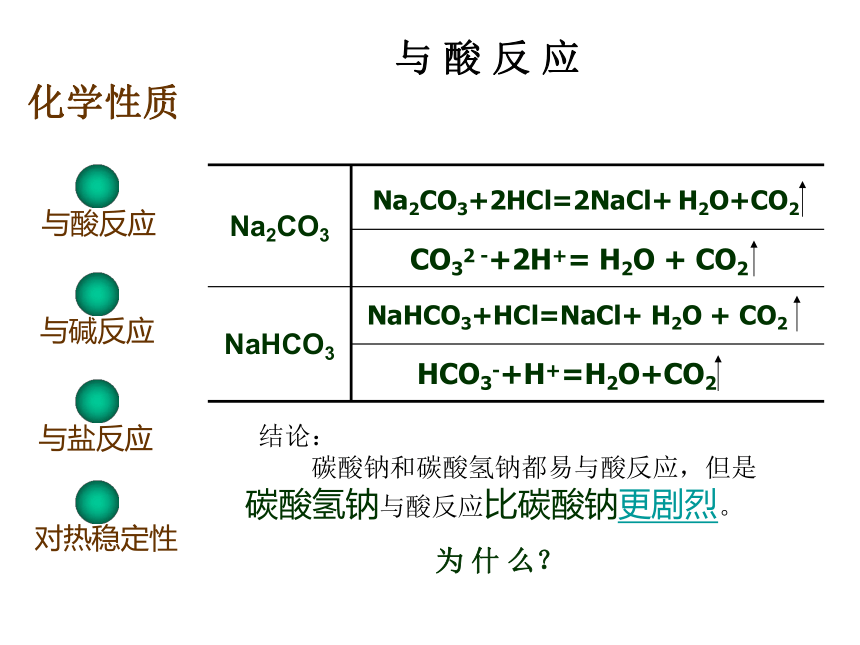
不是一样呢?化 学 性 质与酸反应与碱反应与盐反应对热稳定性与 酸 反 应与酸反应与碱反应与盐反应对热稳定性化学性质 结论:
碳酸钠和碳酸氢钠都易与酸反应,但是
碳酸氢钠与酸反应比碳酸钠更剧烈。为 什 么?有无色气体产生
有无色气体产(反应较剧烈)Na2CO3与盐酸反应一开始没有气泡,继续滴加有气泡产生;
NaHCO3溶液中滴入盐酸立刻有气泡产生。
Na2CO3、NaHCO3与酸的反应: CO32 - + H+ = HCO3 -为什么?化学性质与 碱 反 应与酸反应与碱反应与盐反应对热稳定性能与所有可溶碱反应生成碳酸正盐和水NaHCO3+NaOH=Na2CO3+H2OHCO3-+OH -=CO32-+H2O 易与Ba2+、Ca2+的碱反应生成碳酸盐沉淀和NaOH 思考:
NaHCO3与Ca(OH)2是否反应?若反应,反应
用量不同,离子方程式是否相同?化学性质与 盐 反 应与酸反应与碱反应与盐反应对热稳定性与可溶性的钙盐、钡盐反应生成沉淀可与NaHSO4反应化学性质对 热 稳 定 性与酸反应与碱反应与盐反应对热稳定性结论:
加热时,碳酸钠不分解,而碳酸氢钠
则分解。即:碳酸钠比碳酸氢钠更稳定。碳酸钠受热不分解 所以可以利用它们对热的稳定性来鉴别
它们。Na2CO3、NaHCO3的相互转化 习题一习题二习题三习 题习 题 一习题一习题二习题三 有一包白色碳酸钠粉末,如何证明里面是否混有碳酸氢钠?如果有碳酸氢钠,如何除去? 加热,产生气体,而且气体能使澄清
石灰水变混浊则证明碳酸钠粉末中含有碳
酸氢钠。
加热直到没有气体放出,碳酸氢钠就
已除尽。End 习 题 二习题一习题二习题三 有两瓶无色溶液,分别是稀盐酸(a)和
碳酸钠(b)溶液,不用任何试剂,如何鉴别
这两种溶液?a滴入b:b滴入a: 刚开始没有气泡,随a滴入量的增加才产生气泡。一滴入就有气泡产生End 习 题 三习题一习题二习题三End 有一瓶无色的碳酸氢钠溶液,如何证明碳酸氢钠溶液中是否混有碳酸钠? 加入可溶性的钙盐和钡盐,生成白色的沉淀。用 途制玻璃制 皂造 纸纺织等 发酵剂灭火剂等Na2CO3NaHCO3制 药思考:
通过滴加酚酞的对比实验,能说明一个什么问题?返回End
1、氧化钠和过氧化钠
回顾:1、氧化钠和过氧化钠的颜色、状态
2、分别写出氧化钙、氧化钠与水反应的化学
方程式 CaO+H2O=Ca(OH)2Na2O+H2O=2NaOH氧化钠和过氧化钠的比较漂白剂 供氧剂等淡黄色 固体较稳定2Na2O2+2H2O=4NaOH+O2↑2Na2O2+2CO2=2Na2CO3+O2 ↑Na2O2 -1价 Na2O -2价白色 固体不稳定Na2O+H2O=2NaOHNa2O+CO2=Na2CO3可制烧碱 Na2O2 + 2Na === 2Na2O过氧化物碱性氧化物[思考] ???1.根据Na2O2性质,想一想Na2O2应如何保存??2.把Na2O2投入到FeSO4溶液中,会观察到哪些现象? 为什么?2.碳酸钠和碳酸氢钠纯碱或苏打小苏打Na2CO3.xH2O
X=1、7、10无白色粉末白色晶体碳酸钠比碳酸氢钠易溶于水Na2CO3 = 2Na+ + CO3 2— NaHCO3 = Na+ + HCO3—均为碱性,碳酸钠比碳酸氢钠碱性强演示化 学 性 质 初中已经学过了有关碳酸盐的性质,
那碳酸钠可能有什么样的化学性质?碳
酸氢钠呢?碳酸钠和碳酸氢钠的性质是
不是一样呢?化 学 性 质与酸反应与碱反应与盐反应对热稳定性与 酸 反 应与酸反应与碱反应与盐反应对热稳定性化学性质 结论:
碳酸钠和碳酸氢钠都易与酸反应,但是
碳酸氢钠与酸反应比碳酸钠更剧烈。为 什 么?有无色气体产生
有无色气体产(反应较剧烈)Na2CO3与盐酸反应一开始没有气泡,继续滴加有气泡产生;
NaHCO3溶液中滴入盐酸立刻有气泡产生。
Na2CO3、NaHCO3与酸的反应: CO32 - + H+ = HCO3 -为什么?化学性质与 碱 反 应与酸反应与碱反应与盐反应对热稳定性能与所有可溶碱反应生成碳酸正盐和水NaHCO3+NaOH=Na2CO3+H2OHCO3-+OH -=CO32-+H2O 易与Ba2+、Ca2+的碱反应生成碳酸盐沉淀和NaOH 思考:
NaHCO3与Ca(OH)2是否反应?若反应,反应
用量不同,离子方程式是否相同?化学性质与 盐 反 应与酸反应与碱反应与盐反应对热稳定性与可溶性的钙盐、钡盐反应生成沉淀可与NaHSO4反应化学性质对 热 稳 定 性与酸反应与碱反应与盐反应对热稳定性结论:
加热时,碳酸钠不分解,而碳酸氢钠
则分解。即:碳酸钠比碳酸氢钠更稳定。碳酸钠受热不分解 所以可以利用它们对热的稳定性来鉴别
它们。Na2CO3、NaHCO3的相互转化 习题一习题二习题三习 题习 题 一习题一习题二习题三 有一包白色碳酸钠粉末,如何证明里面是否混有碳酸氢钠?如果有碳酸氢钠,如何除去? 加热,产生气体,而且气体能使澄清
石灰水变混浊则证明碳酸钠粉末中含有碳
酸氢钠。
加热直到没有气体放出,碳酸氢钠就
已除尽。End 习 题 二习题一习题二习题三 有两瓶无色溶液,分别是稀盐酸(a)和
碳酸钠(b)溶液,不用任何试剂,如何鉴别
这两种溶液?a滴入b:b滴入a: 刚开始没有气泡,随a滴入量的增加才产生气泡。一滴入就有气泡产生End 习 题 三习题一习题二习题三End 有一瓶无色的碳酸氢钠溶液,如何证明碳酸氢钠溶液中是否混有碳酸钠? 加入可溶性的钙盐和钡盐,生成白色的沉淀。用 途制玻璃制 皂造 纸纺织等 发酵剂灭火剂等Na2CO3NaHCO3制 药思考:
通过滴加酚酞的对比实验,能说明一个什么问题?返回End
