化学平衡
图片预览







文档简介
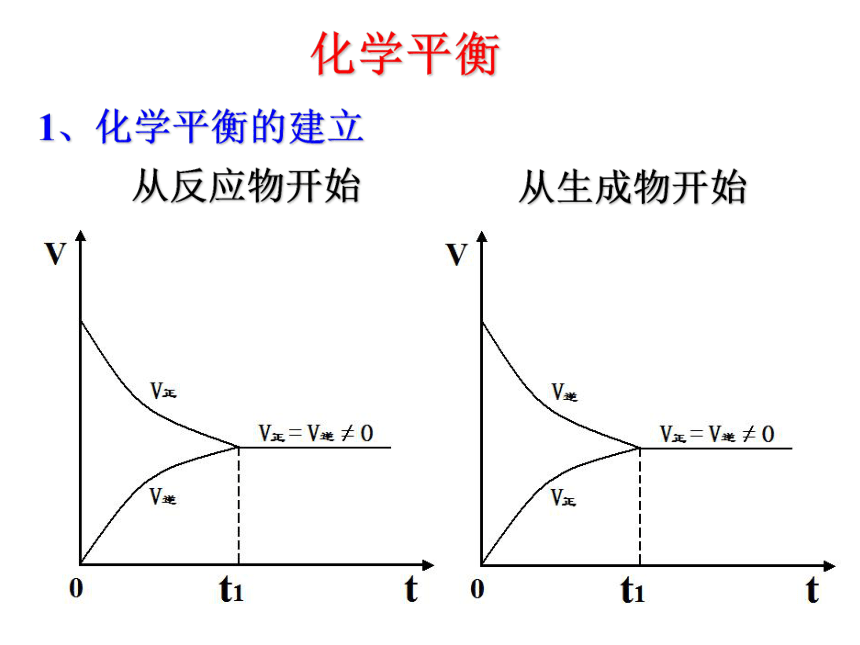
课件23张PPT。化学平衡1、化学平衡的建立从反应物开始从生成物开始2、化学平衡状态 在一定条件下的可逆反应里,正反应
速率和逆反应速率相等,反应混合物中各
组分的浓度保持不变的状态,称为化学平
衡状态。概念的理解:前提 是一定条件下的可逆反应实质 是ひ(正)=ひ(逆) ≠ 0标志 是反应混合物中各组分的浓度
保持不变3、化学平衡的特征(1) 逆—— 可逆反应 变—— 当浓度、压强、温度等条件改变
时,化学平衡即发生移动(2) 等—— ひ正=ひ逆 ≠ 0(3) 动—— 动态平衡 定—— 平衡状态时,反应混合物中各
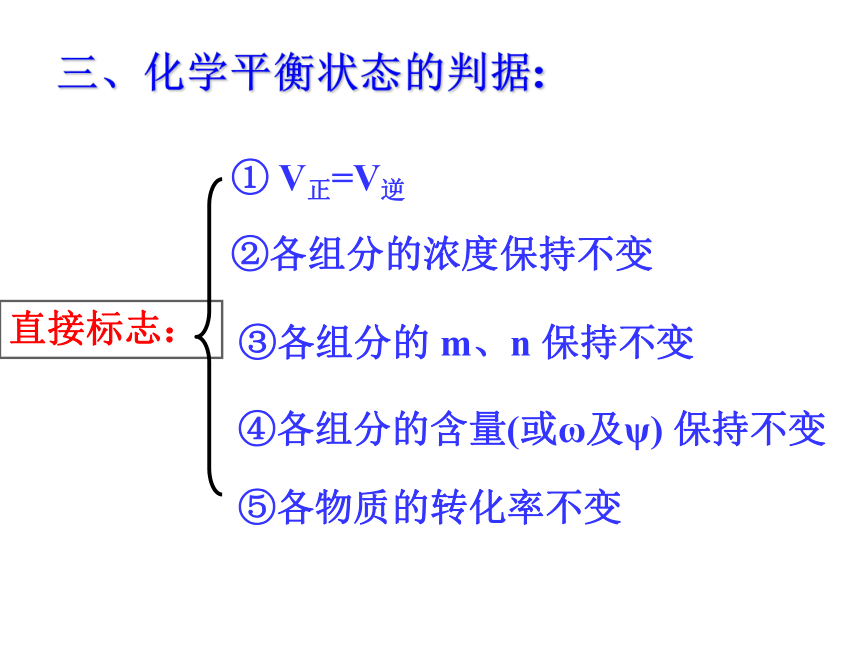
组分的浓度保持不变三、化学平衡状态的判据:① V正=V逆②各组分的浓度保持不变④各组分的含量(或ω及ψ) 保持不变 ⑤各物质的转化率不变直接标志: ③各组分的 m、n 保持不变 ②通过复合量,如摩尔质量和密度,需具体分析两项的变化 ③其它:如颜色等(实际上是浓度) 间接标志 下列方法中可以证明A(s) + 2B2(g) ? 2C2(g) +D2(g)
已经达到平衡状态的是______________________.⑵、一个B — B键的断裂的同时有一个C — C键的生成⑼、百分组成 B2% = C2% = D2%⑴、单位时间内生成了2molC的同时也生成了1molA⑶、反应速率ひ(B2)=ひ(C2)=1/2ひ(D2)⑷、C(B2):C(C2):C(D2) = 2:2:1⑸、温度、体积一定时, B2 、 C2 、 D2 浓度不再变化⑹、温度、体积一定时,容器内的压强不再变化⑺、条件一定时,混合气体的平均相对分子质量不再变化⑻、温度、体积一定时,混合气体的密度不再变化⑴、⑸、⑹、⑻ 例 在一定温度下的恒容容器中,当下列物理量不再发生变化时,表明反应:
A(s)+3B(g) 2C(g)+D(g)已达平衡状态的是 ( )
A.混合气体的压强 B.混合气体的密度
C.B的物质的量浓度 D.气体的总物质的量
BC四、化学平衡移动 对一个可逆反应中旧化学平衡的破坏、新化学平衡的建立过程叫做化学平衡移动。 化学平衡移动的根本原因:外界条件
改变,引起ひ正、ひ逆发生改变,且:
ひ正≠ひ逆≠0,造成化学平衡移动。五、影响化学平衡移动的因素1、浓度:在其他条件不变时,增大反应物
浓度或减小生成物浓度都可使化学平衡向正
反应方向移动;反之化学平衡向逆反应方向移动。2、压强:
对于反应前后气体总体积发生变化的可逆反应,
在其他条件不变时,增大压强,化学平衡向气体体
积缩小的方向移动;反之,化学平衡向气体体积增
大的方向移动。 其他条件不变时,压强增大,ひ正、ひ逆都提高,但气体体积之和大的反应速率增大的幅度更大。 压强对平衡的影响,
只考虑对参加反应的气态物质的影响。1、在一个固定体积的密闭的容器中,放入3升X(气)和2升Y(气),在一定条件下发生下列反应: 4X(g)+3Y(g) 2Q(g)+nR(g)。达到平衡后,容器内温度不变,混合气体的压强比原来增加5%,X的浓度减小1/3,则该反应方程式中的n值是
(A) 3 (B) 4 (C) 5 (D) 6D2、在密闭容器中进行反应N2+3H2 2NH3;△H<0,
一定温度下达到平衡,若将平衡体系中各物质浓度都
增加到原来的2倍,则产生结果是① 平衡不移动 ② 平
衡向正反应方向移动 ③ NH3的百分含量增加 ④ H2的
转化率增大 ⑤ 达到新平衡后容器的压强等于原平衡的
压强的2倍 ⑥C (N2)减小 ⑦ C(NH3)新>2C(NH3)原
(A) ① ② ③ ④ (B) ② ③ ④ ⑦ (C) ③ ④ ⑤ ⑥ (D) ④ ⑤ ⑥ ⑦ B课堂练习3、温度:
在其他条件不变的情况下,升高温度,
化学平衡向吸热反应方向移动,降低温度,
化学平衡向放热反应方向移动。升高温度,吸热反应方向的速率增大的幅度更大。降低温度,吸热反应方向的速率降低的幅度更大。 对于平衡:① C2H2+H2 C2H4;△Ha
和平衡:② 2CH4 C2H4+2H2;△Hb
在其他条件不变时,温度降低① 式向右移动
② 式相左移动。则热化学方程式:
C(固)+2H2(气)=CH4(气);△H1= -Q1KJ/mol 2C(固)+H2(气)=C2H2(气);△H2= -2Q2KJ/mol
2C(固)+2H2(气)=C2H4(气);△H3= -2Q3KJ/mol
中Q1、Q2、Q3值的大小比较是
(A) Q1>Q2>Q3 (B) Q1>Q3>Q2
(C) Q2>Q1>Q3 (D) Q3>Q2>Q1B课堂练习△Ha=2Q2-2Q3< 0△Hb=2Q1-2Q3 > 0 催化剂对化学平衡移动无影响,它的使用能
同等程度地改变正、逆反应速率(即反应速率改
变但仍然相等),可以改变化学反应达到平衡所
需要的时间。正催化剂可以加快反应速率,缩短
反应达到平衡所需要的时间。勒夏特列原理:
——化学平衡移动原理 若改变影响平衡的一个
条件(如浓度、压强、温度等),平衡就向能够减弱这种改变的方向移动。课堂练习:
1、反应 X(g) +Y(g) 2Z(g) (正反应放热),从正
反应开始经t1时间达到平衡状态,在t2末由于条件
变化,平衡受到破坏,在t3时达到新的平衡,下图
表示上述反应过程中
物质的浓度与反应时
间的变化关系,试问
图中的曲线变化是由
哪种条件的改变引起
的? ( )A、增大X或Y的浓度
B、增大压强
C、增大Z浓度
D、降低温度D2、下图表示可逆反应:
A(g) + B(g) C(g),当增大压强时,
平衡由a点移动到b点,正确的曲线是( )。BD4、如图曲线是在其他条件一定时,反应:
2NO2 ? N2O4 ; △H化率与温度的关系曲线。
图上标有A、B、C、D、E 5点,其中表示
未达到平衡状态且ひ(正)>ひ(逆)的点是( ) (A) A 或 E
(B) C
(C) B
(D) DB 5、可逆反应:
mA(S) +nB(g)? pC(g);△H<0
在一定温度的密闭容器中进行,B的
体积分数(VB%)与压强关系如图所示。
下列叙述正确的是( )(A) m + n < p
(B) n > p
(C) n < p
(D) x点时:
ひ(正)>ひ(逆)C D7、已建立化学平衡的某可逆反应,当改变条件
使化学平衡向正反应方向移动时,下列有关叙
述正确的是
① 生成物的百分含量一定增加② 生成物的产量
一定增加③ 反应物的转化率一定增大④ 反应物
浓度一定降低⑤ 正反应速率一定大于逆反应速
率⑥ 使用了合适的催化剂
A ① ② (B) ② ⑤ (C) ③ ⑤ (D) ④ ⑥B6、下列事实中不能用平衡移动原理解释的是
(A) 密闭、低温是存放氨水的必要条件 (B) 实验室用排饱和食盐水法收集氯气 (C) 硝酸工业生产中,使用过量空气以提高
NH3的利用率
(D) 在FeSO4溶液中,加入铁粉以防止氧化D8、对于平衡体系:
mA(气)+nB(气) pC(气)+qD(气);△H<0,
下列判断正确的是
(A) 若温度不变,将容器的体积增大1倍,
此时A的浓度变为原来的0.48倍,则m+n>p+q (B) 若平衡时,A、B的转化率相等,说明反
应开始时A、B的物质的量之比为m:n (C) 若平衡体系共有气体a mol,再向其中加
入b molB物质,当重新达到平衡时,气体的
总物质的量等于(a+b)mol,则m+n=q+p (D) 温度不变时,若压强增大为原来的2倍,
达到新平衡时,总体积一定比原体积的1/2
要小BC
速率和逆反应速率相等,反应混合物中各
组分的浓度保持不变的状态,称为化学平
衡状态。概念的理解:前提 是一定条件下的可逆反应实质 是ひ(正)=ひ(逆) ≠ 0标志 是反应混合物中各组分的浓度
保持不变3、化学平衡的特征(1) 逆—— 可逆反应 变—— 当浓度、压强、温度等条件改变
时,化学平衡即发生移动(2) 等—— ひ正=ひ逆 ≠ 0(3) 动—— 动态平衡 定—— 平衡状态时,反应混合物中各
组分的浓度保持不变三、化学平衡状态的判据:① V正=V逆②各组分的浓度保持不变④各组分的含量(或ω及ψ) 保持不变 ⑤各物质的转化率不变直接标志: ③各组分的 m、n 保持不变 ②通过复合量,如摩尔质量和密度,需具体分析两项的变化 ③其它:如颜色等(实际上是浓度) 间接标志 下列方法中可以证明A(s) + 2B2(g) ? 2C2(g) +D2(g)
已经达到平衡状态的是______________________.⑵、一个B — B键的断裂的同时有一个C — C键的生成⑼、百分组成 B2% = C2% = D2%⑴、单位时间内生成了2molC的同时也生成了1molA⑶、反应速率ひ(B2)=ひ(C2)=1/2ひ(D2)⑷、C(B2):C(C2):C(D2) = 2:2:1⑸、温度、体积一定时, B2 、 C2 、 D2 浓度不再变化⑹、温度、体积一定时,容器内的压强不再变化⑺、条件一定时,混合气体的平均相对分子质量不再变化⑻、温度、体积一定时,混合气体的密度不再变化⑴、⑸、⑹、⑻ 例 在一定温度下的恒容容器中,当下列物理量不再发生变化时,表明反应:
A(s)+3B(g) 2C(g)+D(g)已达平衡状态的是 ( )
A.混合气体的压强 B.混合气体的密度
C.B的物质的量浓度 D.气体的总物质的量
BC四、化学平衡移动 对一个可逆反应中旧化学平衡的破坏、新化学平衡的建立过程叫做化学平衡移动。 化学平衡移动的根本原因:外界条件
改变,引起ひ正、ひ逆发生改变,且:
ひ正≠ひ逆≠0,造成化学平衡移动。五、影响化学平衡移动的因素1、浓度:在其他条件不变时,增大反应物
浓度或减小生成物浓度都可使化学平衡向正
反应方向移动;反之化学平衡向逆反应方向移动。2、压强:
对于反应前后气体总体积发生变化的可逆反应,
在其他条件不变时,增大压强,化学平衡向气体体
积缩小的方向移动;反之,化学平衡向气体体积增
大的方向移动。 其他条件不变时,压强增大,ひ正、ひ逆都提高,但气体体积之和大的反应速率增大的幅度更大。 压强对平衡的影响,
只考虑对参加反应的气态物质的影响。1、在一个固定体积的密闭的容器中,放入3升X(气)和2升Y(气),在一定条件下发生下列反应: 4X(g)+3Y(g) 2Q(g)+nR(g)。达到平衡后,容器内温度不变,混合气体的压强比原来增加5%,X的浓度减小1/3,则该反应方程式中的n值是
(A) 3 (B) 4 (C) 5 (D) 6D2、在密闭容器中进行反应N2+3H2 2NH3;△H<0,
一定温度下达到平衡,若将平衡体系中各物质浓度都
增加到原来的2倍,则产生结果是① 平衡不移动 ② 平
衡向正反应方向移动 ③ NH3的百分含量增加 ④ H2的
转化率增大 ⑤ 达到新平衡后容器的压强等于原平衡的
压强的2倍 ⑥C (N2)减小 ⑦ C(NH3)新>2C(NH3)原
(A) ① ② ③ ④ (B) ② ③ ④ ⑦ (C) ③ ④ ⑤ ⑥ (D) ④ ⑤ ⑥ ⑦ B课堂练习3、温度:
在其他条件不变的情况下,升高温度,
化学平衡向吸热反应方向移动,降低温度,
化学平衡向放热反应方向移动。升高温度,吸热反应方向的速率增大的幅度更大。降低温度,吸热反应方向的速率降低的幅度更大。 对于平衡:① C2H2+H2 C2H4;△Ha
和平衡:② 2CH4 C2H4+2H2;△Hb
在其他条件不变时,温度降低① 式向右移动
② 式相左移动。则热化学方程式:
C(固)+2H2(气)=CH4(气);△H1= -Q1KJ/mol 2C(固)+H2(气)=C2H2(气);△H2= -2Q2KJ/mol
2C(固)+2H2(气)=C2H4(气);△H3= -2Q3KJ/mol
中Q1、Q2、Q3值的大小比较是
(A) Q1>Q2>Q3 (B) Q1>Q3>Q2
(C) Q2>Q1>Q3 (D) Q3>Q2>Q1B课堂练习△Ha=2Q2-2Q3< 0△Hb=2Q1-2Q3 > 0 催化剂对化学平衡移动无影响,它的使用能
同等程度地改变正、逆反应速率(即反应速率改
变但仍然相等),可以改变化学反应达到平衡所
需要的时间。正催化剂可以加快反应速率,缩短
反应达到平衡所需要的时间。勒夏特列原理:
——化学平衡移动原理 若改变影响平衡的一个
条件(如浓度、压强、温度等),平衡就向能够减弱这种改变的方向移动。课堂练习:
1、反应 X(g) +Y(g) 2Z(g) (正反应放热),从正
反应开始经t1时间达到平衡状态,在t2末由于条件
变化,平衡受到破坏,在t3时达到新的平衡,下图
表示上述反应过程中
物质的浓度与反应时
间的变化关系,试问
图中的曲线变化是由
哪种条件的改变引起
的? ( )A、增大X或Y的浓度
B、增大压强
C、增大Z浓度
D、降低温度D2、下图表示可逆反应:
A(g) + B(g) C(g),当增大压强时,
平衡由a点移动到b点,正确的曲线是( )。BD4、如图曲线是在其他条件一定时,反应:
2NO2 ? N2O4 ; △H
图上标有A、B、C、D、E 5点,其中表示
未达到平衡状态且ひ(正)>ひ(逆)的点是( ) (A) A 或 E
(B) C
(C) B
(D) DB 5、可逆反应:
mA(S) +nB(g)? pC(g);△H<0
在一定温度的密闭容器中进行,B的
体积分数(VB%)与压强关系如图所示。
下列叙述正确的是( )(A) m + n < p
(B) n > p
(C) n < p
(D) x点时:
ひ(正)>ひ(逆)C D7、已建立化学平衡的某可逆反应,当改变条件
使化学平衡向正反应方向移动时,下列有关叙
述正确的是
① 生成物的百分含量一定增加② 生成物的产量
一定增加③ 反应物的转化率一定增大④ 反应物
浓度一定降低⑤ 正反应速率一定大于逆反应速
率⑥ 使用了合适的催化剂
A ① ② (B) ② ⑤ (C) ③ ⑤ (D) ④ ⑥B6、下列事实中不能用平衡移动原理解释的是
(A) 密闭、低温是存放氨水的必要条件 (B) 实验室用排饱和食盐水法收集氯气 (C) 硝酸工业生产中,使用过量空气以提高
NH3的利用率
(D) 在FeSO4溶液中,加入铁粉以防止氧化D8、对于平衡体系:
mA(气)+nB(气) pC(气)+qD(气);△H<0,
下列判断正确的是
(A) 若温度不变,将容器的体积增大1倍,
此时A的浓度变为原来的0.48倍,则m+n>p+q (B) 若平衡时,A、B的转化率相等,说明反
应开始时A、B的物质的量之比为m:n (C) 若平衡体系共有气体a mol,再向其中加
入b molB物质,当重新达到平衡时,气体的
总物质的量等于(a+b)mol,则m+n=q+p (D) 温度不变时,若压强增大为原来的2倍,
达到新平衡时,总体积一定比原体积的1/2
要小BC
同课章节目录
