食醋总酸含量的测定
图片预览





文档简介
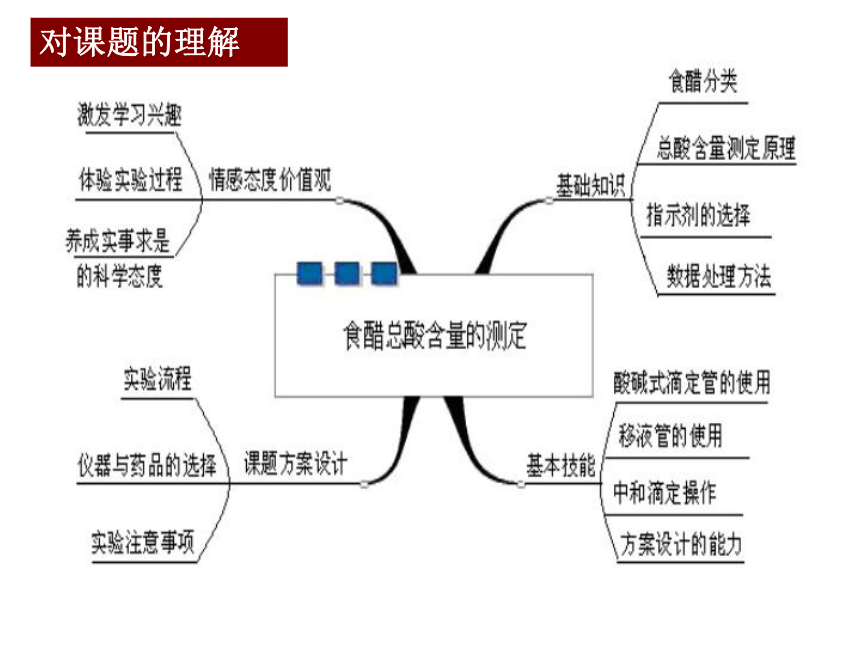
课件17张PPT。课题1 食醋总酸含量的测定专题6 物质的定量分析浙江省温岭中学 郭君瑞对课题的理解实验新特点1.移液管的使用
2.指示剂的选择
3.相对平均偏差的计算
4.涉及滴定曲线
5.运用中和滴定原理设计实验方案解决实际问题(与旧人教版比较)实验目标1.认识用NaOH溶液滴定醋酸的反应原理。
2.练习移液管、滴定管的使用方法,初步掌握中和滴
定的基本技能。
3.能通过实验收集有关数据,并正确地加以处理。
4.应用中和滴定法测定食醋的含酸量,体验用化学定
量分析方法解决实际问题的过程。
5.养成实事求是的科学态度。实验原理 1.化学反应原理:
CH3COOH+NaOH = CH3COONa + H2O
HnA(有机酸)+nNaOH = NanA + nH2O*2.NaOH溶液浓度的标定
(1)配制NaOH饱和溶液,放置一段时间后,吸取上 层清液,稀释到约0.1mol/L,即可得NaOH标准溶液。
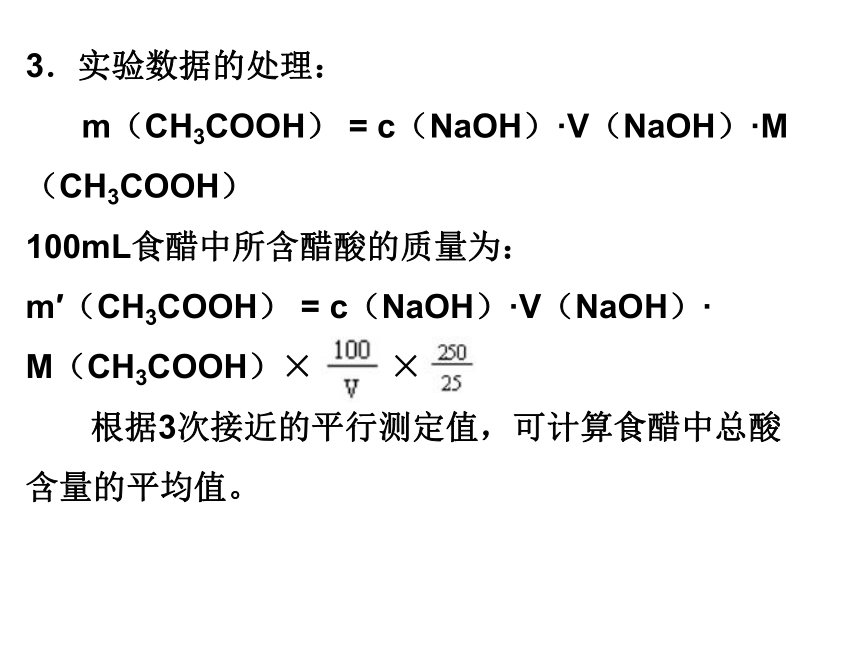
(2)用邻苯二甲酸氢钾(HOOCC6H4COOK)作为基准物质,以酚酞作为指示剂,标定上述NaOH标准溶液。 m/M = c(NaOH)×V(NaOH) 3.实验数据的处理:
m(CH3COOH) = c(NaOH)·V(NaOH)·M(CH3COOH)
100mL食醋中所含醋酸的质量为:
m′(CH3COOH) = c(NaOH)·V(NaOH)·
M(CH3COOH)× ×
根据3次接近的平行测定值,可计算食醋中总酸含量的平均值。平均相对偏差的计算绝对偏差(di)表示测定值(xi)与平均值(x)之差:
di=xi-x, x=
平均偏差(d)为各个单个偏差的平均值:
d= =
相对平均偏差:Rd = ×100% x1+ x2+x3+…+xnnd1+ d2+d3+…+dnn|x1-x|+|x2-x|+|x3-x|+…+|xn-x|nnd实验准备实验方案实验方案 仪器的洗涤溶液的装配★NaOH标准溶液配制3.数据处理与结论1.白醋:效果较好
2.香醋:稀释10倍
3.陈醋: 颜色很深注意事项 各种食醋颜色对比滴定前后颜色对比,区分度较好陈醋脱色半小时后的颜色配制NaOH溶液和稀释食醋的蒸馏水在实验前应加热煮沸2~3分钟,以尽可能除去溶解的CO2,并快速冷却至室温。(1)移液管尖嘴残留液体的处理
(2)滴定前后碱式滴定管中不能有气泡
(3)滴定管使用前要用待盛放的溶液润洗
锥形瓶不能用待测液润洗
(4)滴定终点的判断
(5)读数时是否平视几个关健
实验操作
教学建议1.课时分配
第一课时:食酸的分类,食醋总酸含量的测定原理,
滴定过程中pH的变化以及实验数据的处
理方法。
第二课时:复习滴定管的使用和中和滴定操作,练习
移液管的使用,课题方案的设计与论证。
第三课时:完成食酸总酸含量测定的实验与评价。分组公布实验方案,
说出各自的困惑各组对各种方案
进行质疑与评价学生设计实验方案实验与评价初步实施实验方案 细化实验方案 432561食酸总酸
含量的测定2.教学设计思路(课题方案设计教学)实验药品:白醋、香醋、陈醋、0.1%酚酞、甲基橙、活性炭、蒸馏水。
2.指示剂的选择
3.相对平均偏差的计算
4.涉及滴定曲线
5.运用中和滴定原理设计实验方案解决实际问题(与旧人教版比较)实验目标1.认识用NaOH溶液滴定醋酸的反应原理。
2.练习移液管、滴定管的使用方法,初步掌握中和滴
定的基本技能。
3.能通过实验收集有关数据,并正确地加以处理。
4.应用中和滴定法测定食醋的含酸量,体验用化学定
量分析方法解决实际问题的过程。
5.养成实事求是的科学态度。实验原理 1.化学反应原理:
CH3COOH+NaOH = CH3COONa + H2O
HnA(有机酸)+nNaOH = NanA + nH2O*2.NaOH溶液浓度的标定
(1)配制NaOH饱和溶液,放置一段时间后,吸取上 层清液,稀释到约0.1mol/L,即可得NaOH标准溶液。
(2)用邻苯二甲酸氢钾(HOOCC6H4COOK)作为基准物质,以酚酞作为指示剂,标定上述NaOH标准溶液。 m/M = c(NaOH)×V(NaOH) 3.实验数据的处理:
m(CH3COOH) = c(NaOH)·V(NaOH)·M(CH3COOH)
100mL食醋中所含醋酸的质量为:
m′(CH3COOH) = c(NaOH)·V(NaOH)·
M(CH3COOH)× ×
根据3次接近的平行测定值,可计算食醋中总酸含量的平均值。平均相对偏差的计算绝对偏差(di)表示测定值(xi)与平均值(x)之差:
di=xi-x, x=
平均偏差(d)为各个单个偏差的平均值:
d= =
相对平均偏差:Rd = ×100% x1+ x2+x3+…+xnnd1+ d2+d3+…+dnn|x1-x|+|x2-x|+|x3-x|+…+|xn-x|nnd实验准备实验方案实验方案 仪器的洗涤溶液的装配★NaOH标准溶液配制3.数据处理与结论1.白醋:效果较好
2.香醋:稀释10倍
3.陈醋: 颜色很深注意事项 各种食醋颜色对比滴定前后颜色对比,区分度较好陈醋脱色半小时后的颜色配制NaOH溶液和稀释食醋的蒸馏水在实验前应加热煮沸2~3分钟,以尽可能除去溶解的CO2,并快速冷却至室温。(1)移液管尖嘴残留液体的处理
(2)滴定前后碱式滴定管中不能有气泡
(3)滴定管使用前要用待盛放的溶液润洗
锥形瓶不能用待测液润洗
(4)滴定终点的判断
(5)读数时是否平视几个关健
实验操作
教学建议1.课时分配
第一课时:食酸的分类,食醋总酸含量的测定原理,
滴定过程中pH的变化以及实验数据的处
理方法。
第二课时:复习滴定管的使用和中和滴定操作,练习
移液管的使用,课题方案的设计与论证。
第三课时:完成食酸总酸含量测定的实验与评价。分组公布实验方案,
说出各自的困惑各组对各种方案
进行质疑与评价学生设计实验方案实验与评价初步实施实验方案 细化实验方案 432561食酸总酸
含量的测定2.教学设计思路(课题方案设计教学)实验药品:白醋、香醋、陈醋、0.1%酚酞、甲基橙、活性炭、蒸馏水。
同课章节目录
- 专题一 物质的分离与提纯
- 课题1 海带中碘元素的分离及检验
- 拓展课题1-1 茶叶中某些元素的鉴定
- 课题2 用纸层析法分离铁离子和铜离子
- 拓展课题1-2 菠菜的叶绿体中色素的提取和分离
- 拓展课题1-3 用粉笔进行层析分离
- 课题3 硝酸钾晶体的制备
- 拓展课题1-4 粗盐提纯
- 专题二 物质性质的研究
- 课题1 铝及其化合物的性质
- 拓展课题2-1 铝热反应
- 课题2 乙醇和苯酚的性质
- 拓展课题2-2 苯酚与甲醛的反应
- 专题三 物质的检验与鉴别
- 课题1 牙膏和火柴中某些成分的检验
- 拓展课题3-1 新装修居室内空气中甲醛浓度的检测
- 拓展课题3-2 汽车尾气成分的检验
- 课题2 亚硝酸钠和食盐的鉴别
- 拓展课题3-3 真假碘盐的鉴别
- 专题四 化学反应条件的控制
- 课题1 硫代硫酸钠与酸反应速率的影响因素
- 拓展课题4-1 “蓝瓶子”实验
- 课题2 催化剂对过氧化氢分解反应速率的影响
- 拓展课题4-2 过氧化氢酶的催化作用
- 拓展课题4-3 蔗糖的燃烧
- 课题3 反应条件对化学平衡的影响
- 拓展课题4-4 淀粉与碘显色现象的探究
- 拓展课题4-5 压强对化学平衡的影响
- 专题五 电化学问题研究
- 课题1 原电池
- 拓展课题5-1 干电池模拟实验
- 课题2 电解与电镀
- 拓展课题5-2 阿伏加德罗常数的测定
- 专题六 物质的定量分析
- 课题1 食醋总酸含量的测定
- 拓展课题6-1 配制并标定氢氧化钠溶液
- 课题2 镀锌铁皮锌镀层厚度的测定
- 拓展课题6-2 水果中维生素C含量的测定
- 专题七 物质的制备与合成
- 课题1 硫酸亚铁铵的制备
- 拓展课题7-1 用制氢废液制备硫酸锌晶体
- 课题2 阿司匹林的合成
- 拓展课题7-2 对氨基苯磺酸的合成
