原电池原理及应用复习
图片预览


文档简介
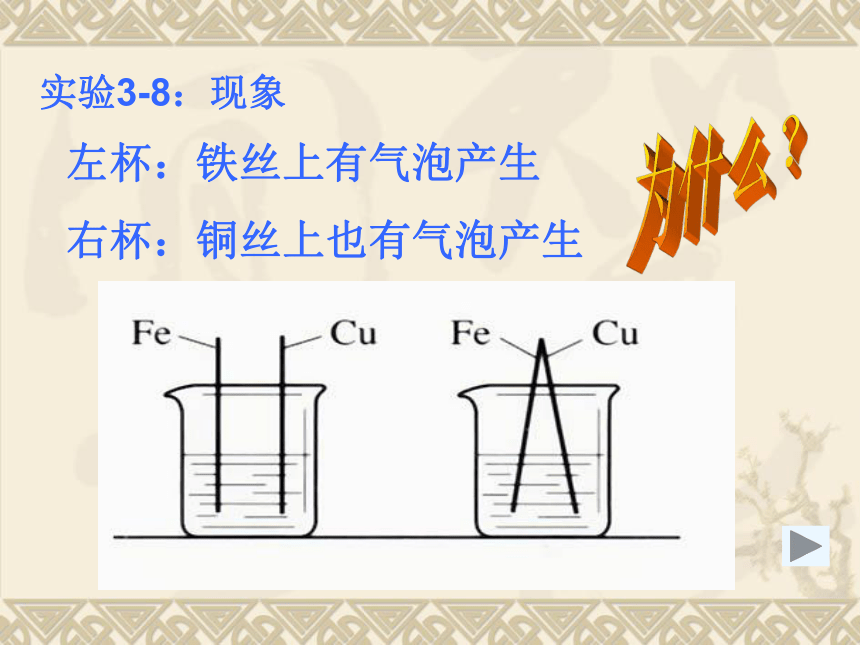
课件18张PPT。第四节 原电池原理及应用实验3-8:现象左杯:铁丝上有气泡产生
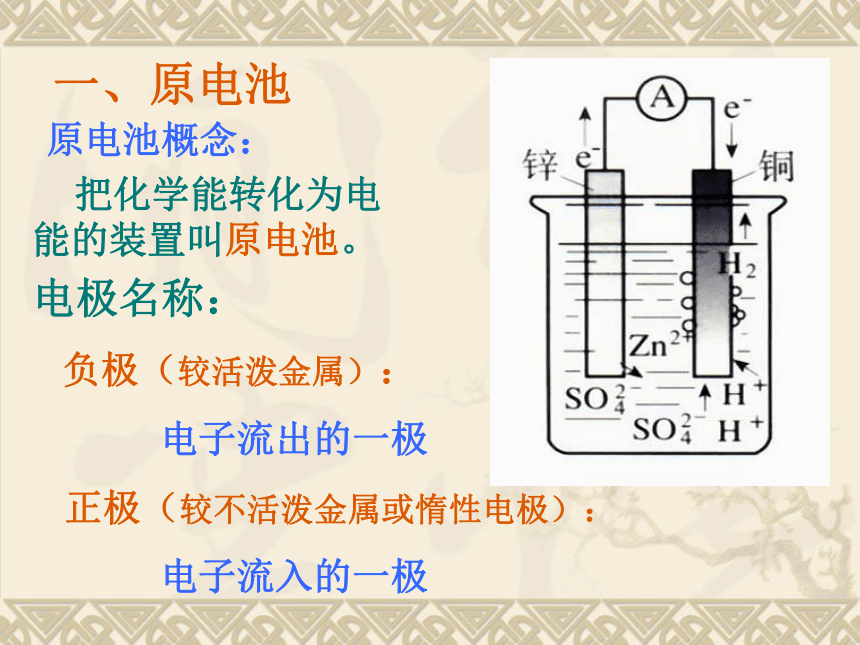
右杯:铜丝上也有气泡产生为什么?原电池概念: 把化学能转化为电能的装置叫原电池。电极名称:
负极(较活泼金属):
电子流出的一极
正极(较不活泼金属或惰性电极):
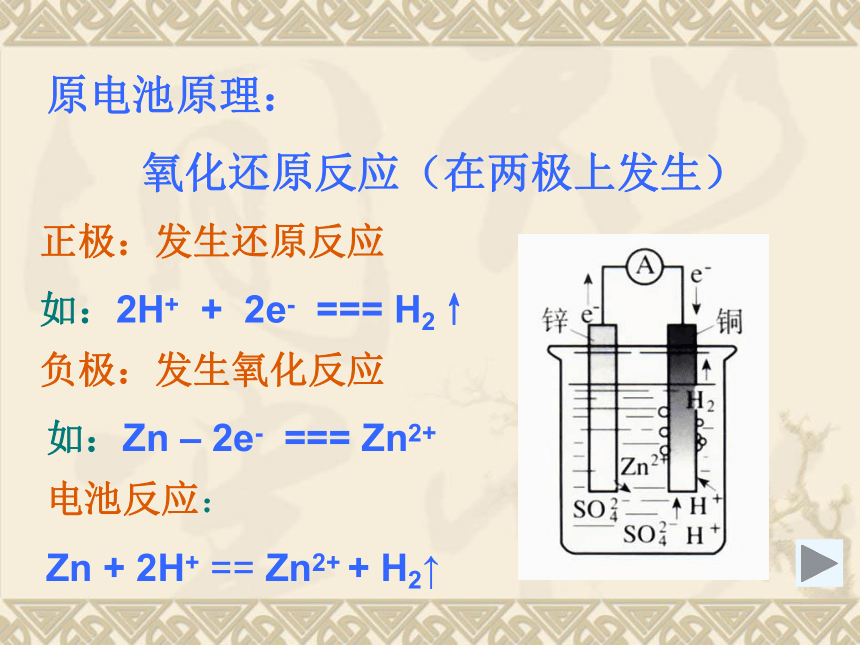
电子流入的一极一、原电池 原电池原理:
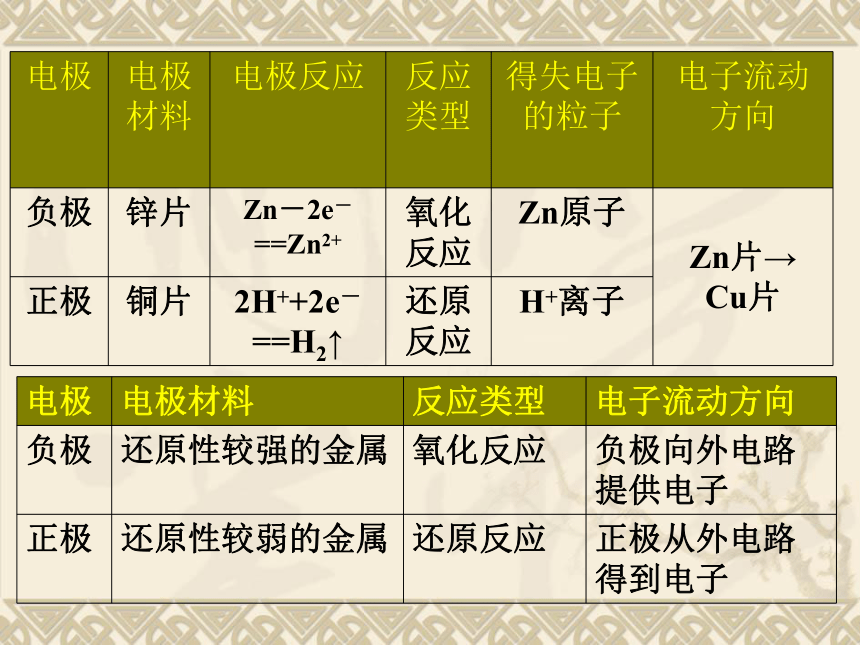
氧化还原反应(在两极上发生)正极:发生还原反应负极:发生氧化反应如:2H+ + 2e- === H2↑如:Zn – 2e- === Zn2+电池反应:
Zn + 2H+ == Zn2+ + H2↑ 构成原电池的条件:1、电极:
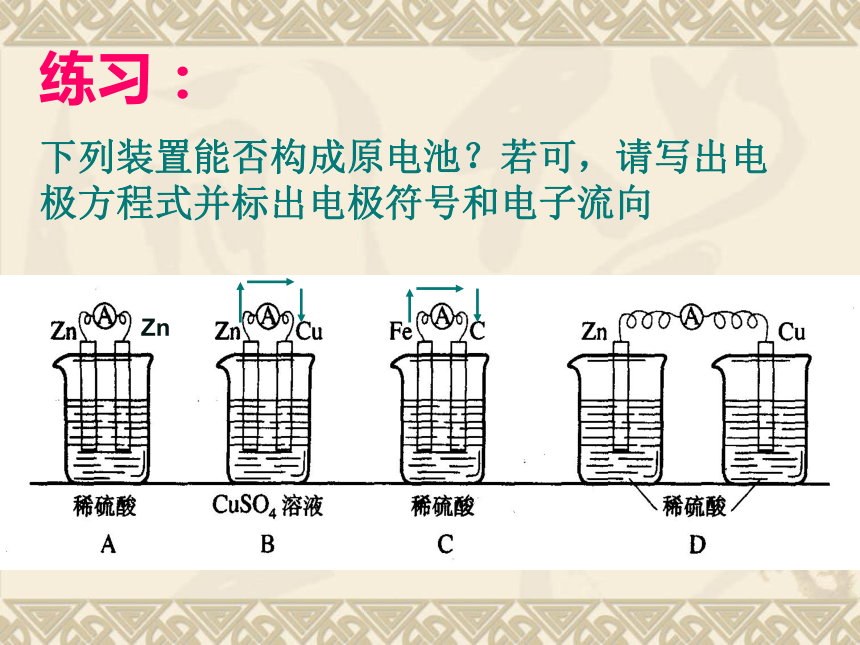
活动性不同的金属或金属和非金属3、电解质溶液2、电极要接触(或用导线)Zn练习:
下列装置能否构成原电池?若可,请写出电极方程式并标出电极符号和电子流向原电池原理的应用:作业
课 本:P.68 一~二
优化设计:P.101自学导引:一
P.102 1~4二、化学电源1、干电池负极(锌筒):Zn – 2e- === Zn2+
正极(石墨):2MnO2+2NH4++2e- === Mn2O3+2NH3+H2O2、铅蓄电池正极:PbO2
负极:Pb
电解质溶液:H2SO4
(密度为1.25g/cm3
— 1.28g/cm3 )3、银-锌蓄电池用于卫星、火箭、空间电视转播站4、锂电池优点:高能、质轻、电压高、工作效
率高和储存时间长。用途:电脑、照相机、手表、心脏
起搏器、手机和火箭、导
弹的动力电源。5、新型电池负极:2H2- 4e- = 4H+
正极:O2 + 2H2O + 4e- = 4OH-电池反应:
2H2+O2===2H2O优点:能量转化率高、
不污染环境。废旧电池回收减 少 污 染
节 约 资 源三、金属的腐蚀1、化学腐蚀2、电化腐蚀(1)析氢腐蚀负极(Fe):Fe-2e- == Fe2+
正极(C):2H++2e- == H2↑思考:用锌和稀硫酸制取氢气时,滴加少量硫
酸铜会加快产生氢气的速率,为什么?2、吸氧腐蚀负极(Fe):2Fe – 4e- == 2Fe2+
正极 (C):2H2O + O2 + 4e- == 4OH-3、金属的防护(1)制成合金
(2)喷油漆、涂油脂、电镀、
喷镀、钝化
(3)电化学保护法。小 结原电池构成原电池的条件(判断)原电池概念(正负极判断)原电池原理(电极反应式、
电子流动方向)化学电源干电池铅蓄电池银-锌蓄电池锂电池新型电池金属腐蚀1、化学腐蚀2、电化腐蚀析氢吸氧金属防护 (1)制成合
(2)喷油漆、涂
油脂、电镀、
喷镀、钝化。
(3)电化学保护。
右杯:铜丝上也有气泡产生为什么?原电池概念: 把化学能转化为电能的装置叫原电池。电极名称:
负极(较活泼金属):
电子流出的一极
正极(较不活泼金属或惰性电极):
电子流入的一极一、原电池 原电池原理:
氧化还原反应(在两极上发生)正极:发生还原反应负极:发生氧化反应如:2H+ + 2e- === H2↑如:Zn – 2e- === Zn2+电池反应:
Zn + 2H+ == Zn2+ + H2↑ 构成原电池的条件:1、电极:
活动性不同的金属或金属和非金属3、电解质溶液2、电极要接触(或用导线)Zn练习:
下列装置能否构成原电池?若可,请写出电极方程式并标出电极符号和电子流向原电池原理的应用:作业
课 本:P.68 一~二
优化设计:P.101自学导引:一
P.102 1~4二、化学电源1、干电池负极(锌筒):Zn – 2e- === Zn2+
正极(石墨):2MnO2+2NH4++2e- === Mn2O3+2NH3+H2O2、铅蓄电池正极:PbO2
负极:Pb
电解质溶液:H2SO4
(密度为1.25g/cm3
— 1.28g/cm3 )3、银-锌蓄电池用于卫星、火箭、空间电视转播站4、锂电池优点:高能、质轻、电压高、工作效
率高和储存时间长。用途:电脑、照相机、手表、心脏
起搏器、手机和火箭、导
弹的动力电源。5、新型电池负极:2H2- 4e- = 4H+
正极:O2 + 2H2O + 4e- = 4OH-电池反应:
2H2+O2===2H2O优点:能量转化率高、
不污染环境。废旧电池回收减 少 污 染
节 约 资 源三、金属的腐蚀1、化学腐蚀2、电化腐蚀(1)析氢腐蚀负极(Fe):Fe-2e- == Fe2+
正极(C):2H++2e- == H2↑思考:用锌和稀硫酸制取氢气时,滴加少量硫
酸铜会加快产生氢气的速率,为什么?2、吸氧腐蚀负极(Fe):2Fe – 4e- == 2Fe2+
正极 (C):2H2O + O2 + 4e- == 4OH-3、金属的防护(1)制成合金
(2)喷油漆、涂油脂、电镀、
喷镀、钝化
(3)电化学保护法。小 结原电池构成原电池的条件(判断)原电池概念(正负极判断)原电池原理(电极反应式、
电子流动方向)化学电源干电池铅蓄电池银-锌蓄电池锂电池新型电池金属腐蚀1、化学腐蚀2、电化腐蚀析氢吸氧金属防护 (1)制成合
(2)喷油漆、涂
油脂、电镀、
喷镀、钝化。
(3)电化学保护。
