沉淀溶解平衡
图片预览






文档简介
课件15张PPT。沉淀溶解平衡按照溶解度的大小,可分为:结论:绝对不溶 的物质是没有的活动与探究:白色沉淀黄色沉淀Ag+ + Cl- = AgClAg+ + I- = AgI溶解度(S): 在一定温度下,某物质在100g 溶剂
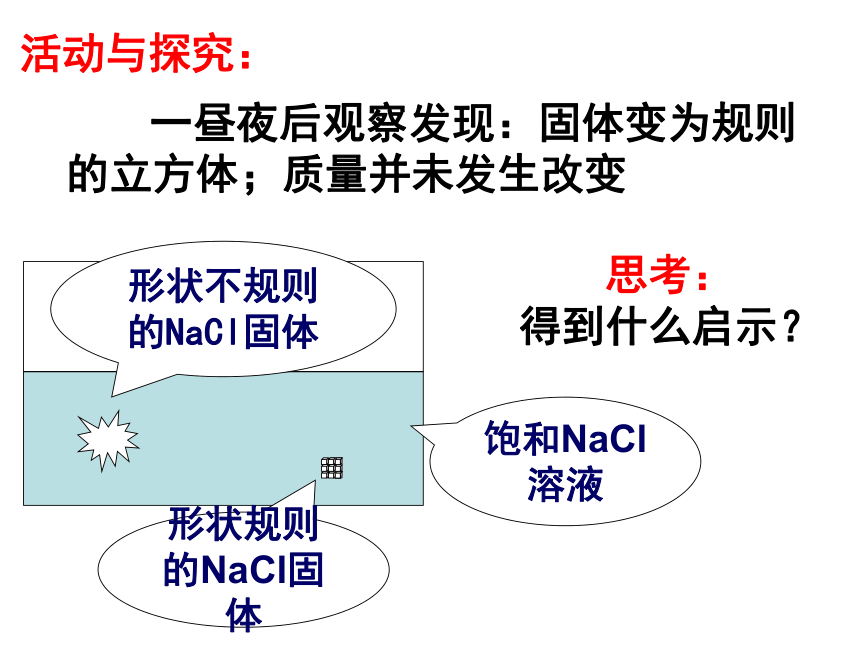
里达到饱和状态 时所溶解的质量饱和NaCl溶液 一昼夜后观察发现:固体变为规则的立方体;质量并未发生改变思考:
得到什么启示?活动与探究:一、沉淀溶解平衡1、概念:在一定的温度下,当沉淀溶解的
速率和沉淀生成速率相等注意:饱和溶液2、表示方法:AgCl(S) Ag+(aq)+Cl-(aq)3、意义:不表示 电离平衡
表示:一方面:少量的Ag+ 和Cl-
脱离AgCl表面进入水中,另一方面:溶液中
的Ag+和Cl-受AgCl表面的阴、阳离子的吸引
回到AgCl的表面认识1:生成沉淀的离子反应之所以能够发生,在于生成物的溶解度很小认识2:难溶电解质的溶解度尽管很小,但不会为0认识3:溶解度小于0.01g的电解质称为难溶电解质,残留在溶液中的离子浓度小于1X10-5mol/L,就认为反应完全了。练习:分别书写下列物质的电离方程式和
沉淀溶解平衡方程式4、沉淀溶解平衡的特征:等:
定:
动:
变:
达到沉淀溶解平衡,沉淀溶解速率
与沉淀的形成的速率相等达到沉淀溶解平衡,溶质离子浓度
保持不变动态平衡,达到沉淀溶解平衡,沉淀的生成与溶解仍在进行,其速率相等沉淀溶解平衡是在一定条件下建立起
来的,当条件改变,会建立新的平衡5、影响沉淀溶解平衡的因素:(1)内因(决定因素):溶质本身的性质(2)外因:讨论:对于平衡AgCl(S) Ag+(aq) + Cl-(aq)
若改变条件,对其有何影响→ ↑ ↑→ 不变 不变不移动 不变 不变← ↓ ↑→ ↓ ↑← ↑ ↓ 写出AgCl(s) Ag+ + Cl- 的平衡
常数表达式动 动 手二、溶度积常数(简称溶度积)1、表示: Ksp 作业:
作业本
里达到饱和状态 时所溶解的质量饱和NaCl溶液 一昼夜后观察发现:固体变为规则的立方体;质量并未发生改变思考:
得到什么启示?活动与探究:一、沉淀溶解平衡1、概念:在一定的温度下,当沉淀溶解的
速率和沉淀生成速率相等注意:饱和溶液2、表示方法:AgCl(S) Ag+(aq)+Cl-(aq)3、意义:不表示 电离平衡
表示:一方面:少量的Ag+ 和Cl-
脱离AgCl表面进入水中,另一方面:溶液中
的Ag+和Cl-受AgCl表面的阴、阳离子的吸引
回到AgCl的表面认识1:生成沉淀的离子反应之所以能够发生,在于生成物的溶解度很小认识2:难溶电解质的溶解度尽管很小,但不会为0认识3:溶解度小于0.01g的电解质称为难溶电解质,残留在溶液中的离子浓度小于1X10-5mol/L,就认为反应完全了。练习:分别书写下列物质的电离方程式和
沉淀溶解平衡方程式4、沉淀溶解平衡的特征:等:
定:
动:
变:
达到沉淀溶解平衡,沉淀溶解速率
与沉淀的形成的速率相等达到沉淀溶解平衡,溶质离子浓度
保持不变动态平衡,达到沉淀溶解平衡,沉淀的生成与溶解仍在进行,其速率相等沉淀溶解平衡是在一定条件下建立起
来的,当条件改变,会建立新的平衡5、影响沉淀溶解平衡的因素:(1)内因(决定因素):溶质本身的性质(2)外因:讨论:对于平衡AgCl(S) Ag+(aq) + Cl-(aq)
若改变条件,对其有何影响→ ↑ ↑→ 不变 不变不移动 不变 不变← ↓ ↑→ ↓ ↑← ↑ ↓ 写出AgCl(s) Ag+ + Cl- 的平衡
常数表达式动 动 手二、溶度积常数(简称溶度积)1、表示: Ksp 作业:
作业本
