盐类的水解(四川省成都市金牛区)
图片预览

文档简介
第三节 盐类的水解
教学目标:
1.使学生理解盐类水解的实质,掌握水解的规律,能初步根据盐的组成判断盐溶液的酸碱性。
2.使学生初步掌握水解离子方程式的书写。
3.能够利用物料守恒、电荷守恒、质子守恒等知识分析盐溶液的组成及性质。
教学重点:
1.盐类水解的本质
2.盐类水解方程式的书写
3.物料守恒、电荷守恒、质子守恒
4. 溶液中离子浓度大小的判断
教学难点:
1. 物料守恒、电荷守恒、质子守恒
2. 溶液中离子浓度大小的判断
教学过程:
一、盐类的水解
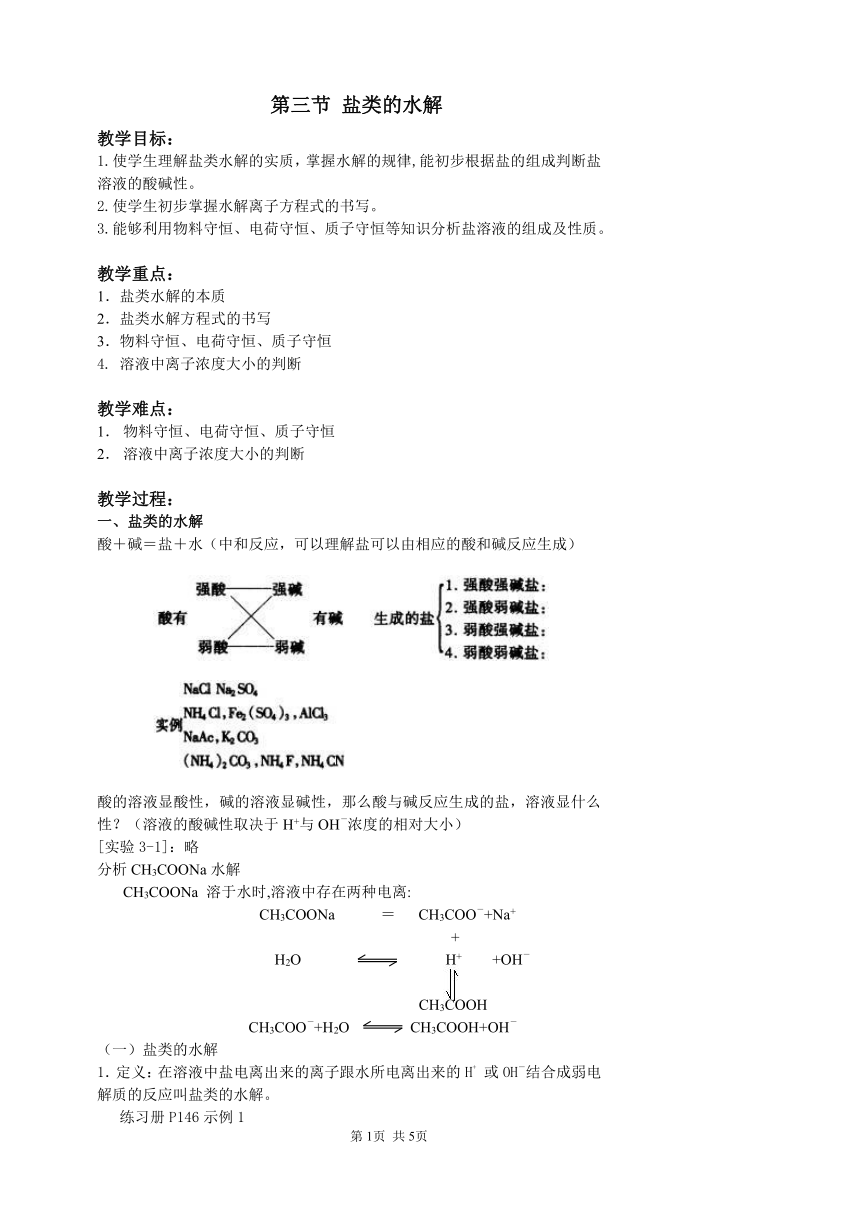
酸+碱=盐+水(中和反应,可以理解盐可以由相应的酸和碱反应生成)
酸的溶液显酸性,碱的溶液显碱性,那么酸与碱反应生成的盐,溶液显什么性?(溶液的酸碱性取决于H+与OH-浓度的相对大小)
[实验3-1]:略
分析CH3COONa水解
CH3COONa 溶于水时,溶液中存在两种电离:
CH3COONa = CH3COO-+Na+
H2O H+ +OH-
CH3COOH
CH3COO-+H2O CH3COOH+OH-
(一)盐类的水解
1.定义:在溶液中盐电离出来的离子跟水所电离出来的H+ 或OH-结合成弱电解质的反应叫盐类的水解。
练习册P146示例1
2.本质:盐中的离子使水的电离平衡发生了移动。
3.特点:盐类的水解是中和反应的逆反应,是可逆反应。
4.类型:
(1)强酸强碱盐
如KNO3、 Na2SO4 不水解,溶液成中性,原因是强酸强碱盐电离出的阴离子、阳离子都不与水电离出的氢离子或氢氧根离子结合生成弱电解质,所以,溶液中盐电离的阳离子、阴离子和氢离子、氢氧根离子的数目都保持不变,没有破坏水的电离平衡,氢离子浓度等于氢氧根离子浓度,显中性。
(2)强酸弱碱盐
如Al 2(SO4)3 NH4NO3水解之后溶液成酸性,原因是弱碱的阳离子结合水电离的OH-,使H+浓度增大,使溶液成酸性。
(3)强碱弱酸盐
如NaClO K2CO3水解之后溶液成碱性,原因是弱酸的阴离子结合水电离的H+使OH-浓度增大,使溶液成碱性。
(4)弱酸酸式盐
溶液酸碱性取决于酸根离子的水解和电离的相对大小
1 若电离程度大于水解程度,溶液成酸性,如NaHSO3、NaH2PO4等
2 若电离程度小于水解程度,溶液成碱性,如NaHCO3、Na2HPO4等
(5)弱酸弱碱盐
弱酸弱碱盐的水解叫做双水解,即该盐的阴阳离子都发生水解,而且可以互相促进,使水解程度变大。弱酸弱碱盐中的阳离子可以结合水电离出来的氢氧根离子反应产生对应的弱碱,而酸根离子可以结合水电离出来的氢离子反应产生对应的弱酸。
若盐水解之后生成的酸和碱的酸碱性相对较强,那么双水解才能进行彻底,如Al3+与HCO3- CO32— S2—; Fe3+与CO32— AlO2—否则不能进行彻底,如CH3COONH4 (练习册P152 表)
5.规律
谁弱谁水解,谁强显谁性,越弱越水解,都弱都水解,都强显中性。
练习册P146 课堂练习5题 课后作业5题
(二)盐类的水解方程式的书写
1.找出发生水解的离子,直接写出水解的离子方程式。
2.水解是可逆反应,一般用“ ”连接,只有双水解彻底时用“=”连接。
3.不写“↑”、“↓”及分解形式;只有双水解彻底时双水解时写“↑”、“↓”。
4.多元弱酸根阴离子的水解要分步写,且以第一步水解为主,如CO32-:
第一步:CO32-+H2O HCO3-+OH-
第二步:HCO3-+H2O H2CO3+OH-
5.多元弱碱根阳离子的水解多步并为一步写,
如Fe3+:Fe3++3H2O Fe(OH)3 +3H+
6.水解方程式要符合电荷守恒。
练习册P146跟踪练习2
二、盐类的水解平衡
(一)盐类的水解平衡
实质上是化学平衡
(二)影响盐类水解平衡的因素
1.温度
因为是中和反应的逆反应,而中和反应为放热反应,所以水解反应是吸热反应。升高温度,有利于促进水解。
2.浓度
溶液浓度越小,实际上是增加了水的量,可使平衡相正反应方向移动,使盐的水解程度增大(最好用勒沙特例原理中浓度同时减小的原理来解释)。所以稀释能促进盐类的水解。
练习册P147 4题
3.加酸或碱
H+可抑制阳离子水解,促进阴离子水解;OH-能促进阳离子水解,抑制阴离子水解。
练习册P148 Fe3++3H2O Fe(OH)3 +3H+ 的相关表格
三、盐类的水解溶液中存在的三个守恒规律
1.电荷守恒规律:电解质溶液中,无论存在多少种离子,溶液总是呈电中性,即阴离子所带负电荷总数一定等于阳离子所带正电荷总数,即盐溶液中阴、阳离子所带的电荷总数相等。
如:①NH4Cl溶液中阳离子有NH4+ ,根据电荷守恒原理有:c(NH4+)+c(H+)=c(Cl-)+c(OH-);
②Na2CO3溶液中阳离子有Na+和H+ ,阴离子有 OH-,HCO3-,CO32-,根据电荷守恒原理有:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)。
2.物料守恒规律:电解质溶液中,由于某些离子能水解或电离,导致离子种类增多,但某些关键性的原子总是守恒的,即某元素各种不同存在形态的微粒物质的量总和不变。
如:①0.1mol/L NH4Cl溶液中:
c(NH4+)+c(NH3 H2O)=0.1mol/L=c(Cl-);
②0.1mol/LNa2CO3溶液中:
2[c(CO32-)+c(HCO3-)+c(H2CO3)]=0.1mol/L= c(Na+)
3.质子守恒规律:水电离出的H+ 数与OH- 数守恒:是依据水电离反应
H2O H+ + OH-,水电离产生的H+ 和OH- 的物质的量总是相等的,无论在溶液中该H+ 和OH- 以什么形式存在。
如:①NH4Cl溶液中:c(H+) = c(OH-) + c(NH3 H2O);
②Na2CO3溶液中:c(OH-) = c(H+) + c(HCO3-) + 2c(H2CO3)。
简单判断方法:先正确写出该溶液的电荷平衡式和物料平衡式,然后联立该两平衡式,消去该电解质在溶液中电离的离子。
如Na2CO3溶液:
电荷守恒:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)
物料守恒:2[c(CO32-)+c(HCO3-)+c(H2CO3)]=0.1mol/L= c(Na+)
然后消去Na+ 可得c(OH-) = c(H+) + c(HCO3-) + 2c(H2CO3)
练习册P150 课后作业5题
四、盐类的水解溶液中溶液中离子浓度的大小比较
规律:先定物质的量,再看水解(或电离)的程度,最后定溶液的酸碱性。
练习册P149 示例3,P150课堂练习5题, P154 示例4
1. 溶液中各粒子的等量关系
满足电荷守恒和物料守恒,在可由两种关系引申出一系列不同的关系式。
2. 溶液中各粒子的大小关系
1 水解生成的离子浓度要比水解的离子剩余的浓度小。
2 酸性溶液c(H+)> c(OH-) 碱性溶液c(H+)< c(OH-)
3 多元弱酸的酸根或多元弱碱的阳离子都是分步水解,但以第一步水解位主。
例如:Na2CO3溶液 c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+)
4 弱酸式盐要考虑酸根的水解和电离两种趋势,并比较大小
如HSO3—、H2PO4—是电离程度大于水解程度,而其它弱酸的酸根都是电离程度小于水解程度,如HCO3—、HPO42—等
例如:NaHCO3溶液 c(Na+)> c(HCO3-)>c(OH-)>c(H+)c(CO32-)
5 混合溶液要首先分析相互间反应是是否有弱酸(或弱碱)剩余,虽然生成的盐的水解也要考虑,但剩余弱酸(或弱碱)的电离占主导地位。
例如:0.4mol/L的NH3·H2O溶液和0.2mol/L的HCl溶液等体积混合,混合之后离子浓度的大小顺序为:c(NH4+)>c(Cl-)c(OH-)> c(H+)
五、盐类水解的利用(练习册P148)
注意:1.某些活泼金属、氧化物、氢氧化物与强酸弱碱盐反应时,要考虑盐的水解。
2.蒸干盐的溶液时,要考虑盐类水解平衡的移动。
3.贮存某些盐的溶液时候,也要考虑滩的水解。
练习册P149 示例2
板书设计:
第三节 盐类的水解
一、盐类的水解
(一)盐类的水解
1.定义:在溶液中盐电离出来的离子跟水所电离出来的H+或OH-结合成弱电解质的反应叫盐类的水解。
2.本质:盐中的离子使水的电离平衡发生了移动。
3.特点:盐类的水解是中和反应的逆反应,是可逆反应。
4.类型:
(1)强酸强碱盐显中性。
(2)强酸弱碱盐显酸性。
(3)强碱弱酸盐显碱性。
(4)弱酸酸式盐:溶液酸碱性取决于酸根离子的水解和电离的相对大小
①若电离程度大于水解程度,溶液成酸性,如NaHSO3、NaH2PO4等
②若电离程度小于水解程度,溶液成碱性,如NaHCO3、Na2HPO4等
(5)弱酸弱碱盐
弱酸弱碱盐的水解叫做双水解,即该盐的阴阳离子都发生水解,而且可以互相促进,使水解程度变大。弱酸弱碱盐中的金属离子可以结合水电离出来的氢氧根离子反应产生对应的弱碱,而酸根离子可以结合水电离出来的氢离子反应产生对应的弱酸。
若盐水解之后生成的酸和碱的酸碱性相对较强,那么双水解才能进行彻底,如Al3+与HCO3- CO32— S2—; Fe3+与CO32— AlO2—否则不能进行彻底,如CH3COO—与NH4+
5.规律
谁弱谁水解,谁强显谁性,越弱越水解,都弱都水解,都强显中性。
(二)盐类的水解方程式的书写
1.找出发生水解的离子,直接写出水解的离子方程式。
2.水解是可逆反应,一般用“ ”连接,只有双水解彻底时用“=”连接。
3.不写“↑”、“↓”及分解形式;只有双水解彻底时写“↑”、“↓”。
4.多元弱酸根阴离子的水解要分步写,且以第一步水解为主,如CO32-:
第一步:CO32-+H2O HCO3-+OH-
第二步:HCO3-+H2O H2CO3+OH-
5.多元弱碱根阳离子的水解多步并为一步写,如Fe3+:
Fe3++3H2O Fe(OH)3 +3H+
6.水解方程式要符合电荷守恒。
二、盐类的水解平衡
(一)盐类的水解平衡
(二)影响盐类水解平衡的因素
1.温度:升高温度,有利于促进水解。
2.浓度:稀释能促进盐类的水解。
3.加酸或碱:H+可抑制阳离子水解,促进阴离子水解;OH-能促进阳离子水解,抑制阴离子水解。
三、盐类的水解溶液中存在的三个守恒规律
1.电荷守恒规律
2.物料守恒规律
3.质子守恒规律
四、盐类的水解溶液中溶液中离子浓度的大小比较
规律:先定物质的量,再看水解(或电离)的程度,最后定溶液的酸碱性。
1.溶液中各粒子的等量关系
满足电荷守恒和物料守恒,在可由两种关系引申出一系列不同的关系式。
2.溶液中各粒子的大小关系
① 水解生成的离子浓度要比水解的离子剩余的浓度小。
② 酸性溶液c(H+)> c(OH-) 碱性溶液c(H+)< c(OH-)
3 多元弱酸的酸根或多元弱碱的阳离子都是分步水解,但以第一步水解位主。
4 弱酸式盐要考虑酸根的水解和电离两种趋势,并比较大小。如HSO3—、H2PO4—是电离程度大于水解程度,而其它弱酸的酸根都是电离程度小于水解程度,如HCO3—、HPO42—等
5 混合溶液要首先分析相互间反应是是否有弱酸(或弱碱)剩余,虽然生成的盐的水解也要考虑,但剩余弱酸(或弱碱)的电离占主导地位。
五、盐类水解的利用
注意:1.某些活泼金属、氧化物、氢氧化物与强酸弱碱盐反应时,要考虑盐的水解。
2.蒸干盐的溶液时,要考虑盐类水解平衡的移动。
3.贮存某些盐的溶液时候,也要考虑滩的水解。
小结:
作业布置:
教学反思:
+
PAGE
第3页 共5页
教学目标:
1.使学生理解盐类水解的实质,掌握水解的规律,能初步根据盐的组成判断盐溶液的酸碱性。
2.使学生初步掌握水解离子方程式的书写。
3.能够利用物料守恒、电荷守恒、质子守恒等知识分析盐溶液的组成及性质。
教学重点:
1.盐类水解的本质
2.盐类水解方程式的书写
3.物料守恒、电荷守恒、质子守恒
4. 溶液中离子浓度大小的判断
教学难点:
1. 物料守恒、电荷守恒、质子守恒
2. 溶液中离子浓度大小的判断
教学过程:
一、盐类的水解
酸+碱=盐+水(中和反应,可以理解盐可以由相应的酸和碱反应生成)
酸的溶液显酸性,碱的溶液显碱性,那么酸与碱反应生成的盐,溶液显什么性?(溶液的酸碱性取决于H+与OH-浓度的相对大小)
[实验3-1]:略
分析CH3COONa水解
CH3COONa 溶于水时,溶液中存在两种电离:
CH3COONa = CH3COO-+Na+
H2O H+ +OH-
CH3COOH
CH3COO-+H2O CH3COOH+OH-
(一)盐类的水解
1.定义:在溶液中盐电离出来的离子跟水所电离出来的H+ 或OH-结合成弱电解质的反应叫盐类的水解。
练习册P146示例1
2.本质:盐中的离子使水的电离平衡发生了移动。
3.特点:盐类的水解是中和反应的逆反应,是可逆反应。
4.类型:
(1)强酸强碱盐
如KNO3、 Na2SO4 不水解,溶液成中性,原因是强酸强碱盐电离出的阴离子、阳离子都不与水电离出的氢离子或氢氧根离子结合生成弱电解质,所以,溶液中盐电离的阳离子、阴离子和氢离子、氢氧根离子的数目都保持不变,没有破坏水的电离平衡,氢离子浓度等于氢氧根离子浓度,显中性。
(2)强酸弱碱盐
如Al 2(SO4)3 NH4NO3水解之后溶液成酸性,原因是弱碱的阳离子结合水电离的OH-,使H+浓度增大,使溶液成酸性。
(3)强碱弱酸盐
如NaClO K2CO3水解之后溶液成碱性,原因是弱酸的阴离子结合水电离的H+使OH-浓度增大,使溶液成碱性。
(4)弱酸酸式盐
溶液酸碱性取决于酸根离子的水解和电离的相对大小
1 若电离程度大于水解程度,溶液成酸性,如NaHSO3、NaH2PO4等
2 若电离程度小于水解程度,溶液成碱性,如NaHCO3、Na2HPO4等
(5)弱酸弱碱盐
弱酸弱碱盐的水解叫做双水解,即该盐的阴阳离子都发生水解,而且可以互相促进,使水解程度变大。弱酸弱碱盐中的阳离子可以结合水电离出来的氢氧根离子反应产生对应的弱碱,而酸根离子可以结合水电离出来的氢离子反应产生对应的弱酸。
若盐水解之后生成的酸和碱的酸碱性相对较强,那么双水解才能进行彻底,如Al3+与HCO3- CO32— S2—; Fe3+与CO32— AlO2—否则不能进行彻底,如CH3COONH4 (练习册P152 表)
5.规律
谁弱谁水解,谁强显谁性,越弱越水解,都弱都水解,都强显中性。
练习册P146 课堂练习5题 课后作业5题
(二)盐类的水解方程式的书写
1.找出发生水解的离子,直接写出水解的离子方程式。
2.水解是可逆反应,一般用“ ”连接,只有双水解彻底时用“=”连接。
3.不写“↑”、“↓”及分解形式;只有双水解彻底时双水解时写“↑”、“↓”。
4.多元弱酸根阴离子的水解要分步写,且以第一步水解为主,如CO32-:
第一步:CO32-+H2O HCO3-+OH-
第二步:HCO3-+H2O H2CO3+OH-
5.多元弱碱根阳离子的水解多步并为一步写,
如Fe3+:Fe3++3H2O Fe(OH)3 +3H+
6.水解方程式要符合电荷守恒。
练习册P146跟踪练习2
二、盐类的水解平衡
(一)盐类的水解平衡
实质上是化学平衡
(二)影响盐类水解平衡的因素
1.温度
因为是中和反应的逆反应,而中和反应为放热反应,所以水解反应是吸热反应。升高温度,有利于促进水解。
2.浓度
溶液浓度越小,实际上是增加了水的量,可使平衡相正反应方向移动,使盐的水解程度增大(最好用勒沙特例原理中浓度同时减小的原理来解释)。所以稀释能促进盐类的水解。
练习册P147 4题
3.加酸或碱
H+可抑制阳离子水解,促进阴离子水解;OH-能促进阳离子水解,抑制阴离子水解。
练习册P148 Fe3++3H2O Fe(OH)3 +3H+ 的相关表格
三、盐类的水解溶液中存在的三个守恒规律
1.电荷守恒规律:电解质溶液中,无论存在多少种离子,溶液总是呈电中性,即阴离子所带负电荷总数一定等于阳离子所带正电荷总数,即盐溶液中阴、阳离子所带的电荷总数相等。
如:①NH4Cl溶液中阳离子有NH4+ ,根据电荷守恒原理有:c(NH4+)+c(H+)=c(Cl-)+c(OH-);
②Na2CO3溶液中阳离子有Na+和H+ ,阴离子有 OH-,HCO3-,CO32-,根据电荷守恒原理有:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)。
2.物料守恒规律:电解质溶液中,由于某些离子能水解或电离,导致离子种类增多,但某些关键性的原子总是守恒的,即某元素各种不同存在形态的微粒物质的量总和不变。
如:①0.1mol/L NH4Cl溶液中:
c(NH4+)+c(NH3 H2O)=0.1mol/L=c(Cl-);
②0.1mol/LNa2CO3溶液中:
2[c(CO32-)+c(HCO3-)+c(H2CO3)]=0.1mol/L= c(Na+)
3.质子守恒规律:水电离出的H+ 数与OH- 数守恒:是依据水电离反应
H2O H+ + OH-,水电离产生的H+ 和OH- 的物质的量总是相等的,无论在溶液中该H+ 和OH- 以什么形式存在。
如:①NH4Cl溶液中:c(H+) = c(OH-) + c(NH3 H2O);
②Na2CO3溶液中:c(OH-) = c(H+) + c(HCO3-) + 2c(H2CO3)。
简单判断方法:先正确写出该溶液的电荷平衡式和物料平衡式,然后联立该两平衡式,消去该电解质在溶液中电离的离子。
如Na2CO3溶液:
电荷守恒:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)
物料守恒:2[c(CO32-)+c(HCO3-)+c(H2CO3)]=0.1mol/L= c(Na+)
然后消去Na+ 可得c(OH-) = c(H+) + c(HCO3-) + 2c(H2CO3)
练习册P150 课后作业5题
四、盐类的水解溶液中溶液中离子浓度的大小比较
规律:先定物质的量,再看水解(或电离)的程度,最后定溶液的酸碱性。
练习册P149 示例3,P150课堂练习5题, P154 示例4
1. 溶液中各粒子的等量关系
满足电荷守恒和物料守恒,在可由两种关系引申出一系列不同的关系式。
2. 溶液中各粒子的大小关系
1 水解生成的离子浓度要比水解的离子剩余的浓度小。
2 酸性溶液c(H+)> c(OH-) 碱性溶液c(H+)< c(OH-)
3 多元弱酸的酸根或多元弱碱的阳离子都是分步水解,但以第一步水解位主。
例如:Na2CO3溶液 c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+)
4 弱酸式盐要考虑酸根的水解和电离两种趋势,并比较大小
如HSO3—、H2PO4—是电离程度大于水解程度,而其它弱酸的酸根都是电离程度小于水解程度,如HCO3—、HPO42—等
例如:NaHCO3溶液 c(Na+)> c(HCO3-)>c(OH-)>c(H+)c(CO32-)
5 混合溶液要首先分析相互间反应是是否有弱酸(或弱碱)剩余,虽然生成的盐的水解也要考虑,但剩余弱酸(或弱碱)的电离占主导地位。
例如:0.4mol/L的NH3·H2O溶液和0.2mol/L的HCl溶液等体积混合,混合之后离子浓度的大小顺序为:c(NH4+)>c(Cl-)c(OH-)> c(H+)
五、盐类水解的利用(练习册P148)
注意:1.某些活泼金属、氧化物、氢氧化物与强酸弱碱盐反应时,要考虑盐的水解。
2.蒸干盐的溶液时,要考虑盐类水解平衡的移动。
3.贮存某些盐的溶液时候,也要考虑滩的水解。
练习册P149 示例2
板书设计:
第三节 盐类的水解
一、盐类的水解
(一)盐类的水解
1.定义:在溶液中盐电离出来的离子跟水所电离出来的H+或OH-结合成弱电解质的反应叫盐类的水解。
2.本质:盐中的离子使水的电离平衡发生了移动。
3.特点:盐类的水解是中和反应的逆反应,是可逆反应。
4.类型:
(1)强酸强碱盐显中性。
(2)强酸弱碱盐显酸性。
(3)强碱弱酸盐显碱性。
(4)弱酸酸式盐:溶液酸碱性取决于酸根离子的水解和电离的相对大小
①若电离程度大于水解程度,溶液成酸性,如NaHSO3、NaH2PO4等
②若电离程度小于水解程度,溶液成碱性,如NaHCO3、Na2HPO4等
(5)弱酸弱碱盐
弱酸弱碱盐的水解叫做双水解,即该盐的阴阳离子都发生水解,而且可以互相促进,使水解程度变大。弱酸弱碱盐中的金属离子可以结合水电离出来的氢氧根离子反应产生对应的弱碱,而酸根离子可以结合水电离出来的氢离子反应产生对应的弱酸。
若盐水解之后生成的酸和碱的酸碱性相对较强,那么双水解才能进行彻底,如Al3+与HCO3- CO32— S2—; Fe3+与CO32— AlO2—否则不能进行彻底,如CH3COO—与NH4+
5.规律
谁弱谁水解,谁强显谁性,越弱越水解,都弱都水解,都强显中性。
(二)盐类的水解方程式的书写
1.找出发生水解的离子,直接写出水解的离子方程式。
2.水解是可逆反应,一般用“ ”连接,只有双水解彻底时用“=”连接。
3.不写“↑”、“↓”及分解形式;只有双水解彻底时写“↑”、“↓”。
4.多元弱酸根阴离子的水解要分步写,且以第一步水解为主,如CO32-:
第一步:CO32-+H2O HCO3-+OH-
第二步:HCO3-+H2O H2CO3+OH-
5.多元弱碱根阳离子的水解多步并为一步写,如Fe3+:
Fe3++3H2O Fe(OH)3 +3H+
6.水解方程式要符合电荷守恒。
二、盐类的水解平衡
(一)盐类的水解平衡
(二)影响盐类水解平衡的因素
1.温度:升高温度,有利于促进水解。
2.浓度:稀释能促进盐类的水解。
3.加酸或碱:H+可抑制阳离子水解,促进阴离子水解;OH-能促进阳离子水解,抑制阴离子水解。
三、盐类的水解溶液中存在的三个守恒规律
1.电荷守恒规律
2.物料守恒规律
3.质子守恒规律
四、盐类的水解溶液中溶液中离子浓度的大小比较
规律:先定物质的量,再看水解(或电离)的程度,最后定溶液的酸碱性。
1.溶液中各粒子的等量关系
满足电荷守恒和物料守恒,在可由两种关系引申出一系列不同的关系式。
2.溶液中各粒子的大小关系
① 水解生成的离子浓度要比水解的离子剩余的浓度小。
② 酸性溶液c(H+)> c(OH-) 碱性溶液c(H+)< c(OH-)
3 多元弱酸的酸根或多元弱碱的阳离子都是分步水解,但以第一步水解位主。
4 弱酸式盐要考虑酸根的水解和电离两种趋势,并比较大小。如HSO3—、H2PO4—是电离程度大于水解程度,而其它弱酸的酸根都是电离程度小于水解程度,如HCO3—、HPO42—等
5 混合溶液要首先分析相互间反应是是否有弱酸(或弱碱)剩余,虽然生成的盐的水解也要考虑,但剩余弱酸(或弱碱)的电离占主导地位。
五、盐类水解的利用
注意:1.某些活泼金属、氧化物、氢氧化物与强酸弱碱盐反应时,要考虑盐的水解。
2.蒸干盐的溶液时,要考虑盐类水解平衡的移动。
3.贮存某些盐的溶液时候,也要考虑滩的水解。
小结:
作业布置:
教学反思:
+
PAGE
第3页 共5页
