复习讲义专题一《化学家眼中的物质世界》
图片预览


文档简介
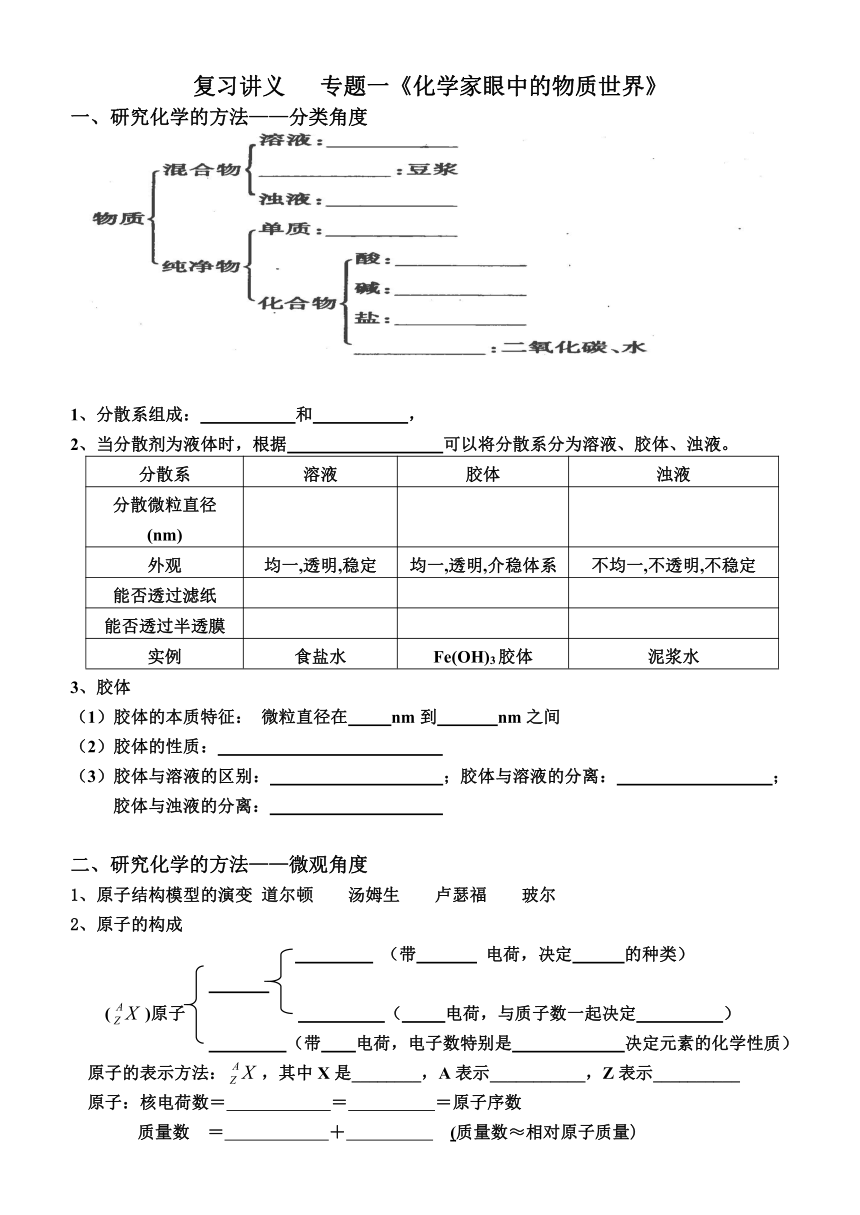
复习讲义 专题一《化学家眼中的物质世界》
一、研究化学的方法——分类角度
1、分散系组成: 和 ,
2、当分散剂为液体时,根据 可以将分散系分为溶液、胶体、浊液。
分散系 溶液 胶体 浊液
分散微粒直径(nm)
外观 均一,透明,稳定 均一,透明,介稳体系 不均一,不透明,不稳定
能否透过滤纸
能否透过半透膜
实例 食盐水 Fe(OH)3胶体 泥浆水
3、胶体
(1)胶体的本质特征: 微粒直径在 nm到 nm之间
(2)胶体的性质:
(3)胶体与溶液的区别: ;胶体与溶液的分离: ;
胶体与浊液的分离:
二、研究化学的方法——微观角度
1、原子结构模型的演变 道尔顿 汤姆生 卢瑟福 玻尔
2、原子的构成
(带 电荷,决定 的种类)
()原子 ( 电荷,与质子数一起决定 )
(带 电荷,电子数特别是 决定元素的化学性质)
原子的表示方法:,其中X是________,A表示___________,Z表示__________
原子:核电荷数= = =原子序数
质量数 = + (质量数≈相对原子质量)
阳离子:(aAm+) 核外电子数=质子数 - 所带电荷数,即核外电子数=
阴离子:(bBn-) 核外电子数=质子数 + 所带电荷数,即核外电子数=
3、原子结构示意图与离子结构示意图
①掌握1-18号元素原子核外电子排布示意图
②画出Na+、Cl-、Mg2+、O2-的结构示意图
4、同位素:
⑴概念:同位素是 相同 不同的原子,举例:
(要点)两同: 相同,同种元素;两不同: 不同,不同原子
⑵核素: 。
注意:同一元素的各核素的质量数不同,核外电子数相同,化学性质 ,
物理性质 。
5、一些规律
⑴原子核外电子是 排布的
⑵化学反应中,原子核不发生变化,但原子的 发生变化,元素的化学性质主要决定于原子结构中的 。
⑶金属元素的原子最外层一般 个电子,在化学反应中易 电子形成与稀有气体原子电子层排布相同的阳离子(稳定结构);非金属元素的原子最外层一般 个电子,在化学反应中易 电子形成与稀有气体原子电子层排布相同的阴离子(稳定结构)
⑷元素化合价得失电子数目的关系
①金属元素一般为 化合价, 电子的数目即为化合价的数值,如Na、K失去最外层1个电子均为 价,Mg、Ca失去最外层2个电子均为 价,Al失去最外层3个电子均为 价。
②非金属元素既可以为正化合价也可以为负化合价,活泼非金属元素的最低负化合价的数值即为 电子的数目。如:F、Cl易得到1个电子,最低化合价均
为 价;O、S易得到2个电子,最低体例价均为 价。
三、物质的量
三、研究化学的方法——反应角度
㈠、从反应物与生成物的特点分:四种基本反应类型 、 、
、
㈡、从化合价有无变化分: 反应与 反应
氧化还原反应
1、本质: (包括电子的得失或偏移)。
2、特征:有元素 。
3、判断氧化还原反应的依据:凡是有 化学反应都属于氧化还原反应。
氧化还原反应与四种基本反应类型的关系:
4、氧化还原反应相关概念:
①升 ——→ 失 ——→ 氧 ——→ 还;
即: 升高 → 失 → 被 或发生 反应 → 作 剂(具有 性)
→ 生成氧化产物
②降 ——→ 得 ——→ 还 ——→ 氧;
★ (注:一定要熟记以上内容,以便能正确判断出一个氧化还原反应中的氧化剂、还原剂、氧化产物和还原产物;氧化剂、还原剂在反应物中找;氧化产物和还原产物在生成物中找。
5、表示方法:双线桥
MnO2 + 4HCl(浓) = MnCl2 + Cl2↑+ 2H2O
6、氧化还原反应的基本规律
守恒律:化合价 总数与 总数相等,即 电子总数与 电子总数相等
7、氧化性、还原性强弱的判断
⑴根据氧化还原反应方程式在同一氧化还原反应中:
氧化性: > 还原性: >
[练习]已知,(1)2FeCl3+2KI=2FeCl2+2KCl+I2;(2)2FeCl2+Cl2=2FeCl3,据此可判断各物质的氧化性由强到弱的顺序是( )
A. FeCl3>Cl2>I2 B. Cl2>FeCl3>I2 C. I2>Cl2>FeCl3 D. Cl2>I2>FeCl3
⑵根据金属活动顺序表
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag
对应的阳离子:
⑶根据化合价:元素处于最高价,只有 ;元素处于最低价,只有 ;
元素处于中间价,有 。
㈢、从有无离子参加分: 反应与 反应
⒈电解质和非电解质
电解质: 。
⑴化合物
非电解质: 。
(如:酒精[乙醇]、蔗糖、SO2、SO3、NH3、CO2等是 。)
①电解质和非电解质都是 ,单质和混合物既不是电解质也不是非电解质。
②酸、碱、盐和水都是
③能导电的物质不一定是电解质.能导电的物质:电解质溶液、熔融的碱和盐、金属单质和石墨
★ 电解质需在水溶液里或熔融状态下才能导电。固态电解质(如:NaCl晶体)不导电,
液态酸(如:液态HCl)不导电。
2、溶液能够导电的原因:有能够 。
3、电离方程式:要注意配平,原子个数守恒,电荷数守恒。Al2(SO4)3 =
4、离子反应:
⑴离子反应发生的条件:
①复分解型离子反应发生条件: 、 、 (如水、弱酸、弱碱)
②氧化还原型离子反应发生条件:离子的价态发生变化。(如Fe放入FeCl3溶液中发生反应的离子方程式为: )
⑵离子方程式的书写:(写、拆、删、查)
①写:写出正确的化学方程式。(要注意配平。)
②拆:把 , 的物质写成离子形式。
★ 常见易溶于水易电离的物质:三大强酸( ),三大强碱( ),可溶性盐,这些物质拆成离子形式,其他物质一律保留化学式。
③删: (价态不变和存在形式不变的离子)
④查:检查书写离子方程式等式两边是否 守恒、 守恒。
★⑶离子方程式正误判断:(4“看”)
①看是否符合反应事实(能不能发生反应,反应物、生成物对不对)。
②看是否可拆。
③看是否配平(原子个数守恒,电荷数守恒)。
④看“=”“ ”“↑”“↓”是否应用恰当。
★⑷离子共存问题
①由于发生复分解反应(生成沉淀或气体或水或难电离物)的离子不能大量共存。
生成沉淀:AgCl、BaSO4、BaCO3、CaCO3、Mg(OH)2、Al(OH)3、Fe(OH)3、Cu(OH)2等。
生成气体:CO32-、HCO3-、SO32-、H2SO3-、等易挥发的弱酸的酸根与H+不能大量共存。
生成难电离物:①H+和OH-生成H2O。
②CH 3COO-和H+生成CH3COOH(弱酸)、H+和ClO-生成HClO(弱酸)、
NH4+和OH-生成NH3·H2O(弱碱)等。
③酸式酸根离子如HCO3-、HSO3-等既不能和H+共存,也不能和OH-共存。如:HCO3-+H+= , HCO3-+OH-=
②审题时应注意题中给出的附加条件。
A、无色溶液中不存在有色离子: 、 、 、 (常见这四种有色离子)。
B、挖掘某些隐含离子:酸性溶液(或PH<7)中隐含有 ,碱性溶液(或PH>7)中隐含有 。
C、注意题目要求“大量共存”还是“不能大量共存”。
四、研究化学的方法——实验
1、固体物质常用分离方法
分离和提纯的方法 分离的物质 仪器 应注意的事项 应用举例
过滤 用于固液混合的分离 漏斗、铁架台、玻璃棒、酒精灯、烧杯 一贴、二低、三靠 如粗盐的提纯
蒸发结晶 用来分离和提纯可溶性固体 蒸发皿、酒精灯、三脚架、玻璃棒、坩埚钳 加热蒸发皿使溶液蒸发时,要用玻璃棒不断搅动溶液;当蒸发皿中出现较多的固体时,即停止加热 分离NaCl和水混合物
冷却热饱和溶液结晶 溶解度受温度较大的物质,冷却热饱和溶液后,溶质结晶析出 烧杯、玻璃棒、过滤器 KNO3溶解度受温度较大的物质较多时用这种方法 分离NaCl和KNO3混合物
2、液体物质常用分离方法
蒸馏 提纯或分离沸点不同的互溶液体混合物(通常沸点需相差30℃以上) 蒸馏烧瓶、温度计、酒精灯、石棉网、冷凝管、尾接管、锥形瓶 防止液体暴沸加沸石,温度计水银球应在蒸馏烧瓶支管口附近,如石油的蒸馏中冷凝管中水下进上出 如石油的蒸馏
萃取 利用溶质在互不相溶的溶剂里的溶解度不同,用一种溶剂把溶质从它与另一种溶剂所组成的溶液中提取出来的方法 分液漏斗 选择的萃取剂应符合下列要求:和原溶液中的溶剂互不相溶;对溶质的溶解度要远大于原溶剂(如:酒精、四氯化碳、苯等) 用四氯化碳萃取溴水里的溴、碘
分液 分离互不相溶的液体 分液漏斗 打开上端活塞使漏斗内外空气相通。打开活塞,使下层液体慢慢流出,及时关闭活塞,上层液体由上端倒出 如用四氯化碳萃取溴水里的溴、碘后再分液
3、气体物质常用分离方法:洗气
4、离子检验法
(1)常见的离子检验:NH4+、、Cl-、SO42-、 CO32-
对于简答题的答题套路:一 写操作步骤,二 写实验现象,三 写结论。
(2)焰色反应法:属 变化
钠: 色、 钾: 色(透过 )。注:实验后,要用 洗净铂丝
例1、写出下列各组混合物分离时所需分离方法或实验步骤的名称:
(1)泥沙与水 ,(2)混入泥沙的食盐
(3)汽油与水 ,(4)水与乙醇 ,(5)水和食盐 ,
(6)氯化钠和硝酸钾
_________
______________
_________
_________
一、研究化学的方法——分类角度
1、分散系组成: 和 ,
2、当分散剂为液体时,根据 可以将分散系分为溶液、胶体、浊液。
分散系 溶液 胶体 浊液
分散微粒直径(nm)
外观 均一,透明,稳定 均一,透明,介稳体系 不均一,不透明,不稳定
能否透过滤纸
能否透过半透膜
实例 食盐水 Fe(OH)3胶体 泥浆水
3、胶体
(1)胶体的本质特征: 微粒直径在 nm到 nm之间
(2)胶体的性质:
(3)胶体与溶液的区别: ;胶体与溶液的分离: ;
胶体与浊液的分离:
二、研究化学的方法——微观角度
1、原子结构模型的演变 道尔顿 汤姆生 卢瑟福 玻尔
2、原子的构成
(带 电荷,决定 的种类)
()原子 ( 电荷,与质子数一起决定 )
(带 电荷,电子数特别是 决定元素的化学性质)
原子的表示方法:,其中X是________,A表示___________,Z表示__________
原子:核电荷数= = =原子序数
质量数 = + (质量数≈相对原子质量)
阳离子:(aAm+) 核外电子数=质子数 - 所带电荷数,即核外电子数=
阴离子:(bBn-) 核外电子数=质子数 + 所带电荷数,即核外电子数=
3、原子结构示意图与离子结构示意图
①掌握1-18号元素原子核外电子排布示意图
②画出Na+、Cl-、Mg2+、O2-的结构示意图
4、同位素:
⑴概念:同位素是 相同 不同的原子,举例:
(要点)两同: 相同,同种元素;两不同: 不同,不同原子
⑵核素: 。
注意:同一元素的各核素的质量数不同,核外电子数相同,化学性质 ,
物理性质 。
5、一些规律
⑴原子核外电子是 排布的
⑵化学反应中,原子核不发生变化,但原子的 发生变化,元素的化学性质主要决定于原子结构中的 。
⑶金属元素的原子最外层一般 个电子,在化学反应中易 电子形成与稀有气体原子电子层排布相同的阳离子(稳定结构);非金属元素的原子最外层一般 个电子,在化学反应中易 电子形成与稀有气体原子电子层排布相同的阴离子(稳定结构)
⑷元素化合价得失电子数目的关系
①金属元素一般为 化合价, 电子的数目即为化合价的数值,如Na、K失去最外层1个电子均为 价,Mg、Ca失去最外层2个电子均为 价,Al失去最外层3个电子均为 价。
②非金属元素既可以为正化合价也可以为负化合价,活泼非金属元素的最低负化合价的数值即为 电子的数目。如:F、Cl易得到1个电子,最低化合价均
为 价;O、S易得到2个电子,最低体例价均为 价。
三、物质的量
三、研究化学的方法——反应角度
㈠、从反应物与生成物的特点分:四种基本反应类型 、 、
、
㈡、从化合价有无变化分: 反应与 反应
氧化还原反应
1、本质: (包括电子的得失或偏移)。
2、特征:有元素 。
3、判断氧化还原反应的依据:凡是有 化学反应都属于氧化还原反应。
氧化还原反应与四种基本反应类型的关系:
4、氧化还原反应相关概念:
①升 ——→ 失 ——→ 氧 ——→ 还;
即: 升高 → 失 → 被 或发生 反应 → 作 剂(具有 性)
→ 生成氧化产物
②降 ——→ 得 ——→ 还 ——→ 氧;
★ (注:一定要熟记以上内容,以便能正确判断出一个氧化还原反应中的氧化剂、还原剂、氧化产物和还原产物;氧化剂、还原剂在反应物中找;氧化产物和还原产物在生成物中找。
5、表示方法:双线桥
MnO2 + 4HCl(浓) = MnCl2 + Cl2↑+ 2H2O
6、氧化还原反应的基本规律
守恒律:化合价 总数与 总数相等,即 电子总数与 电子总数相等
7、氧化性、还原性强弱的判断
⑴根据氧化还原反应方程式在同一氧化还原反应中:
氧化性: > 还原性: >
[练习]已知,(1)2FeCl3+2KI=2FeCl2+2KCl+I2;(2)2FeCl2+Cl2=2FeCl3,据此可判断各物质的氧化性由强到弱的顺序是( )
A. FeCl3>Cl2>I2 B. Cl2>FeCl3>I2 C. I2>Cl2>FeCl3 D. Cl2>I2>FeCl3
⑵根据金属活动顺序表
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag
对应的阳离子:
⑶根据化合价:元素处于最高价,只有 ;元素处于最低价,只有 ;
元素处于中间价,有 。
㈢、从有无离子参加分: 反应与 反应
⒈电解质和非电解质
电解质: 。
⑴化合物
非电解质: 。
(如:酒精[乙醇]、蔗糖、SO2、SO3、NH3、CO2等是 。)
①电解质和非电解质都是 ,单质和混合物既不是电解质也不是非电解质。
②酸、碱、盐和水都是
③能导电的物质不一定是电解质.能导电的物质:电解质溶液、熔融的碱和盐、金属单质和石墨
★ 电解质需在水溶液里或熔融状态下才能导电。固态电解质(如:NaCl晶体)不导电,
液态酸(如:液态HCl)不导电。
2、溶液能够导电的原因:有能够 。
3、电离方程式:要注意配平,原子个数守恒,电荷数守恒。Al2(SO4)3 =
4、离子反应:
⑴离子反应发生的条件:
①复分解型离子反应发生条件: 、 、 (如水、弱酸、弱碱)
②氧化还原型离子反应发生条件:离子的价态发生变化。(如Fe放入FeCl3溶液中发生反应的离子方程式为: )
⑵离子方程式的书写:(写、拆、删、查)
①写:写出正确的化学方程式。(要注意配平。)
②拆:把 , 的物质写成离子形式。
★ 常见易溶于水易电离的物质:三大强酸( ),三大强碱( ),可溶性盐,这些物质拆成离子形式,其他物质一律保留化学式。
③删: (价态不变和存在形式不变的离子)
④查:检查书写离子方程式等式两边是否 守恒、 守恒。
★⑶离子方程式正误判断:(4“看”)
①看是否符合反应事实(能不能发生反应,反应物、生成物对不对)。
②看是否可拆。
③看是否配平(原子个数守恒,电荷数守恒)。
④看“=”“ ”“↑”“↓”是否应用恰当。
★⑷离子共存问题
①由于发生复分解反应(生成沉淀或气体或水或难电离物)的离子不能大量共存。
生成沉淀:AgCl、BaSO4、BaCO3、CaCO3、Mg(OH)2、Al(OH)3、Fe(OH)3、Cu(OH)2等。
生成气体:CO32-、HCO3-、SO32-、H2SO3-、等易挥发的弱酸的酸根与H+不能大量共存。
生成难电离物:①H+和OH-生成H2O。
②CH 3COO-和H+生成CH3COOH(弱酸)、H+和ClO-生成HClO(弱酸)、
NH4+和OH-生成NH3·H2O(弱碱)等。
③酸式酸根离子如HCO3-、HSO3-等既不能和H+共存,也不能和OH-共存。如:HCO3-+H+= , HCO3-+OH-=
②审题时应注意题中给出的附加条件。
A、无色溶液中不存在有色离子: 、 、 、 (常见这四种有色离子)。
B、挖掘某些隐含离子:酸性溶液(或PH<7)中隐含有 ,碱性溶液(或PH>7)中隐含有 。
C、注意题目要求“大量共存”还是“不能大量共存”。
四、研究化学的方法——实验
1、固体物质常用分离方法
分离和提纯的方法 分离的物质 仪器 应注意的事项 应用举例
过滤 用于固液混合的分离 漏斗、铁架台、玻璃棒、酒精灯、烧杯 一贴、二低、三靠 如粗盐的提纯
蒸发结晶 用来分离和提纯可溶性固体 蒸发皿、酒精灯、三脚架、玻璃棒、坩埚钳 加热蒸发皿使溶液蒸发时,要用玻璃棒不断搅动溶液;当蒸发皿中出现较多的固体时,即停止加热 分离NaCl和水混合物
冷却热饱和溶液结晶 溶解度受温度较大的物质,冷却热饱和溶液后,溶质结晶析出 烧杯、玻璃棒、过滤器 KNO3溶解度受温度较大的物质较多时用这种方法 分离NaCl和KNO3混合物
2、液体物质常用分离方法
蒸馏 提纯或分离沸点不同的互溶液体混合物(通常沸点需相差30℃以上) 蒸馏烧瓶、温度计、酒精灯、石棉网、冷凝管、尾接管、锥形瓶 防止液体暴沸加沸石,温度计水银球应在蒸馏烧瓶支管口附近,如石油的蒸馏中冷凝管中水下进上出 如石油的蒸馏
萃取 利用溶质在互不相溶的溶剂里的溶解度不同,用一种溶剂把溶质从它与另一种溶剂所组成的溶液中提取出来的方法 分液漏斗 选择的萃取剂应符合下列要求:和原溶液中的溶剂互不相溶;对溶质的溶解度要远大于原溶剂(如:酒精、四氯化碳、苯等) 用四氯化碳萃取溴水里的溴、碘
分液 分离互不相溶的液体 分液漏斗 打开上端活塞使漏斗内外空气相通。打开活塞,使下层液体慢慢流出,及时关闭活塞,上层液体由上端倒出 如用四氯化碳萃取溴水里的溴、碘后再分液
3、气体物质常用分离方法:洗气
4、离子检验法
(1)常见的离子检验:NH4+、、Cl-、SO42-、 CO32-
对于简答题的答题套路:一 写操作步骤,二 写实验现象,三 写结论。
(2)焰色反应法:属 变化
钠: 色、 钾: 色(透过 )。注:实验后,要用 洗净铂丝
例1、写出下列各组混合物分离时所需分离方法或实验步骤的名称:
(1)泥沙与水 ,(2)混入泥沙的食盐
(3)汽油与水 ,(4)水与乙醇 ,(5)水和食盐 ,
(6)氯化钠和硝酸钾
_________
______________
_________
_________
