硫和含硫化合物的相互转化
图片预览




文档简介
课件26张PPT。硫和含硫化合物的
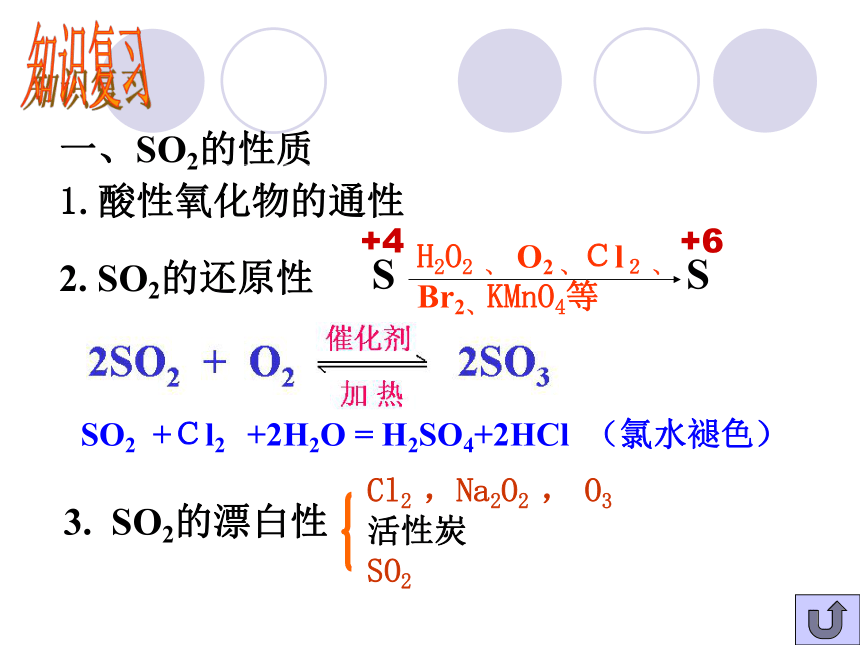
相互转化 知识复习一、SO2的性质1.酸性氧化物的通性2. SO2的还原性3. SO2的漂白性+4 +6 S SH2O2 、 O2 、Cl2 、
Br2、KMnO4等SO2 +Cl2 +2H2O = H2SO4+2HCl (氯水褪色)Cl2 ,Na2O2 , O3
活性炭
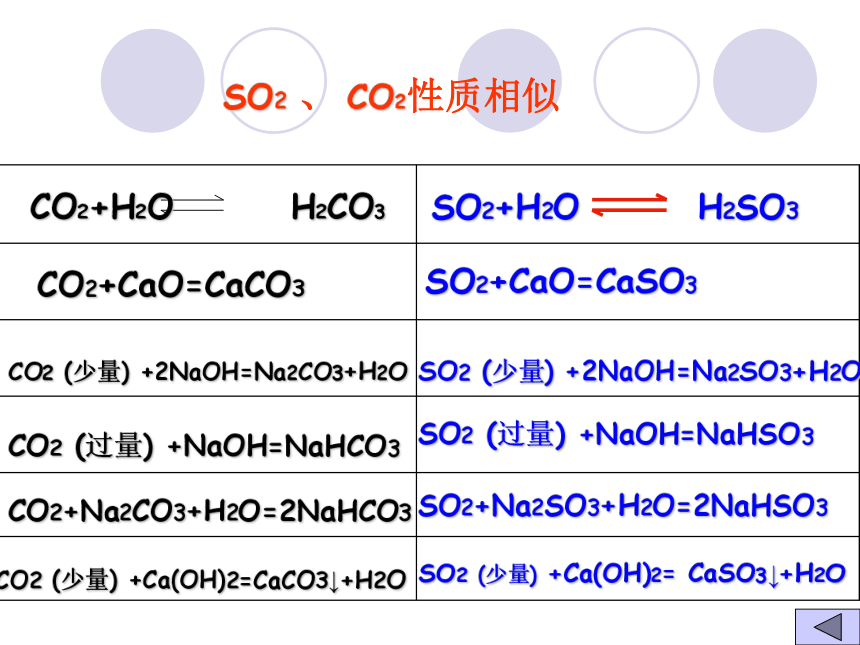
SO2CO2+CaO=CaCO3CO2 (少量) +2NaOH=Na2CO3+H2OCO2+Na2CO3+H2O=2NaHCO3CO2 (过量) +NaOH=NaHCO3CO2 (少量) +Ca(OH)2=CaCO3↓+H2O
SO2+CaO=CaSO3
SO2 (少量) +2NaOH=Na2SO3+H2OSO2+Na2SO3+H2O=2NaHSO3
SO2 (过量) +NaOH=NaHSO3SO2 (少量) +Ca(OH)2= CaSO3↓+H2O SO2 、 CO2性质相似1、稀硫酸具有酸的通性:⑴可以使紫色石蕊试液
⑷与碱反应:⑵与金属反应:⑸与某些盐反应:⑶与金属氧化物:变红Fe + 2H+ == Fe2+ + H2
CuO + 2H+==Cu2+ + H2OCu(OH)2+2H+==Cu2++2H2O Ba2++SO42- == BaSO4H2SO4=2H++SO42-二、硫酸的性质知识复习2、硫酸的物理性质 稀硫酸: 具有酸的通性 (1)无色、油状液体(2)易溶于水,能以任意比与水混溶 浓硫酸:(3)难挥发性
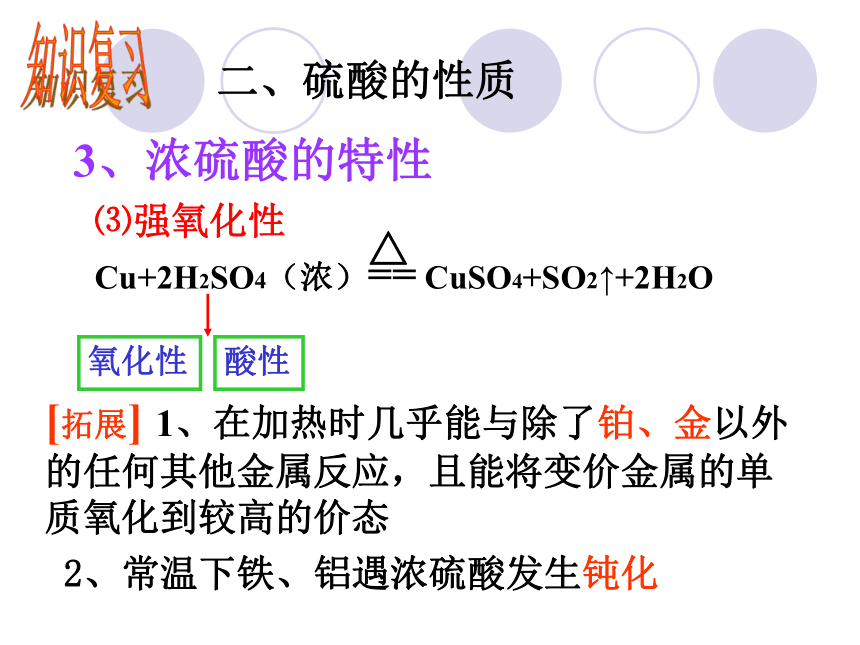
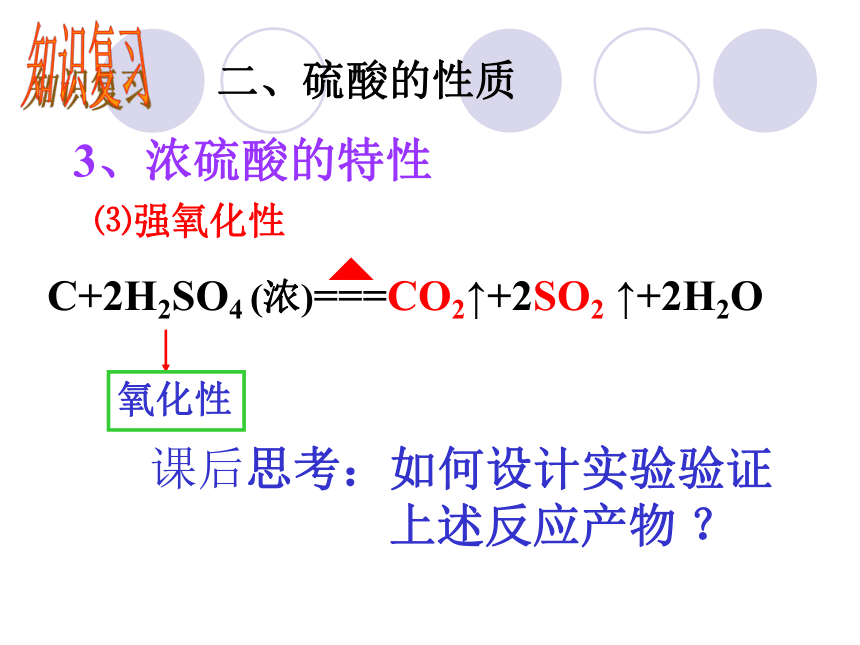
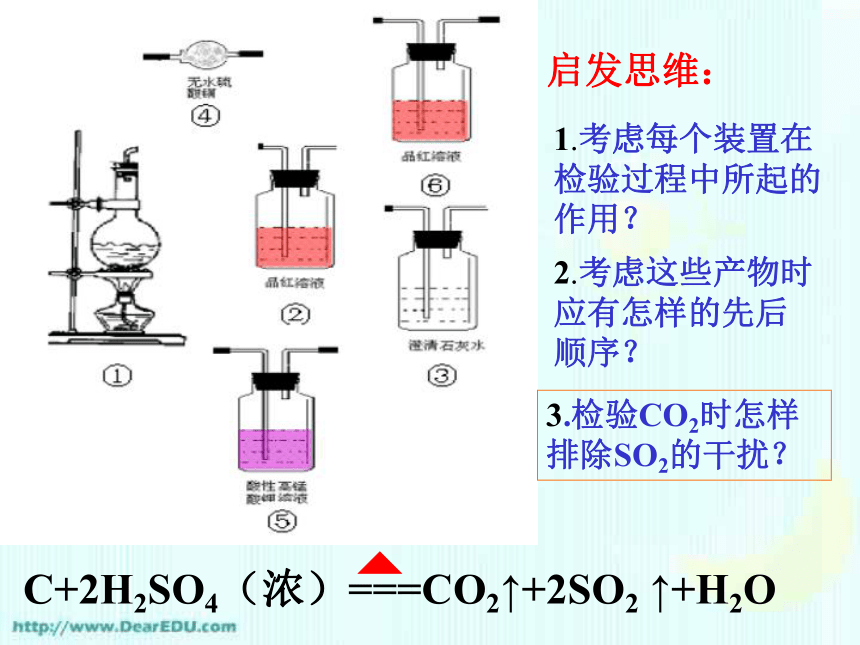
(4)密度大于水;具有一些特性 硫酸溶液知识复习二、硫酸的性质知识复习二、硫酸的性质3、浓硫酸的特性 —吸水性是指物质中本身就存有水,浓硫酸直接与水分子结合 —浓硫酸将有机物中的氢、氧元素按水的比例脱去。⑴吸水性⑵脱水性知识复习二、硫酸的性质3、浓硫酸的特性⑶强氧化性Cu+2H2SO4(浓)== CuSO4+SO2↑+2H2O△[拓展] 1、在加热时几乎能与除了铂、金以外的任何其他金属反应,且能将变价金属的单质氧化到较高的价态 2、常温下铁、铝遇浓硫酸发生钝化氧化性酸性知识复习二、硫酸的性质3、浓硫酸的特性⑶强氧化性C+2H2SO4 (浓)===CO2↑+2SO2 ↑+2H2O氧化性 课后思考:如何设计实验验证
上述反应产物 ?启发思维:1.考虑每个装置在检验过程中所起的作用?2.考虑这些产物时应有怎样的先后顺序?3.检验CO2时怎样排除SO2的干扰?C+2H2SO4(浓)===CO2↑+2SO2 ↑+H2OC与浓硫酸反应产物的鉴别C+2H2SO4(浓)===CO2↑+2SO2 ↑+H2O[探索思考] 将足量锌粒放入浓硫酸中加热,在反应开始的一段时间内会产生H2吗?
随着反应的进行呢?试解释原因。Zn+H2SO4(稀)=ZnSO4+H2↑Zn+2H2SO4(浓)==ZnSO4+SO2↑+2H2O+6+4+10思考:比较稀、浓H2SO4的氧化性 +1
HH2SO2等较弱强 +6
S几种重要的硫酸盐CaSO4·2H2O 生石膏
2CaSO4·H2O 熟石膏
BaSO4 重晶石
CuSO4·5H2O 胆矾
FeSO4·7H2O 绿矾
KAl(SO4)2·12H2O 明矾
NaSO4·10H2O 芒硝三、硫单质的性质黄色或淡黄色固体、很脆不溶于水
微溶于酒精
易溶于CS2不高溶解性1、物理性质S + O2 = SO2点燃硫作还原剂H2 + S = H2S△硫作氧化剂三、硫单质的性质2、化学性质Hg+ S = Hg S除洒落在地面上的汞[讨论]硫和氯气都能分别与铁反应,试比较反应有何异同。结论:氯气的氧化性比硫强硫是氧化剂化合反应生成低价的金属硫化物+2氯气是氧化剂化合反应生成高价的金属氯化物+3硫元素的常见化合价S S S S-2 0 +4 +6 FeS
H2S
HgSSO2
H2SO3
Na2SO3SO3
H2SO4
Na2SO4
BaSO4S总结:S S S S-2 0 +4 +6 硫元素最高价(+6)只有______,最低价(-2)只具有_______ ;中间价(0、+4)既具有_______,又具有________。
使硫元素由高价态向低价态转化需要加入________,而硫元素低价态向高价态转化需要加入________。
氧化性还原性还原性氧化性氧化剂还原剂氧化剂氧化剂氧化剂还原剂还原剂还原剂氧化剂还原剂SFeSNa2SO4H2SO4SO3Na2SO3H2SO3SO2HgSH2S-2 0 +4 +6 含硫化合物的相互转化BaSO4NaOHO2 、CI2等OH-H2OH2OBaCl2O2O2H2SSO2
SO3H2SO3
H2SO4 S
H2S地下黄铁矿
FeS2雄黄
As4S4雌黄
As2S3辰砂
HgS地表石膏
CaSO4 ·2H2O芒硝
Na2SO4 ·10H2O自然界中不同价态硫元素间的转化SO42-的检验:方法:先加稀盐酸,再加氯化钡溶液。〖巩固练习〗如何鉴别失去标签的稀硫酸和浓硫酸?请同学们提出尽可能多的方案 1、下列转化需要加入氧化剂才能实现的是( )
A.H2S SO2 B. H2SO4 SO2
C.SO42- BaSO4 D. SO32- SO2
2、既有氧化性又有还原性的酸是( )
A. 碳酸 B. 亚硫酸
C. 硫酸 D. 高氯酸课堂练习AB3、已知下列氧化剂均能氧化+4价的硫元素,为了除去稀硫酸中混有的亚硫酸,应选用的最合理的氧化剂是( )
A. KMnO4 B. Ca(ClO)2 C. H2O2 D. Cl2
C二氧化硫?物理性质
SO2,无色有刺激性气味的气体,有毒,易液化,易溶于水(约1∶40)
由化合价推测化学性质:
SO2中的S为中间价态,通常反应中呈还原性.,有时也体现其氧化性.
实验室制取SO2 :
Na2SO3 + H2SO4(浓)= Na2SO4 + SO2↑+ H2O
二氧化硫的化学性质a. 强还原性
SO2+Cl2+H2O=2HCl+H2SO4( I2 、Br2)
b. 弱氧化性
2H2S+SO2=3S↓+2H2O
c. 酸性氧化物的通性
SO2 +H2O= H2SO3
SO2+2NaOH=Na2SO3+H2O
d. 漂白性(检验SO2方法)
能使品红溶液退色,加热沸腾溶液又变红色个本课时结束
再见!
Br2、KMnO4等SO2 +Cl2 +2H2O = H2SO4+2HCl (氯水褪色)Cl2 ,Na2O2 , O3
活性炭
SO2CO2+CaO=CaCO3CO2 (少量) +2NaOH=Na2CO3+H2OCO2+Na2CO3+H2O=2NaHCO3CO2 (过量) +NaOH=NaHCO3CO2 (少量) +Ca(OH)2=CaCO3↓+H2O
SO2+CaO=CaSO3
SO2 (少量) +2NaOH=Na2SO3+H2OSO2+Na2SO3+H2O=2NaHSO3
SO2 (过量) +NaOH=NaHSO3SO2 (少量) +Ca(OH)2= CaSO3↓+H2O SO2 、 CO2性质相似1、稀硫酸具有酸的通性:⑴可以使紫色石蕊试液
⑷与碱反应:⑵与金属反应:⑸与某些盐反应:⑶与金属氧化物:变红Fe + 2H+ == Fe2+ + H2
CuO + 2H+==Cu2+ + H2OCu(OH)2+2H+==Cu2++2H2O Ba2++SO42- == BaSO4H2SO4=2H++SO42-二、硫酸的性质知识复习2、硫酸的物理性质 稀硫酸: 具有酸的通性 (1)无色、油状液体(2)易溶于水,能以任意比与水混溶 浓硫酸:(3)难挥发性
(4)密度大于水;具有一些特性 硫酸溶液知识复习二、硫酸的性质知识复习二、硫酸的性质3、浓硫酸的特性 —吸水性是指物质中本身就存有水,浓硫酸直接与水分子结合 —浓硫酸将有机物中的氢、氧元素按水的比例脱去。⑴吸水性⑵脱水性知识复习二、硫酸的性质3、浓硫酸的特性⑶强氧化性Cu+2H2SO4(浓)== CuSO4+SO2↑+2H2O△[拓展] 1、在加热时几乎能与除了铂、金以外的任何其他金属反应,且能将变价金属的单质氧化到较高的价态 2、常温下铁、铝遇浓硫酸发生钝化氧化性酸性知识复习二、硫酸的性质3、浓硫酸的特性⑶强氧化性C+2H2SO4 (浓)===CO2↑+2SO2 ↑+2H2O氧化性 课后思考:如何设计实验验证
上述反应产物 ?启发思维:1.考虑每个装置在检验过程中所起的作用?2.考虑这些产物时应有怎样的先后顺序?3.检验CO2时怎样排除SO2的干扰?C+2H2SO4(浓)===CO2↑+2SO2 ↑+H2OC与浓硫酸反应产物的鉴别C+2H2SO4(浓)===CO2↑+2SO2 ↑+H2O[探索思考] 将足量锌粒放入浓硫酸中加热,在反应开始的一段时间内会产生H2吗?
随着反应的进行呢?试解释原因。Zn+H2SO4(稀)=ZnSO4+H2↑Zn+2H2SO4(浓)==ZnSO4+SO2↑+2H2O+6+4+10思考:比较稀、浓H2SO4的氧化性 +1
HH2SO2等较弱强 +6
S几种重要的硫酸盐CaSO4·2H2O 生石膏
2CaSO4·H2O 熟石膏
BaSO4 重晶石
CuSO4·5H2O 胆矾
FeSO4·7H2O 绿矾
KAl(SO4)2·12H2O 明矾
NaSO4·10H2O 芒硝三、硫单质的性质黄色或淡黄色固体、很脆不溶于水
微溶于酒精
易溶于CS2不高溶解性1、物理性质S + O2 = SO2点燃硫作还原剂H2 + S = H2S△硫作氧化剂三、硫单质的性质2、化学性质Hg+ S = Hg S除洒落在地面上的汞[讨论]硫和氯气都能分别与铁反应,试比较反应有何异同。结论:氯气的氧化性比硫强硫是氧化剂化合反应生成低价的金属硫化物+2氯气是氧化剂化合反应生成高价的金属氯化物+3硫元素的常见化合价S S S S-2 0 +4 +6 FeS
H2S
HgSSO2
H2SO3
Na2SO3SO3
H2SO4
Na2SO4
BaSO4S总结:S S S S-2 0 +4 +6 硫元素最高价(+6)只有______,最低价(-2)只具有_______ ;中间价(0、+4)既具有_______,又具有________。
使硫元素由高价态向低价态转化需要加入________,而硫元素低价态向高价态转化需要加入________。
氧化性还原性还原性氧化性氧化剂还原剂氧化剂氧化剂氧化剂还原剂还原剂还原剂氧化剂还原剂SFeSNa2SO4H2SO4SO3Na2SO3H2SO3SO2HgSH2S-2 0 +4 +6 含硫化合物的相互转化BaSO4NaOHO2 、CI2等OH-H2OH2OBaCl2O2O2H2SSO2
SO3H2SO3
H2SO4 S
H2S地下黄铁矿
FeS2雄黄
As4S4雌黄
As2S3辰砂
HgS地表石膏
CaSO4 ·2H2O芒硝
Na2SO4 ·10H2O自然界中不同价态硫元素间的转化SO42-的检验:方法:先加稀盐酸,再加氯化钡溶液。〖巩固练习〗如何鉴别失去标签的稀硫酸和浓硫酸?请同学们提出尽可能多的方案 1、下列转化需要加入氧化剂才能实现的是( )
A.H2S SO2 B. H2SO4 SO2
C.SO42- BaSO4 D. SO32- SO2
2、既有氧化性又有还原性的酸是( )
A. 碳酸 B. 亚硫酸
C. 硫酸 D. 高氯酸课堂练习AB3、已知下列氧化剂均能氧化+4价的硫元素,为了除去稀硫酸中混有的亚硫酸,应选用的最合理的氧化剂是( )
A. KMnO4 B. Ca(ClO)2 C. H2O2 D. Cl2
C二氧化硫?物理性质
SO2,无色有刺激性气味的气体,有毒,易液化,易溶于水(约1∶40)
由化合价推测化学性质:
SO2中的S为中间价态,通常反应中呈还原性.,有时也体现其氧化性.
实验室制取SO2 :
Na2SO3 + H2SO4(浓)= Na2SO4 + SO2↑+ H2O
二氧化硫的化学性质a. 强还原性
SO2+Cl2+H2O=2HCl+H2SO4( I2 、Br2)
b. 弱氧化性
2H2S+SO2=3S↓+2H2O
c. 酸性氧化物的通性
SO2 +H2O= H2SO3
SO2+2NaOH=Na2SO3+H2O
d. 漂白性(检验SO2方法)
能使品红溶液退色,加热沸腾溶液又变红色个本课时结束
再见!
