沪科版高中化学一年级第一学期《探索原子构建物质的奥秘》测试题(解析版)
文档属性
| 名称 | 沪科版高中化学一年级第一学期《探索原子构建物质的奥秘》测试题(解析版) |

|
|
| 格式 | zip | ||
| 文件大小 | 184.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-12-28 00:00:00 | ||
图片预览




文档简介
《探索原子构建物质的奥秘》测试题
一、单选题(每小题只有一个正确答案)
1.下列叙述错误的是( )
A. 金属元素和非金属元素一定形成离子化合物
B. 共价化合物中只有共价键,一定没有离子键
C. 含有金属阳离子的晶体未必是离子晶体
D. 离子化合物中可能含有极性共价键
2.下列说法中正确的是( )
A. 电子层结构相同的不同简单离子,其半径随核电荷数增多而减小
B. 失去电子难的原子获得电子的能力一定强
C. 在化学反应中,某元素由化合态变为游离态,则该元素一定被还原
D. 共价键的键能越大,分子晶体的熔点越高
3.已知BF3与一定量的水形成(H2O)2·BF3晶体Q ,Q在一定条件下可转化为R:
据此判断晶体Q中各种微粒间的作用力不涉及( )
A. 共价键和配位键 B. 氢键 C. 离子键 D. 范德华力
4.下列各组化合物中,化学键类型完全相同的是( )
A. 和 B. 和 C. 和 D. 和
5.下列各组物质中化学键的类型完全相同的是
A. HCl和MgCl2 B. Na2O?和CO2 C. CaCl2和NaOH D. NH3和H2O
6.下列物质中含有共价键的离子化合物的是( )
A. HCl B. N2 C. CaCl2 D. NaOH
7.下列物质中含有非极性共价键的是( )
A. NaOH B. Na2O C. Na2O2 D. CaCl2
8.下列物质中含有离子键的是( )
A. Cl2 B. Na2O2 C. CO 2 D. NH3
9.已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料。下列说法正确的是( )。
A. 元素B、E组成的化合物常温下一定呈气态
B. 一定条件下,元素C、D的最高价氧化物对应水化物之间不能发生反应
C. 工业上常用电解法制备元素C、D、E的单质
D. 化合物AE与CE含有相同类型的化学键
10.下列说法不正确的是( )
A. 化学反应中一定有化学键断裂,同时也有化学键形成
B. 只含有共价键的化合物必定是共价化合物
C. 含有离子键的化合物必定是离子化合物
D. 非金属元素间形成的化合物一定是共价化合物
11.下列物质中,既含有离子键又含有共价键的是( )
A. H2SO4 B. NaOH C. MgCl2 D. NaCl
12.下列物质中,既含共价键又含离子键的是( )
A. KCl B. H2O C. Na2O2 D. CO2
13.下列叙述正确的是( )
A. 在N2、CO2和SiO2物质中,都存在共价键,它们都是由分子构成
B. 金刚石、石墨、足球烯均是碳元素的同素异形体,性质都相似
C. HBr受热分解的过程中,只需克服分子间的作用力
D. 仅由非金属元素组成的物质也可能含有离子键
14.下列物质中含有离子键的是( )
A. Cl2 B. CO2 C. NaOH D. HCl
15.下列对一些实验事实和理论解释正确的是( )
选项 实验事实 理论解释
A HCl气体溶于水,能电离出H+、Cl- HCl为离子化合物
B HBr的酸性强于HCl的酸性 Br的非金属性比Cl强
C HF的沸点高于HCl F的非金属性比Cl强
D K3C60在熔融状态下能够导电 K3C60中含有离子键
A. A B. B C. C D. D
二、填空题
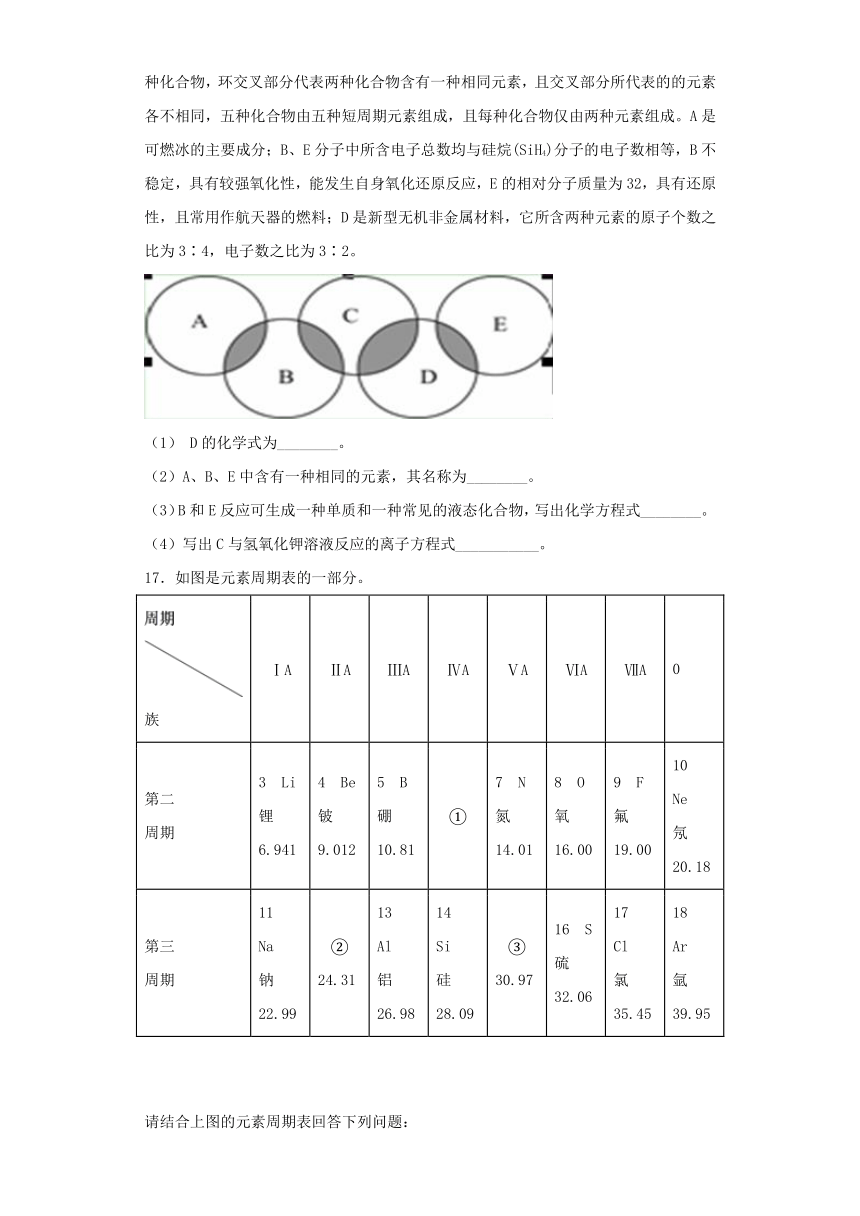
16.2016年奥运会将在里约热内卢举行,下图类似奥运五环,表示A、B、C、D、E五种化合物,环交叉部分代表两种化合物含有一种相同元素,且交叉部分所代表的的元素各不相同,五种化合物由五种短周期元素组成,且每种化合物仅由两种元素组成。A是可燃冰的主要成分;B、E分子中所含电子总数均与硅烷(SiH4)分子的电子数相等,B不稳定,具有较强氧化性,能发生自身氧化还原反应,E的相对分子质量为32,具有还原性,且常用作航天器的燃料;D是新型无机非金属材料,它所含两种元素的原子个数之比为3∶4,电子数之比为3∶2。
(1) D的化学式为________。
(2)A、B、E中含有一种相同的元素,其名称为________。
(3)B和E反应可生成一种单质和一种常见的液态化合物,写出化学方程式________。
(4)写出C与氢氧化钾溶液反应的离子方程式___________。
17.如图是元素周期表的一部分。
族 0
第二 周期 3 锂 6.941 4 铍 9.012 5 硼 10.81 7 氮 14.01 8 氧 16.00 9 氟 19.00 10 氖 20.18
第三 周期 11 钠 22.99 24.31 13 铝 26.98 14 硅 28.09 30.97 16 硫 32.06 17 氯 35.45 18 氩 39.95
请结合上图的元素周期表回答下列问题:
(1)金属性最强的是_______,原子半径最小的是_______;(填元素符号)
(2)相对原子质量为30.97的元素属_______(填“金属”或“非金属”),位置中的元素原子核内的质子数为_______(填数值);
(3)请画出位置中元素的离子结构示意图____________。
(4)位置中的元素形成的一种单质分子的空间结构为正四面体,该分子中的化学键类型为_______,该分子中所含化学键个数为___________。
(5)第三周期中有一种非金属元素最高价氧化物对应的水化物难溶于水,但能溶于烧碱溶液,请写出它溶于烧碱溶液的离子反应方程式________________。
(6)由Na、H、S、O四种元素组成的一种离子化合物A,已知A,既能与盐酸反应,又能与氢氧化钠溶液反应,还能和氯水反应,写出A与氯水反应的离子方程式___________。
(7)科学家认为存在NH5这种物质,且预测其与水剧烈反应放出气体,所得水溶液呈弱碱性,写出该反应的化学方程式___________________________,写出NH5的电子式______________。
18.根据要求回答下列问题:
I. 写出下列物质或微粒的电子式:
(1)CO2_________________
(2)N2__________________
(3) Na2O_____________
(4)NaOH________________
II. 下列物质:①CaBr2 ②H2O ③NH4Cl ④H2O2 ⑤Na2O2 ⑥Ca(OH)2 ⑦HClO ⑧ I2 ⑨He
(1)含有共价键的离子化合物是(用序号回答)_____________
含有共价键的共价化合物是(用序号回答)_______________
(2)当其熔化时,不破坏化学键的是(用序号回答)______________.
19.卤族元素的单质和化合物很多,请利用所学物质结构与性质的相关知识回答下列问题:
(1)卤族元素位于周期表的 区;氟原子的电子排布图为 溴原子的价电子排布式为 .
(2)在不太稀的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的。使氢氟酸分子缔合的作用力是
(3)已知高碘酸有两种形式,化学式分别为H5IO6和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱: H5IO6 HIO4.(填“>”、“<”或“=”)。H5IO6中α键与π键的个数比为 。
(4)碘在水中的溶解度虽然小,但在碘化钾溶液中溶解度却明显增大。这是由于溶液中发生下列反应 I-+ I2 =I3-与KI3类似的,还有CsICl2等。已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列 式发生。
A.CsICl2=CsCl+ICl B.CsICl2 =CsI +Cl2
(5)ClO2-的空间构型为 型,中心氯原子的杂化轨道类型为 ,写出一个ClO2-的等电子体 。
(6)如图为碘晶体晶胞结构。有关说法中正确的是 。
A.碘分子的排列有2种不同的取向
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中的碘原子间存在非极性键和范德华力
(7)已知CaF2晶体(见图)的密度为ρg/cm3 .NA为阿伏加德罗常数,相邻的两个Ca2+核间距为a cm,则CaF2的摩尔质量可以表示为 。
20.某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质。当汽车发生碰撞时,产气药剂产生大量气体使气囊迅速膨胀,从而起到保护作用。
(1)Fe2O3是主氧化剂,与Na发生置换反应生成的还原产物为________(填化学式)。
(2)KClO4是助氧化剂,其中含有化学键的类型为________________________。
(3)NaHCO3是冷却剂,吸收产气过程中释放的热量而发生分解,其化学方程式为
________________________________________________________________。
(4)NaN3是气体发生剂,受热分解产生N2和Na。取56 g上述产气药剂,分解产生的气体通过碱石灰后的体积为16.8 L(标准状况),该产气药剂中NaN3的质量分数为________。
三、实验题
21.硫代硫酸钠(Na2S2O3) 是一种常用的化工原料,常用作除氧剂等。回答下列问题。
(1)硫代硫酸钠做除氧剂的主要原因是其具有______性。
(2)硫代硫酸纳中所含化学键的类型为_________。
(3)硫代硫酸钠在中性或碱性溶液中稳定,在酸性溶液中不稳定。向pH=2的硫酸中滴加Na2S2O3溶液,可观察到的现象是_______________。
(4)硫代硫酸纳溶液呈弱碱性。用离子方程式解释其呈弱碱性的原因__________;25℃时该离子反应的平衡常数值约为_________。[已知25℃时,K1(H2S2O3)=2.52×10-1,K2(H2S2O3)=1.00×10-2]
(5)工业生产中,一般将Na2S和Na2CO3以物质的量比2 :1配成混合溶液,在配制混合溶液前先将蒸馏水加热煮沸一段时间后待用,再将SO2缓缓通入溶液中,即可得硫代硫酸钠。
①将蒸馏水加热煮沸一段时间后待用,其目的是_________。
②反应的化学方程式为__________。
③已知:2Na2S2O3+I2= 2NaI+Na2S4O6。为测定所制得晶体的纯度,该小组以淀粉作指示剂,用0.010mol/L的碘水进行多次取样滴定,测得Na2S2O3·5H2O 的含量约为102%。若所用试剂及操作均无不当,产生该结果最可能的原因是_______________。
四、推断题
22.a,b,c,d为四种由短周期元素构成的中性粒子,它们都有14个电子,且除a外都是共价型分子。回答下列问题:
(1)a是单核粒子,a单质可用作半导体材料,a原子核外电子排布式为______________。
(2)b是双核化合物,常温下为无色无味气体。b的化学式为________。人一旦吸入b气体后,就易引起中毒,是因为__________而中毒。
(3)c是双核单质,写出其电子式____________。c分子中所含共价键的类型为_______(填“极性键”或“非极性键”)。c单质常温下性质稳定,不易起反应,原因是________________________。
(4)d是四核化合物,其结构式为______________;d分子内所含共价键有________个σ键,________个π键;σ键与π键的强度大小关系为σ___π(填“>”、“<”或“=”),原因是:__________。
23.Ⅰ.下列化合物中,含有非极性共价键的离子化合物是 (____)
A.CaC2 B.NH4NO3 C.N2H4 D.Na2O2
Ⅱ.图A所示的转化关系中(具体反应条件略),a、b、c和d分别为四种短周期元素的常见单质,其余均为它们的化合物,i的溶液为常见的酸。a的一种同素异形体的晶胞如图B所示。
回答下列问题:
(1)图B对应的物质名称是____,其晶胞中的原子数为____,晶体的类型为____。
(2)d中元素的原子核外电子排布式为_______________。
(3)图A中由二种元素组成的物质中,沸点最高的是____,原因是____________________,该物质的分子构型为____,中心原子的杂化轨道类型为____。
(4)图A中的双原子分子中,极性最大的分子是____。
(5)k的分子式为____,中心原子的杂化轨道类型为____,属于___分子(填“极性”或“非极性”)。
试卷第2页,总7页
参考答案
1.A
【解析】
【详解】
A.周期表中金属与非金属交界处的金属常可与氯等非金属形成共价化合物,如:AlCl3、SnCl4、SbCl5,故A说法错误;
B.共价化合物中只有共价键,故B说法正确;
C.含有金属阳离子的晶体也可以是金属晶体,故C说法正确;
D.离子化合物中可能含有极性共价键,也可能含有非极性共价健,故D说法错误;
答案选A。
2.A
【解析】分析:A、根据离子半径大小的原因分析解答;
B、根据稳定原子得失电子的能力都很难分析解答;
C、由元素被还原时元素的化合价变化分析解答;
D、根据分子稳定与否的原因分析解答。
详解:A.电子层结构相同的不同简单离子,其半径随核电荷数增多而减小,故A正确;
B.失去电子难的原子获得电子的能力不一定强,故B错误;
C.在化学反应中,某元素由化合态变为游离态,则该元素可能被还原,也可能被氧化,故C错误;
D.共价键的键能越大,含有该分子的物质的稳定性就越强,故D错误。?
故答案为A。
3.C
【解析】晶体Q中,非金属元素原子之间易形成共价键,B原子含有空轨道、O原子含有孤电子对,所以B原子和O原子之间存在配位键,分子之间存在范德华力,水分子中的O原子和其它分子中的H原子易形成氢键,所以不涉及的是离子键,C正确;正确选项C。
4.A
【解析】分析:CaCl2、Na2S、Na2O、CaO中只有离子键,CO2、HCl中只有共价键,Na2O2和NaOH中既有离子键又有共价键。
详解:A项,CaCl2、Na2S中只有离子键,化学键完全相同;B项,Na2O中只有离子键,Na2O2中既有离子键又有非极性共价键,化学键不完全相同;C项,CO2中只有共价键,CaO中只有离子键,化学键不相同;D项,HCl中只有共价键,NaOH中具有离子键又有极性共价键,化学键不完全相同;化学键完全相同的是A项,答案选A。
点睛:本题考查化学键与物质类别的关系,掌握化学键的判断方法是解题的关键。一般活泼金属元素和活泼非金属元素组成的化合物中含离子键(AlCl3除外);全由非金属元素组成的化合物中只含共价键(铵盐除外);含原子团的离子化合物中既含离子键又含共价键。
5.D
【解析】A. HCl中H与Cl之间存在极性键,MgCl2中含有离子键,A错误;B. Na2O中含有离子键,CO2中C与O之间存在极性键,B错误;C. CaCl2中含有离子键,NaOH中含有离子键,另外H与O之间还有极性键,C错误;D. NH3和H2O中均存在极性键,D正确,答案选D。
点睛:掌握离子键和共价键的含义、形成条件是解答的关键,一般活泼的金属和活泼的非金属容易形成离子键,非金属元素的原子间容易形成共价键,如果是同一种元素的原子间形成的共价键则是非极性键,不同种元素的原子间形成的共价键则是极性键。尤其要注意AlCl3中含有共价键,不是离子键。
6.D
【解析】A. HCl是含有共价键的共价化合物,A错误B. N2是含有共价键的单质,B错误;C. CaCl2是含有离子键的离子化合物,C错误;D. NaOH是含有离子键、共价键的离子化合物,D正确,答案选D。
点睛:一般活泼的金属和活泼的非金属容易形成离子键,非金属元素的原子间容易形成共价键。注意含有离子键的化合物是离子化合物,全部由共价键形成的化合物是共价化合物,其中离子化合物中可以含有共价键,但共价化合物中一定不存在离子键。
7.C
【解析】A. NaOH中含有离子键和极性键,A错误;B . Na2O中含有离子键,B错误;C.Na2O2中含有离子键和非极性键,C正确;D.CaCl2中含有离子键,D错误,答案选C。
点睛:了解离子键和共价键的含义、形成条件是解答的关键,一般活泼的金属和活泼的非金属容易形成离子键,非金属元素的原子间容易形成共价键,其中共用电子对不发生偏移的是非极性键,共用电子对发生偏移的是极性键。
8.B
【解析】A、Cl2中只有非极性共价键,即A错误;B、Na2O2是活泼的金属元素钠和活泼的非金属元素氧形成的离子化合物,既含有离子键又含有共价键,故B正确;C、CO 2只有C=O共价键,故C错误;D、只含有N—H共价键,则D错误。本题正确答案为B。
9.C
【解析】D为铝元素,符合B原子条件的为C、S,由于B的原子序数比D小,则B为碳元素,C只能为钠元素,由此确定A为H、E为Cl。B、E组成的化合物为CCl4,常温下为液体;NaOH+Al(OH)3NaAlO2+2H2O,B正确;Na、Al的还原性强,其单质制备只能用电解法,Cl2的氧化性强,工业制备一般也用电解法;HCl含共价键,NaCl含离子键,D错误。
10.D
【解析】分析:A.化学反应实质是旧键断裂,新键形成;
B.只含共价键的化合物是共价化合物,含有共价键的化合物可能是离子化合物;
C.含有离子键的化合物是离子化合物,离子化合物中可能含有共价键;
D. 非金属元素间形成的化合物可能是离子化合物。
详解: A.化学反应实质是旧键断裂,新键形成,所以化学反应中一定有化学键断裂,同时也有化学键形成,故A正确;
B.只含共价键的化合物是共价化合物,含有共价键的化合物可能是离子化合物,如KOH,故B正确;
C.含有离子键的化合物是离子化合物,离子化合物中可能含有共价键,所以含有离子键的化合物一定是离子化合物,所以C选项是正确的;
D. 非金属元素间形成的化合物可能是离子化合物,如NH4Cl,故D错误;
所以本题选D。
11.B
【解析】
【分析】
离子键存在于离子化合物中,是阴阳离子之间的相互作用,共价键是在于非金属原子之间形成的化学键。
【详解】
A.H2SO4中含H、S、O三种非金属元素,属于共价化合物,只含共价键,选项A错误;B.氢氧化钠是离子化合物,其中含有离子键,氢氧两种元素之间形成共价键,即氢氧化钠中含有离子键和共价键,选项B正确;C.氯化镁由活泼金属Mg和活泼非金属Cl组成,形成了离子化合物,只含离子键,不含共价键,选项C错误;D.氯化钠由活泼金属Na和活泼非金属Cl组成,形成了离子化合物,只含离子键,不含共价键,选项D错误;答案选B。
【点睛】
本题考查离子键和共价键的区别,题目难度不大,注意离子化合物、共价化合物以及离子键和共价键的区别。
12.C
【解析】A. KCl是活泼金属元素与活泼非金属元素组成的离子化合物,只存在离子键,故A错误;B. H2O分子中只存在共价键,故B错误;C. Na2O2 属于离子化合物,存在离子键,过氧根离子中还存在共价键,故C正确;D. CO2分子中只存在共价键,故D错误;故选C。
13.D
【解析】A.在N2、CO2和SiO2物质中,都存在共价键,N2和CO2是由分子构成,SiO2构成微粒是原子,属原子晶体,故A错误;B.金刚石、石墨、足球烯均是碳元素形成的不同单质,属于同素异形体,物理性质不同,化学性质相似,故B错误;C.HBr受热分解的过程中,除需克服分子间的作用力,还需要破坏H—Br之间的共价键,故C错误;D.仅由非金属元素组成的化合物中可能含有离子键,如铵盐,故D正确;故选D。
14.C
【解析】A.Cl2中含有非极性共价键,故A不选;B.CO2 中含有极性共价键,故B不选; C.NaOH中含有离子键和极性共价键,故C选; D.HCl中含有极性共价键,故D不选;答案为C。
15.D
【解析】A、氯化氢是共价化合物,A错误;B、非金属性强弱与氢化物的酸性强弱没有关系,B错误;C、非金属性强弱与氢化物的沸点没有关系,C错误;D、K3C60在熔融状态下能够导电,说明K3C60中含有离子键,属于离子化合物,D正确,答案选D。
点睛:选项B和C是易错点,判断元素金属性(或非金属性)的强弱的方法很多,但也不能滥用,有些是不能作为判断依据的,如:①通常根据元素原子在化学反应中得、失电子的难易判断元素非金属性或金属性的强弱,而不是根据得、失电子的多少。②通常根据最高价氧化物对应水化物的酸碱性的强弱判断元素非金属性或金属性的强弱,而不是根据其他化合物酸碱性的强弱来判断。
16..(1)Si3N4 (2)氢
(3)N2H4+2H2O=N2↑+H2O
(4)SiO2+2OH-=SiO32-+H2O
【解析】
试题分析:A是可燃冰的主要成分;说明A是甲烷,B、E分子中所含电子总数均与硅烷(SiH4)分子的电子数相等,说明是18电子,B不稳定,具有较强氧化性,能发生自身氧化还原反应,说明B是H2O2,E的相对分子质量为32,具有还原性,且常用作航天器的燃料,说明是N2H4,D是新型无机非金属材料,它所含两种元素的原子个数之比为3∶4,电子数之比为3∶2,D和E具有相同的元素,可以判断为N,所以结合原子个数比可推知化合价为+4价,再结合原子个数比,可以计算出D是Si3N4,则C是SiO2。
考点:考查18电子微粒、化学方程式和离子方程式的书写
17. F 非金属 6 非极性共价键 HSO3-+ H2O + Cl2=SO42-+ 2Cl-+3H+ NH5+H2O=H2↑+NH3·H2O或NH5+H2O=H2↑+NH3+H2O
【解析】分析:根据元素周期表,①、②、③依次代表C、Mg、P元素。
(1)根据同周期从左到右原子半径逐渐减小,元素的金属性逐渐减弱,元素的非金属性逐渐增强;同主族从上到下原子半径逐渐增大,元素的金属性逐渐增强,元素的非金属性逐渐减弱。
(2)P元素属于非金属元素。C的质子数为6。
(3)Mg2+的核电荷数为12,K、L层依次排2、8个电子。
(4)P的单质中空间结构为正四面体的是P4,1个P4中含6个P-P键。
(5)第三周期非金属元素最高价氧化物对应的水化物难溶于水,但能溶于烧碱溶液,该元素为Si,最高价氧化物对应的水化物为H2SiO3。
(6)由Na、H、S、O四种元素组成的一种离子化合物A既能与盐酸反应,又能与氢氧化钠溶液反应,还能和氯水反应,A属于弱酸的酸式盐且具有还原性,A为NaHSO3。
(7)NH5与水剧烈反应放出气体,所得水溶液呈弱碱性,说明NH5与H2O反应生成NH3·H2O和H2。NH5类似金属的氢化物。
详解:(1)根据同周期从左到右原子半径逐渐减小,元素的金属性逐渐减弱,元素的非金属性逐渐增强;同主族从上到下原子半径逐渐增大,元素的金属性逐渐增强,元素的非金属性逐渐减弱;金属性最强的是左下角的Na,原子半径最小的是右上角的F。
(2)相对原子质量为30.97的元素是P元素,P元素属于非金属元素。位置①中的元素为C元素,C原子核内质子数为6。
(3)位置②的元素为Mg元素,Mg2+的离子结构示意图为。
(4)位置③的元素为P元素,P的一种单质分子的空间结构为正四面体,该单质的分子式为P4,该分子中P原子间形成非极性共价键。该分子中的键角为60?,1个P4分子中含6个P-P键,1mol该分子中含6molP-P键,所含共价键个数为6NA。
(5)第三周期中有一种非金属元素最高价氧化物对应的水化物难溶于水,但能溶于烧碱溶液,该元素为Si,其最高价氧化物对应的水化物为H2SiO3,H2SiO3与烧碱反应的化学方程式为H2SiO3+2NaOH=Na2SiO3+2H2O,离子方程式为H2SiO3+2OH-=SiO32-+2H2O。
(6)由Na、H、S、O四种元素组成的一种离子化合物A既能与盐酸反应,又能与氢氧化钠溶液反应,还能和氯水反应,A属于弱酸的酸式盐且具有还原性,A为NaHSO3;A与氯水反应的化学方程式为Cl2+NaHSO3+H2O=NaHSO4+2HCl,离子方程式为Cl2+HSO3-+H2O=2Cl-+SO42-+3H+。
(7)NH5与水剧烈反应放出气体,所得水溶液呈弱碱性,说明NH5与H2O反应生成NH3·H2O和H2,该反应的化学方程式为NH5+H2O=NH3·H2O+H2↑。NH5具有与金属氢化物相似的性质,NH5的化学式为NH4H,NH5的电子式为。
18. ③⑤⑥ ②④⑦ ②④⑦⑧⑨
【解析】I. (1)CO2是共价化合物,电子式为; (2)N2分子中存在氮氮三键,电子式为;(3) Na2O是离子化合物,电子式为;(4)NaOH是含有离子键和共价键的离子化合物,电子式为;
II. ①CaBr2是含有离子键的离子化合物;②H2O是含有共价键的共价化合物;③NH4Cl是含有离子键和共价键的离子化合物;④H2O2是含有共价键的共价化合物;⑤Na2O2是含有离子键和共价键的离子化合物;⑥Ca(OH)2是含有离子键和共价键的离子化合物;⑦HClO是含有共价键的共价化合物;⑧I2是含有共价键的单质;⑨He是稀有气体分子,不存在化学键,则
(1)根据以上分析可知含有共价键的离子化合物是③⑤⑥;含有共价键的共价化合物是②④⑦;(2)当其熔化时破坏的是离子键,共价键不变,则不破坏化学键的是②④⑦⑧⑨。
19.(1)P ;4s24p5;(2)氢键;(3)< 11:1;
(4)A
(5)角(或V型),sp3杂化,Cl2O、OF2、BrO2-等;(6)A 、D;(7)
【解析】
试题分析:(1)卤族元素原子的最外层有7个电子,在周期表中位于第ⅦA。即位于周期表的p区。9号元素氟原子的电子排布图为。35号元素溴原子的价电子排布式为4s24p5.(2)在氢氟酸中HF分子之间通常以氢键的形式结合在一起。所以氢氟酸是以二分子缔合形式存在的。H5IO6 为五元酸,HIO4是一元酸。在酸分子中非羟基氧原子数越多,该酸的酸性就越强。所以二者酸性强弱: H5IO6< HIO4。(3)在H5IO6中含有5个H—Oα键和5个I—Oα键与1个I=O双键中的α键和π键,所以H5IO6中α键与π键的个数比为11:1。(4)晶格能越大的物质,化学键结合的越牢固,断裂就越难。非金属性Cl>I,所以晶格能CsCl>CsI。因此按照A的方式方式反应。(5)ClO2-的空间构型为V型,其中心原子Cl的杂化方式为sp3杂化。等电子体的微粒的原子个数相同,价电子数也相同的微粒。因此与ClO2-的等电子体的微粒有Cl2O、OF2、BrO2-等。(6)由I2的晶体晶胞结构示意图可以看出:A..碘分子的排列有2种不同的取向.正确。B.在晶胞的顶点和面心上各有一个I2分子。则在每个晶胞中含有的I2的个数为:8×1/8+6×1/2=4.则含有的I原子的个数为8个。错误。C.碘晶体是分子晶体。不是原子晶体。错误。D.在碘晶体中的分子内的碘原子间存在非极性键,在不同分子之间的碘原子间则存在的是范德华力。正确。(7)在每个CaF2晶胞中含有Ca2+:8×1/8+6×1/2=4,含有F-:8×1=8。所以每个晶胞中含有4个CaF2。所以CaF2的摩尔质量为(a3·ρNA)÷4.
考点:考查元素在周期表中的位置、原子核外的电子排布图、排布式、分子之间的氢键、酸性强弱比较、原子的杂化方式、等电子体、分子晶体、离子晶体的知识。
20. Fe 离子键和共价键 2NaHCO3Na2CO3+CO2↑+H2O 58%
【解析】(1)Fe2O3是主氧化剂,与Na发生置换反应,Fe元素发生还原反应,则还原产物为Fe;
(2)KClO4由钾离子与高氯酸根离子构成,高氯酸根离子中Cl原子与O原子之间形成共价键,含有离子键、共价键;
(3)碳酸氢钠分解生成碳酸钠、二氧化碳与水,反应方程式为:2NaHCO3Na2CO3+CO2↑+H2O;
(4)碱石灰可以吸收二氧化碳、水蒸汽,剩余的气体为氮气,氮气的物质的量==0.75mol,根据氮元素守恒n(NaN3)==0.5mol,
则m(NaN3)=0.5mol×65g/mol=32.5g,故NaN3的质量分数为×100%=58%。
21. 还原 离子键和共价键 溶液变浑浊,有刺激性气味的气体产生 S2O32-+H2OHS2O3-+OH- 1.0×10-12 赶走水中的溶解氧(或空气) Na2S+Na2CO3+4SO2=3Na2S2O3+CO2 晶体中含有杂质(如Na2S等)?在滴定时参与反应或有一部分晶体失去结晶水
【解析】(1)硫代硫酸钠中的硫呈+2价,是中间价态,故其既有氧化性又有还原性。硫代硫酸钠做除氧剂的主要原因是其具有还原性。
(2)硫代硫酸纳中,硫代硫酸根与钠离子之间形成离子键,硫代硫酸根离子内部成键原子间形成的是共价键,故硫代硫酸纳中所含化学键的类型为离子键和共价键。
(3)硫代硫酸钠在中性或碱性溶液中稳定,在酸性溶液中不稳定。向pH=2的硫酸中滴加Na2S2O3溶液,发生反应2H++ S2O32-=S↓+SO2↑+H2O,可观察到的现象是溶液变浑浊,有刺激性气味的气体产生。
(4)硫代硫酸纳溶液呈弱碱性,是因为硫代硫酸根离子水解使溶液呈碱性,用离子方程式表示为S2O32-+H2O?HS2O3-+OH-;25℃时该离子反应的平衡常数为 1.0×10-12。
(5)①将蒸馏水加热煮沸一段时间后待用,其目的是赶走水中的溶解氧(或空气)。
②反应的化学方程式为Na2S+Na2CO3+4SO2=3Na2S2O3+CO2 。
③已知:2Na2S2O3+I2= 2NaI+Na2S4O6。为测定所制得晶体的纯度,该小组以淀粉作指示剂,用0.010mol/L的碘水进行多次取样滴定,测得Na2S2O3·5H2O 的含量约为102%。若所用试剂及操作均无不当,产生该结果最可能的原因是:晶体中含有具有还原性的杂质(如Na2S等) 在滴定时参与反应,或有一部分晶体失去结晶水。
22.1s22s22p63s23p2 CO CO一旦被吸入肺里后,会与血液中的血红蛋白结合,使血红蛋白丧失输送氧气的能力 非极性键 N2分子中的共价叁键键能很大,共价键很牢固 H—C≡C—H 3 2 > 形成σ键的原子轨道的重叠程度比π键的重叠程度大,形成的共价键强
【解析】
【分析】
从a,b,c,d为四种由短周期元素构成的中性粒子,它们都有14个电子入手,并结合题目分析,a是Si;b是CO;c是N2;d是C2H2;
【详解】
(1)a是Si,根据构造原理知,Si原子的电子排布式为1s22s22p63s23p2;
(2)b是两个原子的化合物,根据其物理性质:无色无味气体,推断b为CO,CO一旦进入肺里,会与血液中的血红蛋白结合而使血红蛋白丧失输送氧气的能力,使人中毒;
(3)c是双原子单质,每个原子有7个电子,故c为N2,N2分子的结构式为N≡N,为非极性键,N2分子中的共价叁键键能很大,所以N2分子很稳定,其电子式为:;
(4)d是四核化合物,即4个原子共有14个电子,d为C2H2,C2H2的结构式为H—C≡C—H,有两个H—C σ键,一个C—C σ键,两个π键。形成σ键的原子轨道的重叠程度比π键的重叠程度大,故形成的共价键强。
23. AD 金刚石 8 原子晶体 1s22s22p63s23p5 H2O 分子间形成氢键 V形(或角形) sp3 HCl COCl2 sp2 极性
【解析】Ⅰ.A.CaC2中钙离子和C22-离子之间存在离子键,属于离子化合物,C22-离子内两个碳原子之间存在非极性共价键,故A正确;B.NH4NO3中铵根离子与硝酸根离子之间存在离子键,铵根离子内存在N-H极性共价键,硝酸根离子内存在N-O极性共价键,故B错误;C.N2H4中只含共价键,属于共价化合物,故C错误;D.Na2O2中钠离子和O22-离子之间存在离子键,属于离子化合物,O22-离子内两个氧原子之间存在非极性共价键,故D正确;故选AD。
Ⅱ.a、b、c和d分别为四种短周期元素的常见单质,b与c反应生成水,故b、c分别为H2、O2中的一种,a的一种同素异形体的晶胞中每个原子周围有4个键,判断为金刚石,则a为C,则b为H2、c为O2,由转化关系可知,f为CO,g为CO2,因i是常见的酸,只由b、d形成可判断为盐酸,则d为Cl2,i为HCl,而k与水反应生成CO2与盐酸,该反应没在教材中出现过,且由f、d反应得到,应含C、O、Cl三种元素,只能判断为COCl2。
(1)有上述分析可知,图B对应的位置为金刚石,该晶胞中C原子数目=4+8×+6×=8,属于原子晶体,故答案为:金刚石;8;原子晶体;
(2)d中元素为Cl元素,基态原子电子排布式为1s22s22p63s23p5,故答案为:1s22s22p63s23p5;
(3)所有两元素形成的物质中,水分子之间存在氢键,常温下是液态,其它都是气体,故水的沸点最高,水分子中O原子呈2个σ键、含有2对孤电子对,故为V型结构,O原子采用sp3 杂化,故答案为:H2O;分子间形成氢键;V型;sp3 ;
(4)所有双原子分子中,只有H、Cl电负性差值最大,因而HCl的极性最大,故答案为:HCl;
(5)k的分子式为COCl2,COCl2中C原子成3个σ键、1个π键,没有孤电子对,C原子采取sp2杂化,为平面三角形结构,分子中正负电荷中心不重合,属于极性分子,故答案为:COCl2;sp2;极性。
一、单选题(每小题只有一个正确答案)
1.下列叙述错误的是( )
A. 金属元素和非金属元素一定形成离子化合物
B. 共价化合物中只有共价键,一定没有离子键
C. 含有金属阳离子的晶体未必是离子晶体
D. 离子化合物中可能含有极性共价键
2.下列说法中正确的是( )
A. 电子层结构相同的不同简单离子,其半径随核电荷数增多而减小
B. 失去电子难的原子获得电子的能力一定强
C. 在化学反应中,某元素由化合态变为游离态,则该元素一定被还原
D. 共价键的键能越大,分子晶体的熔点越高
3.已知BF3与一定量的水形成(H2O)2·BF3晶体Q ,Q在一定条件下可转化为R:
据此判断晶体Q中各种微粒间的作用力不涉及( )
A. 共价键和配位键 B. 氢键 C. 离子键 D. 范德华力
4.下列各组化合物中,化学键类型完全相同的是( )
A. 和 B. 和 C. 和 D. 和
5.下列各组物质中化学键的类型完全相同的是
A. HCl和MgCl2 B. Na2O?和CO2 C. CaCl2和NaOH D. NH3和H2O
6.下列物质中含有共价键的离子化合物的是( )
A. HCl B. N2 C. CaCl2 D. NaOH
7.下列物质中含有非极性共价键的是( )
A. NaOH B. Na2O C. Na2O2 D. CaCl2
8.下列物质中含有离子键的是( )
A. Cl2 B. Na2O2 C. CO 2 D. NH3
9.已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料。下列说法正确的是( )。
A. 元素B、E组成的化合物常温下一定呈气态
B. 一定条件下,元素C、D的最高价氧化物对应水化物之间不能发生反应
C. 工业上常用电解法制备元素C、D、E的单质
D. 化合物AE与CE含有相同类型的化学键
10.下列说法不正确的是( )
A. 化学反应中一定有化学键断裂,同时也有化学键形成
B. 只含有共价键的化合物必定是共价化合物
C. 含有离子键的化合物必定是离子化合物
D. 非金属元素间形成的化合物一定是共价化合物
11.下列物质中,既含有离子键又含有共价键的是( )
A. H2SO4 B. NaOH C. MgCl2 D. NaCl
12.下列物质中,既含共价键又含离子键的是( )
A. KCl B. H2O C. Na2O2 D. CO2
13.下列叙述正确的是( )
A. 在N2、CO2和SiO2物质中,都存在共价键,它们都是由分子构成
B. 金刚石、石墨、足球烯均是碳元素的同素异形体,性质都相似
C. HBr受热分解的过程中,只需克服分子间的作用力
D. 仅由非金属元素组成的物质也可能含有离子键
14.下列物质中含有离子键的是( )
A. Cl2 B. CO2 C. NaOH D. HCl
15.下列对一些实验事实和理论解释正确的是( )
选项 实验事实 理论解释
A HCl气体溶于水,能电离出H+、Cl- HCl为离子化合物
B HBr的酸性强于HCl的酸性 Br的非金属性比Cl强
C HF的沸点高于HCl F的非金属性比Cl强
D K3C60在熔融状态下能够导电 K3C60中含有离子键
A. A B. B C. C D. D
二、填空题
16.2016年奥运会将在里约热内卢举行,下图类似奥运五环,表示A、B、C、D、E五种化合物,环交叉部分代表两种化合物含有一种相同元素,且交叉部分所代表的的元素各不相同,五种化合物由五种短周期元素组成,且每种化合物仅由两种元素组成。A是可燃冰的主要成分;B、E分子中所含电子总数均与硅烷(SiH4)分子的电子数相等,B不稳定,具有较强氧化性,能发生自身氧化还原反应,E的相对分子质量为32,具有还原性,且常用作航天器的燃料;D是新型无机非金属材料,它所含两种元素的原子个数之比为3∶4,电子数之比为3∶2。
(1) D的化学式为________。
(2)A、B、E中含有一种相同的元素,其名称为________。
(3)B和E反应可生成一种单质和一种常见的液态化合物,写出化学方程式________。
(4)写出C与氢氧化钾溶液反应的离子方程式___________。
17.如图是元素周期表的一部分。
族 0
第二 周期 3 锂 6.941 4 铍 9.012 5 硼 10.81 7 氮 14.01 8 氧 16.00 9 氟 19.00 10 氖 20.18
第三 周期 11 钠 22.99 24.31 13 铝 26.98 14 硅 28.09 30.97 16 硫 32.06 17 氯 35.45 18 氩 39.95
请结合上图的元素周期表回答下列问题:
(1)金属性最强的是_______,原子半径最小的是_______;(填元素符号)
(2)相对原子质量为30.97的元素属_______(填“金属”或“非金属”),位置中的元素原子核内的质子数为_______(填数值);
(3)请画出位置中元素的离子结构示意图____________。
(4)位置中的元素形成的一种单质分子的空间结构为正四面体,该分子中的化学键类型为_______,该分子中所含化学键个数为___________。
(5)第三周期中有一种非金属元素最高价氧化物对应的水化物难溶于水,但能溶于烧碱溶液,请写出它溶于烧碱溶液的离子反应方程式________________。
(6)由Na、H、S、O四种元素组成的一种离子化合物A,已知A,既能与盐酸反应,又能与氢氧化钠溶液反应,还能和氯水反应,写出A与氯水反应的离子方程式___________。
(7)科学家认为存在NH5这种物质,且预测其与水剧烈反应放出气体,所得水溶液呈弱碱性,写出该反应的化学方程式___________________________,写出NH5的电子式______________。
18.根据要求回答下列问题:
I. 写出下列物质或微粒的电子式:
(1)CO2_________________
(2)N2__________________
(3) Na2O_____________
(4)NaOH________________
II. 下列物质:①CaBr2 ②H2O ③NH4Cl ④H2O2 ⑤Na2O2 ⑥Ca(OH)2 ⑦HClO ⑧ I2 ⑨He
(1)含有共价键的离子化合物是(用序号回答)_____________
含有共价键的共价化合物是(用序号回答)_______________
(2)当其熔化时,不破坏化学键的是(用序号回答)______________.
19.卤族元素的单质和化合物很多,请利用所学物质结构与性质的相关知识回答下列问题:
(1)卤族元素位于周期表的 区;氟原子的电子排布图为 溴原子的价电子排布式为 .
(2)在不太稀的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的。使氢氟酸分子缔合的作用力是
(3)已知高碘酸有两种形式,化学式分别为H5IO6和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱: H5IO6 HIO4.(填“>”、“<”或“=”)。H5IO6中α键与π键的个数比为 。
(4)碘在水中的溶解度虽然小,但在碘化钾溶液中溶解度却明显增大。这是由于溶液中发生下列反应 I-+ I2 =I3-与KI3类似的,还有CsICl2等。已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列 式发生。
A.CsICl2=CsCl+ICl B.CsICl2 =CsI +Cl2
(5)ClO2-的空间构型为 型,中心氯原子的杂化轨道类型为 ,写出一个ClO2-的等电子体 。
(6)如图为碘晶体晶胞结构。有关说法中正确的是 。
A.碘分子的排列有2种不同的取向
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中的碘原子间存在非极性键和范德华力
(7)已知CaF2晶体(见图)的密度为ρg/cm3 .NA为阿伏加德罗常数,相邻的两个Ca2+核间距为a cm,则CaF2的摩尔质量可以表示为 。
20.某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质。当汽车发生碰撞时,产气药剂产生大量气体使气囊迅速膨胀,从而起到保护作用。
(1)Fe2O3是主氧化剂,与Na发生置换反应生成的还原产物为________(填化学式)。
(2)KClO4是助氧化剂,其中含有化学键的类型为________________________。
(3)NaHCO3是冷却剂,吸收产气过程中释放的热量而发生分解,其化学方程式为
________________________________________________________________。
(4)NaN3是气体发生剂,受热分解产生N2和Na。取56 g上述产气药剂,分解产生的气体通过碱石灰后的体积为16.8 L(标准状况),该产气药剂中NaN3的质量分数为________。
三、实验题
21.硫代硫酸钠(Na2S2O3) 是一种常用的化工原料,常用作除氧剂等。回答下列问题。
(1)硫代硫酸钠做除氧剂的主要原因是其具有______性。
(2)硫代硫酸纳中所含化学键的类型为_________。
(3)硫代硫酸钠在中性或碱性溶液中稳定,在酸性溶液中不稳定。向pH=2的硫酸中滴加Na2S2O3溶液,可观察到的现象是_______________。
(4)硫代硫酸纳溶液呈弱碱性。用离子方程式解释其呈弱碱性的原因__________;25℃时该离子反应的平衡常数值约为_________。[已知25℃时,K1(H2S2O3)=2.52×10-1,K2(H2S2O3)=1.00×10-2]
(5)工业生产中,一般将Na2S和Na2CO3以物质的量比2 :1配成混合溶液,在配制混合溶液前先将蒸馏水加热煮沸一段时间后待用,再将SO2缓缓通入溶液中,即可得硫代硫酸钠。
①将蒸馏水加热煮沸一段时间后待用,其目的是_________。
②反应的化学方程式为__________。
③已知:2Na2S2O3+I2= 2NaI+Na2S4O6。为测定所制得晶体的纯度,该小组以淀粉作指示剂,用0.010mol/L的碘水进行多次取样滴定,测得Na2S2O3·5H2O 的含量约为102%。若所用试剂及操作均无不当,产生该结果最可能的原因是_______________。
四、推断题
22.a,b,c,d为四种由短周期元素构成的中性粒子,它们都有14个电子,且除a外都是共价型分子。回答下列问题:
(1)a是单核粒子,a单质可用作半导体材料,a原子核外电子排布式为______________。
(2)b是双核化合物,常温下为无色无味气体。b的化学式为________。人一旦吸入b气体后,就易引起中毒,是因为__________而中毒。
(3)c是双核单质,写出其电子式____________。c分子中所含共价键的类型为_______(填“极性键”或“非极性键”)。c单质常温下性质稳定,不易起反应,原因是________________________。
(4)d是四核化合物,其结构式为______________;d分子内所含共价键有________个σ键,________个π键;σ键与π键的强度大小关系为σ___π(填“>”、“<”或“=”),原因是:__________。
23.Ⅰ.下列化合物中,含有非极性共价键的离子化合物是 (____)
A.CaC2 B.NH4NO3 C.N2H4 D.Na2O2
Ⅱ.图A所示的转化关系中(具体反应条件略),a、b、c和d分别为四种短周期元素的常见单质,其余均为它们的化合物,i的溶液为常见的酸。a的一种同素异形体的晶胞如图B所示。
回答下列问题:
(1)图B对应的物质名称是____,其晶胞中的原子数为____,晶体的类型为____。
(2)d中元素的原子核外电子排布式为_______________。
(3)图A中由二种元素组成的物质中,沸点最高的是____,原因是____________________,该物质的分子构型为____,中心原子的杂化轨道类型为____。
(4)图A中的双原子分子中,极性最大的分子是____。
(5)k的分子式为____,中心原子的杂化轨道类型为____,属于___分子(填“极性”或“非极性”)。
试卷第2页,总7页
参考答案
1.A
【解析】
【详解】
A.周期表中金属与非金属交界处的金属常可与氯等非金属形成共价化合物,如:AlCl3、SnCl4、SbCl5,故A说法错误;
B.共价化合物中只有共价键,故B说法正确;
C.含有金属阳离子的晶体也可以是金属晶体,故C说法正确;
D.离子化合物中可能含有极性共价键,也可能含有非极性共价健,故D说法错误;
答案选A。
2.A
【解析】分析:A、根据离子半径大小的原因分析解答;
B、根据稳定原子得失电子的能力都很难分析解答;
C、由元素被还原时元素的化合价变化分析解答;
D、根据分子稳定与否的原因分析解答。
详解:A.电子层结构相同的不同简单离子,其半径随核电荷数增多而减小,故A正确;
B.失去电子难的原子获得电子的能力不一定强,故B错误;
C.在化学反应中,某元素由化合态变为游离态,则该元素可能被还原,也可能被氧化,故C错误;
D.共价键的键能越大,含有该分子的物质的稳定性就越强,故D错误。?
故答案为A。
3.C
【解析】晶体Q中,非金属元素原子之间易形成共价键,B原子含有空轨道、O原子含有孤电子对,所以B原子和O原子之间存在配位键,分子之间存在范德华力,水分子中的O原子和其它分子中的H原子易形成氢键,所以不涉及的是离子键,C正确;正确选项C。
4.A
【解析】分析:CaCl2、Na2S、Na2O、CaO中只有离子键,CO2、HCl中只有共价键,Na2O2和NaOH中既有离子键又有共价键。
详解:A项,CaCl2、Na2S中只有离子键,化学键完全相同;B项,Na2O中只有离子键,Na2O2中既有离子键又有非极性共价键,化学键不完全相同;C项,CO2中只有共价键,CaO中只有离子键,化学键不相同;D项,HCl中只有共价键,NaOH中具有离子键又有极性共价键,化学键不完全相同;化学键完全相同的是A项,答案选A。
点睛:本题考查化学键与物质类别的关系,掌握化学键的判断方法是解题的关键。一般活泼金属元素和活泼非金属元素组成的化合物中含离子键(AlCl3除外);全由非金属元素组成的化合物中只含共价键(铵盐除外);含原子团的离子化合物中既含离子键又含共价键。
5.D
【解析】A. HCl中H与Cl之间存在极性键,MgCl2中含有离子键,A错误;B. Na2O中含有离子键,CO2中C与O之间存在极性键,B错误;C. CaCl2中含有离子键,NaOH中含有离子键,另外H与O之间还有极性键,C错误;D. NH3和H2O中均存在极性键,D正确,答案选D。
点睛:掌握离子键和共价键的含义、形成条件是解答的关键,一般活泼的金属和活泼的非金属容易形成离子键,非金属元素的原子间容易形成共价键,如果是同一种元素的原子间形成的共价键则是非极性键,不同种元素的原子间形成的共价键则是极性键。尤其要注意AlCl3中含有共价键,不是离子键。
6.D
【解析】A. HCl是含有共价键的共价化合物,A错误B. N2是含有共价键的单质,B错误;C. CaCl2是含有离子键的离子化合物,C错误;D. NaOH是含有离子键、共价键的离子化合物,D正确,答案选D。
点睛:一般活泼的金属和活泼的非金属容易形成离子键,非金属元素的原子间容易形成共价键。注意含有离子键的化合物是离子化合物,全部由共价键形成的化合物是共价化合物,其中离子化合物中可以含有共价键,但共价化合物中一定不存在离子键。
7.C
【解析】A. NaOH中含有离子键和极性键,A错误;B . Na2O中含有离子键,B错误;C.Na2O2中含有离子键和非极性键,C正确;D.CaCl2中含有离子键,D错误,答案选C。
点睛:了解离子键和共价键的含义、形成条件是解答的关键,一般活泼的金属和活泼的非金属容易形成离子键,非金属元素的原子间容易形成共价键,其中共用电子对不发生偏移的是非极性键,共用电子对发生偏移的是极性键。
8.B
【解析】A、Cl2中只有非极性共价键,即A错误;B、Na2O2是活泼的金属元素钠和活泼的非金属元素氧形成的离子化合物,既含有离子键又含有共价键,故B正确;C、CO 2只有C=O共价键,故C错误;D、只含有N—H共价键,则D错误。本题正确答案为B。
9.C
【解析】D为铝元素,符合B原子条件的为C、S,由于B的原子序数比D小,则B为碳元素,C只能为钠元素,由此确定A为H、E为Cl。B、E组成的化合物为CCl4,常温下为液体;NaOH+Al(OH)3NaAlO2+2H2O,B正确;Na、Al的还原性强,其单质制备只能用电解法,Cl2的氧化性强,工业制备一般也用电解法;HCl含共价键,NaCl含离子键,D错误。
10.D
【解析】分析:A.化学反应实质是旧键断裂,新键形成;
B.只含共价键的化合物是共价化合物,含有共价键的化合物可能是离子化合物;
C.含有离子键的化合物是离子化合物,离子化合物中可能含有共价键;
D. 非金属元素间形成的化合物可能是离子化合物。
详解: A.化学反应实质是旧键断裂,新键形成,所以化学反应中一定有化学键断裂,同时也有化学键形成,故A正确;
B.只含共价键的化合物是共价化合物,含有共价键的化合物可能是离子化合物,如KOH,故B正确;
C.含有离子键的化合物是离子化合物,离子化合物中可能含有共价键,所以含有离子键的化合物一定是离子化合物,所以C选项是正确的;
D. 非金属元素间形成的化合物可能是离子化合物,如NH4Cl,故D错误;
所以本题选D。
11.B
【解析】
【分析】
离子键存在于离子化合物中,是阴阳离子之间的相互作用,共价键是在于非金属原子之间形成的化学键。
【详解】
A.H2SO4中含H、S、O三种非金属元素,属于共价化合物,只含共价键,选项A错误;B.氢氧化钠是离子化合物,其中含有离子键,氢氧两种元素之间形成共价键,即氢氧化钠中含有离子键和共价键,选项B正确;C.氯化镁由活泼金属Mg和活泼非金属Cl组成,形成了离子化合物,只含离子键,不含共价键,选项C错误;D.氯化钠由活泼金属Na和活泼非金属Cl组成,形成了离子化合物,只含离子键,不含共价键,选项D错误;答案选B。
【点睛】
本题考查离子键和共价键的区别,题目难度不大,注意离子化合物、共价化合物以及离子键和共价键的区别。
12.C
【解析】A. KCl是活泼金属元素与活泼非金属元素组成的离子化合物,只存在离子键,故A错误;B. H2O分子中只存在共价键,故B错误;C. Na2O2 属于离子化合物,存在离子键,过氧根离子中还存在共价键,故C正确;D. CO2分子中只存在共价键,故D错误;故选C。
13.D
【解析】A.在N2、CO2和SiO2物质中,都存在共价键,N2和CO2是由分子构成,SiO2构成微粒是原子,属原子晶体,故A错误;B.金刚石、石墨、足球烯均是碳元素形成的不同单质,属于同素异形体,物理性质不同,化学性质相似,故B错误;C.HBr受热分解的过程中,除需克服分子间的作用力,还需要破坏H—Br之间的共价键,故C错误;D.仅由非金属元素组成的化合物中可能含有离子键,如铵盐,故D正确;故选D。
14.C
【解析】A.Cl2中含有非极性共价键,故A不选;B.CO2 中含有极性共价键,故B不选; C.NaOH中含有离子键和极性共价键,故C选; D.HCl中含有极性共价键,故D不选;答案为C。
15.D
【解析】A、氯化氢是共价化合物,A错误;B、非金属性强弱与氢化物的酸性强弱没有关系,B错误;C、非金属性强弱与氢化物的沸点没有关系,C错误;D、K3C60在熔融状态下能够导电,说明K3C60中含有离子键,属于离子化合物,D正确,答案选D。
点睛:选项B和C是易错点,判断元素金属性(或非金属性)的强弱的方法很多,但也不能滥用,有些是不能作为判断依据的,如:①通常根据元素原子在化学反应中得、失电子的难易判断元素非金属性或金属性的强弱,而不是根据得、失电子的多少。②通常根据最高价氧化物对应水化物的酸碱性的强弱判断元素非金属性或金属性的强弱,而不是根据其他化合物酸碱性的强弱来判断。
16..(1)Si3N4 (2)氢
(3)N2H4+2H2O=N2↑+H2O
(4)SiO2+2OH-=SiO32-+H2O
【解析】
试题分析:A是可燃冰的主要成分;说明A是甲烷,B、E分子中所含电子总数均与硅烷(SiH4)分子的电子数相等,说明是18电子,B不稳定,具有较强氧化性,能发生自身氧化还原反应,说明B是H2O2,E的相对分子质量为32,具有还原性,且常用作航天器的燃料,说明是N2H4,D是新型无机非金属材料,它所含两种元素的原子个数之比为3∶4,电子数之比为3∶2,D和E具有相同的元素,可以判断为N,所以结合原子个数比可推知化合价为+4价,再结合原子个数比,可以计算出D是Si3N4,则C是SiO2。
考点:考查18电子微粒、化学方程式和离子方程式的书写
17. F 非金属 6 非极性共价键 HSO3-+ H2O + Cl2=SO42-+ 2Cl-+3H+ NH5+H2O=H2↑+NH3·H2O或NH5+H2O=H2↑+NH3+H2O
【解析】分析:根据元素周期表,①、②、③依次代表C、Mg、P元素。
(1)根据同周期从左到右原子半径逐渐减小,元素的金属性逐渐减弱,元素的非金属性逐渐增强;同主族从上到下原子半径逐渐增大,元素的金属性逐渐增强,元素的非金属性逐渐减弱。
(2)P元素属于非金属元素。C的质子数为6。
(3)Mg2+的核电荷数为12,K、L层依次排2、8个电子。
(4)P的单质中空间结构为正四面体的是P4,1个P4中含6个P-P键。
(5)第三周期非金属元素最高价氧化物对应的水化物难溶于水,但能溶于烧碱溶液,该元素为Si,最高价氧化物对应的水化物为H2SiO3。
(6)由Na、H、S、O四种元素组成的一种离子化合物A既能与盐酸反应,又能与氢氧化钠溶液反应,还能和氯水反应,A属于弱酸的酸式盐且具有还原性,A为NaHSO3。
(7)NH5与水剧烈反应放出气体,所得水溶液呈弱碱性,说明NH5与H2O反应生成NH3·H2O和H2。NH5类似金属的氢化物。
详解:(1)根据同周期从左到右原子半径逐渐减小,元素的金属性逐渐减弱,元素的非金属性逐渐增强;同主族从上到下原子半径逐渐增大,元素的金属性逐渐增强,元素的非金属性逐渐减弱;金属性最强的是左下角的Na,原子半径最小的是右上角的F。
(2)相对原子质量为30.97的元素是P元素,P元素属于非金属元素。位置①中的元素为C元素,C原子核内质子数为6。
(3)位置②的元素为Mg元素,Mg2+的离子结构示意图为。
(4)位置③的元素为P元素,P的一种单质分子的空间结构为正四面体,该单质的分子式为P4,该分子中P原子间形成非极性共价键。该分子中的键角为60?,1个P4分子中含6个P-P键,1mol该分子中含6molP-P键,所含共价键个数为6NA。
(5)第三周期中有一种非金属元素最高价氧化物对应的水化物难溶于水,但能溶于烧碱溶液,该元素为Si,其最高价氧化物对应的水化物为H2SiO3,H2SiO3与烧碱反应的化学方程式为H2SiO3+2NaOH=Na2SiO3+2H2O,离子方程式为H2SiO3+2OH-=SiO32-+2H2O。
(6)由Na、H、S、O四种元素组成的一种离子化合物A既能与盐酸反应,又能与氢氧化钠溶液反应,还能和氯水反应,A属于弱酸的酸式盐且具有还原性,A为NaHSO3;A与氯水反应的化学方程式为Cl2+NaHSO3+H2O=NaHSO4+2HCl,离子方程式为Cl2+HSO3-+H2O=2Cl-+SO42-+3H+。
(7)NH5与水剧烈反应放出气体,所得水溶液呈弱碱性,说明NH5与H2O反应生成NH3·H2O和H2,该反应的化学方程式为NH5+H2O=NH3·H2O+H2↑。NH5具有与金属氢化物相似的性质,NH5的化学式为NH4H,NH5的电子式为。
18. ③⑤⑥ ②④⑦ ②④⑦⑧⑨
【解析】I. (1)CO2是共价化合物,电子式为; (2)N2分子中存在氮氮三键,电子式为;(3) Na2O是离子化合物,电子式为;(4)NaOH是含有离子键和共价键的离子化合物,电子式为;
II. ①CaBr2是含有离子键的离子化合物;②H2O是含有共价键的共价化合物;③NH4Cl是含有离子键和共价键的离子化合物;④H2O2是含有共价键的共价化合物;⑤Na2O2是含有离子键和共价键的离子化合物;⑥Ca(OH)2是含有离子键和共价键的离子化合物;⑦HClO是含有共价键的共价化合物;⑧I2是含有共价键的单质;⑨He是稀有气体分子,不存在化学键,则
(1)根据以上分析可知含有共价键的离子化合物是③⑤⑥;含有共价键的共价化合物是②④⑦;(2)当其熔化时破坏的是离子键,共价键不变,则不破坏化学键的是②④⑦⑧⑨。
19.(1)P ;4s24p5;(2)氢键;(3)< 11:1;
(4)A
(5)角(或V型),sp3杂化,Cl2O、OF2、BrO2-等;(6)A 、D;(7)
【解析】
试题分析:(1)卤族元素原子的最外层有7个电子,在周期表中位于第ⅦA。即位于周期表的p区。9号元素氟原子的电子排布图为。35号元素溴原子的价电子排布式为4s24p5.(2)在氢氟酸中HF分子之间通常以氢键的形式结合在一起。所以氢氟酸是以二分子缔合形式存在的。H5IO6 为五元酸,HIO4是一元酸。在酸分子中非羟基氧原子数越多,该酸的酸性就越强。所以二者酸性强弱: H5IO6< HIO4。(3)在H5IO6中含有5个H—Oα键和5个I—Oα键与1个I=O双键中的α键和π键,所以H5IO6中α键与π键的个数比为11:1。(4)晶格能越大的物质,化学键结合的越牢固,断裂就越难。非金属性Cl>I,所以晶格能CsCl>CsI。因此按照A的方式方式反应。(5)ClO2-的空间构型为V型,其中心原子Cl的杂化方式为sp3杂化。等电子体的微粒的原子个数相同,价电子数也相同的微粒。因此与ClO2-的等电子体的微粒有Cl2O、OF2、BrO2-等。(6)由I2的晶体晶胞结构示意图可以看出:A..碘分子的排列有2种不同的取向.正确。B.在晶胞的顶点和面心上各有一个I2分子。则在每个晶胞中含有的I2的个数为:8×1/8+6×1/2=4.则含有的I原子的个数为8个。错误。C.碘晶体是分子晶体。不是原子晶体。错误。D.在碘晶体中的分子内的碘原子间存在非极性键,在不同分子之间的碘原子间则存在的是范德华力。正确。(7)在每个CaF2晶胞中含有Ca2+:8×1/8+6×1/2=4,含有F-:8×1=8。所以每个晶胞中含有4个CaF2。所以CaF2的摩尔质量为(a3·ρNA)÷4.
考点:考查元素在周期表中的位置、原子核外的电子排布图、排布式、分子之间的氢键、酸性强弱比较、原子的杂化方式、等电子体、分子晶体、离子晶体的知识。
20. Fe 离子键和共价键 2NaHCO3Na2CO3+CO2↑+H2O 58%
【解析】(1)Fe2O3是主氧化剂,与Na发生置换反应,Fe元素发生还原反应,则还原产物为Fe;
(2)KClO4由钾离子与高氯酸根离子构成,高氯酸根离子中Cl原子与O原子之间形成共价键,含有离子键、共价键;
(3)碳酸氢钠分解生成碳酸钠、二氧化碳与水,反应方程式为:2NaHCO3Na2CO3+CO2↑+H2O;
(4)碱石灰可以吸收二氧化碳、水蒸汽,剩余的气体为氮气,氮气的物质的量==0.75mol,根据氮元素守恒n(NaN3)==0.5mol,
则m(NaN3)=0.5mol×65g/mol=32.5g,故NaN3的质量分数为×100%=58%。
21. 还原 离子键和共价键 溶液变浑浊,有刺激性气味的气体产生 S2O32-+H2OHS2O3-+OH- 1.0×10-12 赶走水中的溶解氧(或空气) Na2S+Na2CO3+4SO2=3Na2S2O3+CO2 晶体中含有杂质(如Na2S等)?在滴定时参与反应或有一部分晶体失去结晶水
【解析】(1)硫代硫酸钠中的硫呈+2价,是中间价态,故其既有氧化性又有还原性。硫代硫酸钠做除氧剂的主要原因是其具有还原性。
(2)硫代硫酸纳中,硫代硫酸根与钠离子之间形成离子键,硫代硫酸根离子内部成键原子间形成的是共价键,故硫代硫酸纳中所含化学键的类型为离子键和共价键。
(3)硫代硫酸钠在中性或碱性溶液中稳定,在酸性溶液中不稳定。向pH=2的硫酸中滴加Na2S2O3溶液,发生反应2H++ S2O32-=S↓+SO2↑+H2O,可观察到的现象是溶液变浑浊,有刺激性气味的气体产生。
(4)硫代硫酸纳溶液呈弱碱性,是因为硫代硫酸根离子水解使溶液呈碱性,用离子方程式表示为S2O32-+H2O?HS2O3-+OH-;25℃时该离子反应的平衡常数为 1.0×10-12。
(5)①将蒸馏水加热煮沸一段时间后待用,其目的是赶走水中的溶解氧(或空气)。
②反应的化学方程式为Na2S+Na2CO3+4SO2=3Na2S2O3+CO2 。
③已知:2Na2S2O3+I2= 2NaI+Na2S4O6。为测定所制得晶体的纯度,该小组以淀粉作指示剂,用0.010mol/L的碘水进行多次取样滴定,测得Na2S2O3·5H2O 的含量约为102%。若所用试剂及操作均无不当,产生该结果最可能的原因是:晶体中含有具有还原性的杂质(如Na2S等) 在滴定时参与反应,或有一部分晶体失去结晶水。
22.1s22s22p63s23p2 CO CO一旦被吸入肺里后,会与血液中的血红蛋白结合,使血红蛋白丧失输送氧气的能力 非极性键 N2分子中的共价叁键键能很大,共价键很牢固 H—C≡C—H 3 2 > 形成σ键的原子轨道的重叠程度比π键的重叠程度大,形成的共价键强
【解析】
【分析】
从a,b,c,d为四种由短周期元素构成的中性粒子,它们都有14个电子入手,并结合题目分析,a是Si;b是CO;c是N2;d是C2H2;
【详解】
(1)a是Si,根据构造原理知,Si原子的电子排布式为1s22s22p63s23p2;
(2)b是两个原子的化合物,根据其物理性质:无色无味气体,推断b为CO,CO一旦进入肺里,会与血液中的血红蛋白结合而使血红蛋白丧失输送氧气的能力,使人中毒;
(3)c是双原子单质,每个原子有7个电子,故c为N2,N2分子的结构式为N≡N,为非极性键,N2分子中的共价叁键键能很大,所以N2分子很稳定,其电子式为:;
(4)d是四核化合物,即4个原子共有14个电子,d为C2H2,C2H2的结构式为H—C≡C—H,有两个H—C σ键,一个C—C σ键,两个π键。形成σ键的原子轨道的重叠程度比π键的重叠程度大,故形成的共价键强。
23. AD 金刚石 8 原子晶体 1s22s22p63s23p5 H2O 分子间形成氢键 V形(或角形) sp3 HCl COCl2 sp2 极性
【解析】Ⅰ.A.CaC2中钙离子和C22-离子之间存在离子键,属于离子化合物,C22-离子内两个碳原子之间存在非极性共价键,故A正确;B.NH4NO3中铵根离子与硝酸根离子之间存在离子键,铵根离子内存在N-H极性共价键,硝酸根离子内存在N-O极性共价键,故B错误;C.N2H4中只含共价键,属于共价化合物,故C错误;D.Na2O2中钠离子和O22-离子之间存在离子键,属于离子化合物,O22-离子内两个氧原子之间存在非极性共价键,故D正确;故选AD。
Ⅱ.a、b、c和d分别为四种短周期元素的常见单质,b与c反应生成水,故b、c分别为H2、O2中的一种,a的一种同素异形体的晶胞中每个原子周围有4个键,判断为金刚石,则a为C,则b为H2、c为O2,由转化关系可知,f为CO,g为CO2,因i是常见的酸,只由b、d形成可判断为盐酸,则d为Cl2,i为HCl,而k与水反应生成CO2与盐酸,该反应没在教材中出现过,且由f、d反应得到,应含C、O、Cl三种元素,只能判断为COCl2。
(1)有上述分析可知,图B对应的位置为金刚石,该晶胞中C原子数目=4+8×+6×=8,属于原子晶体,故答案为:金刚石;8;原子晶体;
(2)d中元素为Cl元素,基态原子电子排布式为1s22s22p63s23p5,故答案为:1s22s22p63s23p5;
(3)所有两元素形成的物质中,水分子之间存在氢键,常温下是液态,其它都是气体,故水的沸点最高,水分子中O原子呈2个σ键、含有2对孤电子对,故为V型结构,O原子采用sp3 杂化,故答案为:H2O;分子间形成氢键;V型;sp3 ;
(4)所有双原子分子中,只有H、Cl电负性差值最大,因而HCl的极性最大,故答案为:HCl;
(5)k的分子式为COCl2,COCl2中C原子成3个σ键、1个π键,没有孤电子对,C原子采取sp2杂化,为平面三角形结构,分子中正负电荷中心不重合,属于极性分子,故答案为:COCl2;sp2;极性。
