第4单元 沉淀溶解平衡(浙江省杭州市)
图片预览





文档简介
课件19张PPT。1、盐类的水解实质:2、水解规律:3、影响因素有弱才水解,无弱不水解;
谁弱谁水解,谁强显谁性;
越弱越水解,都弱双水解。盐电离出来的离子与水电离出来的H + 或OH –
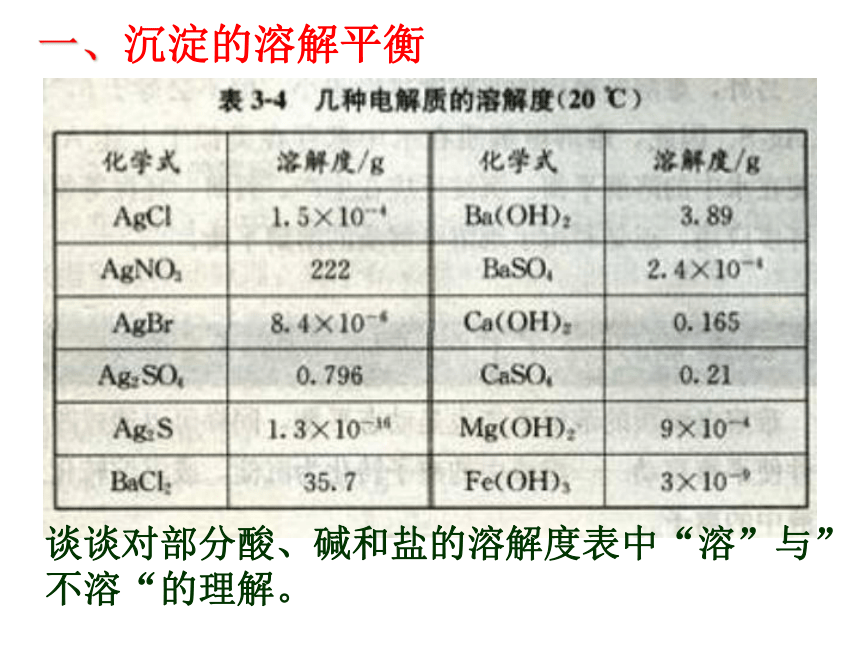
结合,从而使水的电离平衡发生移动的过程。第四单元 沉淀溶解平衡一、沉淀的溶解平衡谈谈对部分酸、碱和盐的溶解度表中“溶”与”不溶“的理解。生成沉淀的离子反应反应之所以能够发生,在于生成物的溶解度小。
难溶电解质的溶解度尽管很小,但不会等于0(生成AgCl沉淀后的溶液中三种有关反应的粒子在反应体系中共存)。
习惯上,将溶解度小于0.01克的电解质称为难溶电解质
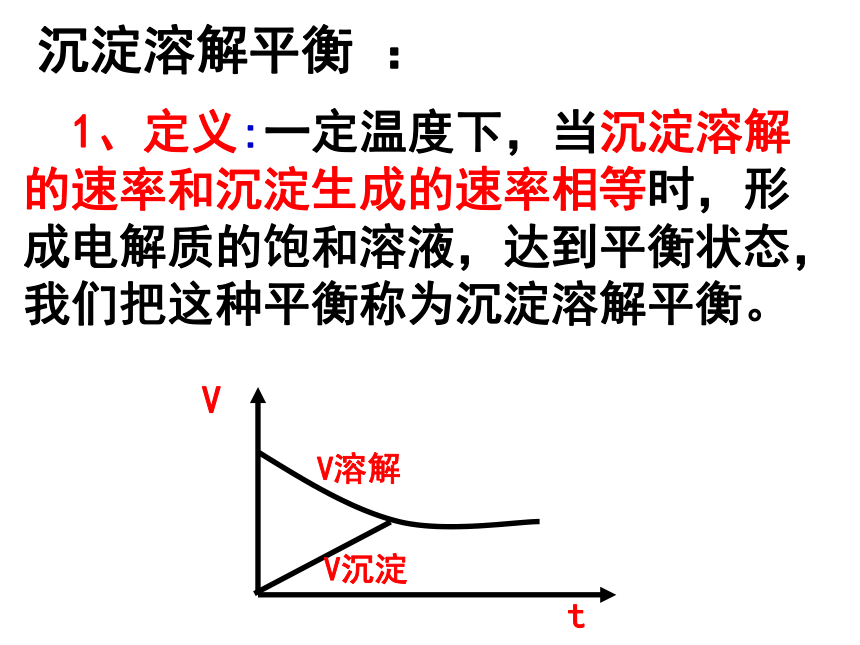
化学上通常认为残留在溶液中的离子浓度小于10-5mol/L时,沉淀达到完全。实验探究 将少量PbI2(难溶于水)固体加入盛有一定量水的50mL烧杯中,用玻璃棒充分搅拌,静置一段时间。 取上层清夜2 mL,加入试管中,逐滴加入AgNO3溶液,振荡,观察实验现象。现象:溶液中出现黄色浑浊现象。沉淀溶解平衡 : 1、定义:一定温度下,当沉淀溶解的速率和沉淀生成的速率相等时,形成电解质的饱和溶液,达到平衡状态,我们把这种平衡称为沉淀溶解平衡。2、特征逆、动、等、定、变3、影响因素内因:难溶物本身的性质外因:①浓度:加水稀释,平衡向溶解方向移动②温度:绝大多数难溶盐的溶解是吸热过程。③同离子效应:④其他溶度积———Ksp1、定义在一定条件下,难溶性物质的饱和溶液中,存在溶解平衡,其平衡常数叫做溶度积常数或简称溶度积.Ksp= c(Ag+).c(Br-) Ksp= c(Fe3+).c3(OH-)难溶电解质溶解平衡关系式和溶度积AgBr Ag+ + Br-阅读 课本P82表3-14Fe(OH)3 Fe3++3OH-2、影响因素 Ksp决定于难溶电解质的本性,与温度有关,一定温度下,Ksp是常数。 在一定温度下,难溶电解质的Ksp的大小反映了其在水中的溶解能力。 Ksp越大,在水中的溶解能力越强, Ksp越小,在水中的溶解能力越弱。3、意义4、离子积Q c= c(Am+)n.c(Bn-)m
Qc称为离子积,其表达式中离子浓度是溶液中的实际浓度。 AnBm(s) nAm+(aq) + mBn-(aq) 溶度积(Ksp):在一定温度下,在难溶电解质的饱和溶液中,各离子浓度幂之乘积为一常数.
MmAn的饱和溶液: Ksp=[c(Mn+)]m · [c(Am-)]n
溶度积规则:离子积Qc=c(Mn+)m · c(Am-)n
Qc > Ksp,溶液处于过饱和溶液状态,生成沉淀.
Qc = Ksp,沉淀和溶解达到平衡,溶液为饱和溶液.
Qc < Ksp,溶液未达饱和,沉淀发生溶解.5、溶度积和溶度积规则例1:完成难溶物CaCO3、Ag2CrO4、Mg(OH)2在水中的沉淀溶解平衡的关系式和溶度积。 已知AgCl 298K时在水中溶解了1.92×10-3g·L-1,计算其Ksp。解:AgCl的摩尔质量= 143.5 g · mol-1
c = 1.92×10-3/143.5
= 1.34 ×10-5 (mol·L-1)
Ksp = c2 = 1.8×10-10例2:溶度积与离子浓度的换算:1、沉淀的生成二、沉淀反应的应用例1:将4×10-3mol?L-1的AgNO3溶液与4×10-3mol?L-1的NaCl溶液等体积混合能否有沉淀析出?Ksp(AgCl)= 1.8×10-10C(Ag+)=2 ×10-3, c(Cl-)= 2 ×10-3
Qc=2 ×10-3× 2 ×10-3
=4.0 ×10-6 >1.8×10-10Qc>Ksp,所以有AgCl沉淀析出。例2:取5ml0.002mol·L-1 BaCl2与等体积的0.02mol·L-1Na2SO4的混合,计算Ba2+是否沉淀完全[即c(Ba2+ )<10-5mol·L-1]?
BaSO4的 Ksp=1.1×10-10.)Ksp ≈ 0.009· c(Ba2+) = 1.1×10-10
c(Ba2+) =1.2×10-8(mol·L-1) <10-5mol·L-1
Ba2+已沉淀完全。SO42-过量0.009mol/L解:SO42-+Ba2+ BaSO4↓例3:课本P83硫酸铜中除少量Fe3+的方法在1mol·L-1CuSO4溶液中含有少量的Fe3+ 杂质,pH值控制在什么范 围才能除去Fe3+ ?
[使c(Fe3+) ≤ 10-5mol·L-1]解:Fe (OH)3 Fe3+ + 3OH –
Ksp = c(Fe3+ )c3(OH–) = 2.6×10-39 Fe(OH)3的 Ksp=2.6×10-39,Cu(OH)2 的Ksp= 5.6×10-20pH = 2.8 pH > 2.8Cu(OH)2 Cu 2+ + 2OH –
Ksp = c(Cu 2+ )c2(OH –) = 5.6×10-20 pH = 4.4
控制 pH:2.8 ~ 4.4 . 分步沉淀
在相同浓度的Cl-、Br-、I- 的溶液中逐滴加入AgNO3 溶液,AgI最先沉淀,其次是AgBr, 最后是AgCl。因为:Ksp(AgI) < Ksp(AgBr) < Ksp(AgCl)2、沉淀的溶解 根据平衡移动原理,对于在水中难溶的电解质,如果能设法不断移去溶解平衡体系中的相应离子,使平衡向沉淀溶解的方向移动,就可以使沉淀溶解。例如难溶于水的CaCO3沉淀可以溶于盐酸中:CaCO3 Ca2++CO32-+H+HCO3- H2CO3 →H2O+CO2↑课本P86溶洞的形成也是这样的道理3、沉淀的转化 对于一些用酸或其他方法也不能溶解的沉淀,可以先将其转化为另一种用酸或其他方法能溶解的沉淀.锅炉中水垢中含有CaSO4 ,可先用Na2CO3溶液处理,使 之转化为疏松、易溶于酸的CaCO3。CaSO4 SO42- + Ca2+ +
CO32-CaCO3例4:过量AgCl溶解在下列各种物质中,问哪
种溶液中c(Ag+)最小 ( )
A. 100mL水 B. 1000mL水
C. 100mL0.2mol·L-1KCl溶液
D. 1000mL0.5mol·L-1KNO3溶液例5:下列说法中正确的是( )
A.不溶于不的物质溶解度为0
B.绝对不溶解的物质是不存在的
C.某离子被沉淀完全是指该离子在溶液中的浓度为0
D.物质的溶解性为难溶,则该物质不溶于水B例6:试利用平衡移动原理解释下列事实:
(1)FeS不溶于水,但能溶于稀盐酸中
(2)CaCO3难溶于稀硫酸,却能溶于醋酸中
(3)分别用等体积的蒸馏水和0.010mol/L硫酸洗涤BaSO4沉淀,用水洗涤造成BaSO4的损失量大于用稀硫酸洗涤的损失量
谁弱谁水解,谁强显谁性;
越弱越水解,都弱双水解。盐电离出来的离子与水电离出来的H + 或OH –
结合,从而使水的电离平衡发生移动的过程。第四单元 沉淀溶解平衡一、沉淀的溶解平衡谈谈对部分酸、碱和盐的溶解度表中“溶”与”不溶“的理解。生成沉淀的离子反应反应之所以能够发生,在于生成物的溶解度小。
难溶电解质的溶解度尽管很小,但不会等于0(生成AgCl沉淀后的溶液中三种有关反应的粒子在反应体系中共存)。
习惯上,将溶解度小于0.01克的电解质称为难溶电解质
化学上通常认为残留在溶液中的离子浓度小于10-5mol/L时,沉淀达到完全。实验探究 将少量PbI2(难溶于水)固体加入盛有一定量水的50mL烧杯中,用玻璃棒充分搅拌,静置一段时间。 取上层清夜2 mL,加入试管中,逐滴加入AgNO3溶液,振荡,观察实验现象。现象:溶液中出现黄色浑浊现象。沉淀溶解平衡 : 1、定义:一定温度下,当沉淀溶解的速率和沉淀生成的速率相等时,形成电解质的饱和溶液,达到平衡状态,我们把这种平衡称为沉淀溶解平衡。2、特征逆、动、等、定、变3、影响因素内因:难溶物本身的性质外因:①浓度:加水稀释,平衡向溶解方向移动②温度:绝大多数难溶盐的溶解是吸热过程。③同离子效应:④其他溶度积———Ksp1、定义在一定条件下,难溶性物质的饱和溶液中,存在溶解平衡,其平衡常数叫做溶度积常数或简称溶度积.Ksp= c(Ag+).c(Br-) Ksp= c(Fe3+).c3(OH-)难溶电解质溶解平衡关系式和溶度积AgBr Ag+ + Br-阅读 课本P82表3-14Fe(OH)3 Fe3++3OH-2、影响因素 Ksp决定于难溶电解质的本性,与温度有关,一定温度下,Ksp是常数。 在一定温度下,难溶电解质的Ksp的大小反映了其在水中的溶解能力。 Ksp越大,在水中的溶解能力越强, Ksp越小,在水中的溶解能力越弱。3、意义4、离子积Q c= c(Am+)n.c(Bn-)m
Qc称为离子积,其表达式中离子浓度是溶液中的实际浓度。 AnBm(s) nAm+(aq) + mBn-(aq) 溶度积(Ksp):在一定温度下,在难溶电解质的饱和溶液中,各离子浓度幂之乘积为一常数.
MmAn的饱和溶液: Ksp=[c(Mn+)]m · [c(Am-)]n
溶度积规则:离子积Qc=c(Mn+)m · c(Am-)n
Qc > Ksp,溶液处于过饱和溶液状态,生成沉淀.
Qc = Ksp,沉淀和溶解达到平衡,溶液为饱和溶液.
Qc < Ksp,溶液未达饱和,沉淀发生溶解.5、溶度积和溶度积规则例1:完成难溶物CaCO3、Ag2CrO4、Mg(OH)2在水中的沉淀溶解平衡的关系式和溶度积。 已知AgCl 298K时在水中溶解了1.92×10-3g·L-1,计算其Ksp。解:AgCl的摩尔质量= 143.5 g · mol-1
c = 1.92×10-3/143.5
= 1.34 ×10-5 (mol·L-1)
Ksp = c2 = 1.8×10-10例2:溶度积与离子浓度的换算:1、沉淀的生成二、沉淀反应的应用例1:将4×10-3mol?L-1的AgNO3溶液与4×10-3mol?L-1的NaCl溶液等体积混合能否有沉淀析出?Ksp(AgCl)= 1.8×10-10C(Ag+)=2 ×10-3, c(Cl-)= 2 ×10-3
Qc=2 ×10-3× 2 ×10-3
=4.0 ×10-6 >1.8×10-10Qc>Ksp,所以有AgCl沉淀析出。例2:取5ml0.002mol·L-1 BaCl2与等体积的0.02mol·L-1Na2SO4的混合,计算Ba2+是否沉淀完全[即c(Ba2+ )<10-5mol·L-1]?
BaSO4的 Ksp=1.1×10-10.)Ksp ≈ 0.009· c(Ba2+) = 1.1×10-10
c(Ba2+) =1.2×10-8(mol·L-1) <10-5mol·L-1
Ba2+已沉淀完全。SO42-过量0.009mol/L解:SO42-+Ba2+ BaSO4↓例3:课本P83硫酸铜中除少量Fe3+的方法在1mol·L-1CuSO4溶液中含有少量的Fe3+ 杂质,pH值控制在什么范 围才能除去Fe3+ ?
[使c(Fe3+) ≤ 10-5mol·L-1]解:Fe (OH)3 Fe3+ + 3OH –
Ksp = c(Fe3+ )c3(OH–) = 2.6×10-39 Fe(OH)3的 Ksp=2.6×10-39,Cu(OH)2 的Ksp= 5.6×10-20pH = 2.8 pH > 2.8Cu(OH)2 Cu 2+ + 2OH –
Ksp = c(Cu 2+ )c2(OH –) = 5.6×10-20 pH = 4.4
控制 pH:2.8 ~ 4.4 . 分步沉淀
在相同浓度的Cl-、Br-、I- 的溶液中逐滴加入AgNO3 溶液,AgI最先沉淀,其次是AgBr, 最后是AgCl。因为:Ksp(AgI) < Ksp(AgBr) < Ksp(AgCl)2、沉淀的溶解 根据平衡移动原理,对于在水中难溶的电解质,如果能设法不断移去溶解平衡体系中的相应离子,使平衡向沉淀溶解的方向移动,就可以使沉淀溶解。例如难溶于水的CaCO3沉淀可以溶于盐酸中:CaCO3 Ca2++CO32-+H+HCO3- H2CO3 →H2O+CO2↑课本P86溶洞的形成也是这样的道理3、沉淀的转化 对于一些用酸或其他方法也不能溶解的沉淀,可以先将其转化为另一种用酸或其他方法能溶解的沉淀.锅炉中水垢中含有CaSO4 ,可先用Na2CO3溶液处理,使 之转化为疏松、易溶于酸的CaCO3。CaSO4 SO42- + Ca2+ +
CO32-CaCO3例4:过量AgCl溶解在下列各种物质中,问哪
种溶液中c(Ag+)最小 ( )
A. 100mL水 B. 1000mL水
C. 100mL0.2mol·L-1KCl溶液
D. 1000mL0.5mol·L-1KNO3溶液例5:下列说法中正确的是( )
A.不溶于不的物质溶解度为0
B.绝对不溶解的物质是不存在的
C.某离子被沉淀完全是指该离子在溶液中的浓度为0
D.物质的溶解性为难溶,则该物质不溶于水B例6:试利用平衡移动原理解释下列事实:
(1)FeS不溶于水,但能溶于稀盐酸中
(2)CaCO3难溶于稀硫酸,却能溶于醋酸中
(3)分别用等体积的蒸馏水和0.010mol/L硫酸洗涤BaSO4沉淀,用水洗涤造成BaSO4的损失量大于用稀硫酸洗涤的损失量
