第三单元 盐类的水解(浙江省杭州市)
图片预览










文档简介
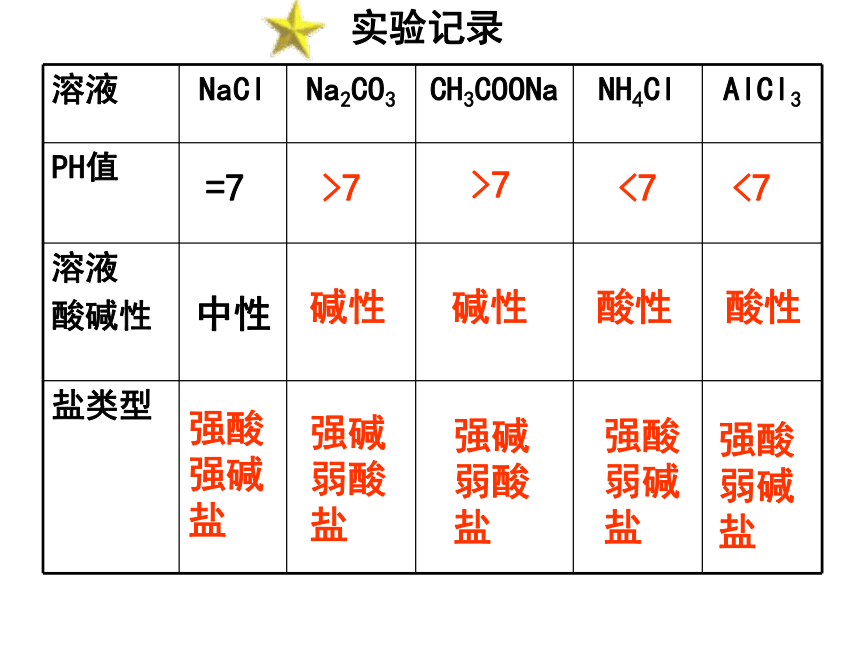
课件35张PPT。专题3 溶液中的离子反应第三单元 盐类的水解第一幕 寻找规律【课堂实验】用PH试纸分别测定 NaCl 、 Na2CO3、 CH3COONa 、
NH4Cl、Al2(SO4)3、溶液的酸碱性。实验目的:测定不同盐溶液的酸碱性及盐溶液的酸碱性与盐的类型间的关系。
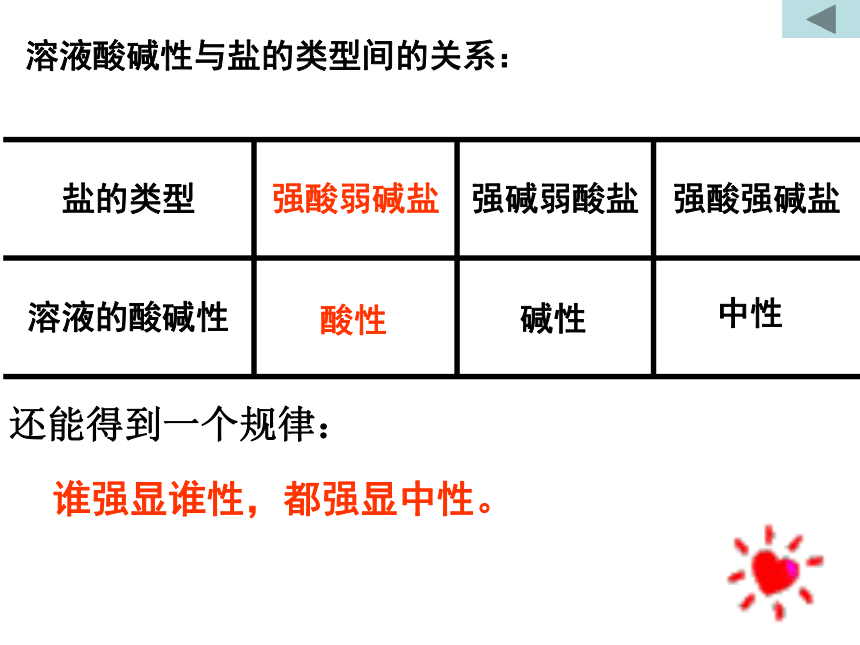
实验用具:PH试纸,比色卡,玻璃棒,试剂。实验步骤:用玻璃棒蘸取少量溶液,涂在PH试纸上,然后将显示出的颜色与比色卡对照,再将所得的PH数值填写在表格中。归纳实验结论。实验记录中性 =7强酸强碱盐碱性>7强碱弱酸盐>7碱性强碱弱酸盐酸性<7强酸弱碱盐<7强酸弱碱盐酸性溶液酸碱性与盐的类型间的关系:酸性碱性中性还能得到一个规律:谁强显谁性,都强显中性。第二幕 探究原因(1)CH3COONa溶液中存在着几种离子?
(2)哪些离子可能相互结合,对水的电离平衡有何影响?
(3)为什么CH3COONa溶液显碱性?探讨与交流 :以CH3COONa溶液例 大多数盐,既不会电离出H+,也不会电离出OH-,为什么也会显示出酸碱性?疑问?盐类水解的定义: 在盐溶液中,盐电离出的离子(弱酸阴离子或弱碱阳离子)跟水所电离出的H+或OH-结合生成弱电解质分子的反应就叫做盐类的水解。 第三幕 得出结论2、NH4Cl等强酸弱碱盐,其中发生水解的离子为________,溶液显_____性;CH3COONa等强碱弱酸盐中,发生水解的离子_________,溶液显_____性。
可总结为:谁____谁水解,谁____显谁性。分析:1、NaCl能否水解,NaCl溶液为什么显中性?水解的条件:水解的实质:破坏了水的电离平衡,
促进了水的电离。水解的规律:谁弱谁水解,无弱不水解,谁强显谁性,都强显中性。在水溶液中、易溶于水、电离出弱酸阴离子或弱碱阳离子。常见的弱酸阴离子:CH3COO - 、CO3 2- 、F - 、S 2- 等
常见的弱碱阳离子:NH4+ 、Al3+ 、Cu2+ 、Fe3+ 、Ag+等1. 下列溶液PH小于7的是 A、KBr B、CuSO4 C、NaF D、Ba(NO3)2
2.下列离子在水溶液中不会发生水解的是 A 、 NH4+ B、 SO42_ C 、 Al3+ D 、 F_练习:3.? 氯化铵溶液中离子浓度从大到小排列正确的是:A NH4+ 、H + 、OH-、Cl_
B Cl _ 、 NH4+ 、H + 、OH _
C H +、 Cl_ 、 NH4+ 、OH _
D Cl、 NH4+ 、 OH- 、H +1、盐类水解的特点:⑴是中和反应的逆反应,存在水解平衡⑵是吸热反应,升温促进水解(4)水解程度很小,故水解产物极少,盐溶液的酸碱性极弱水解反应的表示(P75)2、水解离子方程式的书写 2、一般不用“ ↑、↓ ”3、多元弱酸根离子的水解分步写,一般只写第一步4、多元弱碱阳离子的水解一步到位(3)稀释促进水解练一练:1 判断下列溶液的酸碱性,能水解的写出其水解离子方程式
(1)FeCl3 (2) NaF (3)CuSO4
(4)K2CO3 (5)KI (6)Al2(SO4)3 C、NaNO3 向水中加入下列哪些物质,可使水的电离平衡发生移动?怎样移动?抑制水的电离促进水的电离不 移 动抑制水的电离促进水的电离A、H2SO4习 题 1 :B、FeCl3E、KOHD、K2CO3下列盐的水溶液中,离子浓度比正确的是: D、NaF c(Na+) : c(F-) < 1 : 1B、K2SO4 c(K+) : c(SO42-) = 2 : 1C、(NH4)2SO4 c(NH4+) : c(SO42-) < 2 : 1A、NaClO c(Na+) : c(ClO-) = 1 : 1习 题 2 :B C影响盐类水解的因素影响盐类水解的主要因素是盐本身的性质。另外还受外在因素影响:
1、温度:盐的水解反应是吸热反应,升高温度水解程度增大。
2、浓度:盐的浓度越小,一般水解程度越大。加水稀释盐的溶液,可以促进水解。
3、溶液的酸、碱性:盐类水解后,溶液会呈不同的酸、碱性,因此控制溶液的酸、碱性,可以促进或抑制盐的水解,故在盐溶液中加入酸或碱都能影响盐的水解。 思考:正反应增加降增大颜色变深逆反应正反应逆反应正反应增加增加减少减少降升升升减小增大减小增大颜色变浅颜色变浅颜色变浅红褐色沉淀,无色气体相同浓度的下列溶液中,[CO32-]的大小关系依次为( )
①Na2CO3 ②NaHCO3 ③H2CO3
盐类水解第二课时复习上一节课的内容一、盐类水解的定义有弱必水解,无弱不水解;越弱越水解,弱弱双水解;
谁强显谁性,强强定中性;越稀越水解,越高越水解; 二、水解的特点:三、水解反应的方程式书写 CuCl2,NaF,NH4Cl,Na2CO3,Mg3N2,Al2S3是中和反应的逆反应,升温促进水解稀释促进水解,水解程度很小四、水解平衡的影响因素(一)内因:盐的本性(越弱越水解)其酸性越弱酸越难电离酸根离子与H+的
结 合 能 力 越 强水解后OH-浓度越大溶液碱性越强pH值越大①不同弱酸对应的盐NaClO> NaHCO3NH4Cl< MgCl2 Mg(OH)2 > Al(OH)3③同一弱酸对应的盐碱 性:对应的酸:Na2CO3 > NaHCO3HCO3 - 酸式盐的水解程度④多元弱酸对应的酸式盐:
Na2SO3>Na2SO4 >NaHSO3 >NaHSO4Na3PO4>Na2HPO4>NaH2PO4 >H3PO4除NaH2PO4和NaHSO3 是电离大于水解外,其余的均为水解大于电离。能生成沉淀或气体的双水解可以进行到底⑤弱酸弱碱盐:水解程度较大。(二)外因:符合勒夏特列原理。1、温度:升温促进水解,降温抑制水解。CH3COONa的酚酞溶液加热后颜色:加深2、浓度:稀释促进水解3、加酸或碱(一) 判断溶液的酸碱性(相同温度、浓度下)NaHCO3 Na2CO3 NaClO Na2SO4 Na2HPO4 NaH2PO4 NaHSO3 NaHSO4 AgNO3 CH3COONH4 (二) 某些盐的无水物,不能用蒸发溶液或灼烧晶体的方法制取。五、盐类水解的应用(定性)FeCl3 溶液→ Fe(NO3)3 溶液→
Na2CO3 溶液→ CuSO4·5H2O →
Fe2(SO4)3 溶液→
Na2SO3 溶液→ Ca(HCO3)2 溶液→Fe2O3Fe2O3Na2CO3CuSO4Fe2(SO4)3Na2SO4CaO(三) 某些盐溶液的配制与保存:FeCl3 :加少量稀盐酸FeCl2 :加少量稀盐酸和铁屑加相应的酸或碱,以抑制水解。配制FeCl2加入Fe是为了防止Fe2+氧化成Fe3+:思考:Na2CO3、Na2SiO3、Na3PO4等溶液的保存能否在磨口试剂瓶中?并说明原因?4Fe2++O2+4H+==4Fe3++2H2ONH4F溶液 :铅容器或塑料瓶。Fe + 2Fe3+ == 2Fe2+(四) 某些物质的用途1、用盐作净水剂:明矾、FeCl3等胶体可以吸附不溶性杂质。2、用盐作洗涤剂:Na2CO3、C17H35COONa等加热:平衡正向移动,碱性增强,去污效果好。3、除杂:除去KNO3溶液中少量的Fe3+离子可用加热的方法?草木灰不能和铵态氮肥混合使用,为什么?4、肥料的混用 “焊药”—金属焊接时常用于除去金属表面的氧化膜,常用ZnCl2、NH4Cl。5、Al2(SO4)3和NaHCO3溶液反应:
双水解反应----用于泡沫灭火器。Al3+ + 3HCO3 - =Al(OH)3 ↓ + 3CO2↑ 灭火器原理泡沫灭火器里的药品是NaHCO3溶液和Al2(SO4)3溶液。 (五) 溶液中微粒浓度以CH3COONa为例说明:1、一个不等式(除水外):c(Na+) >c(CH3COO -) >c(OH-)> c(CH3COOH)>c (H+) 2、三个守恒:(1)物料守恒:(2)电荷守恒:c(Na+) +c(H+)=c(CH3COO - ) +c(OH-)c(Na+) =c(CH3COO-) +c(CH3COOH)(3)水电离的H+ 与OH-守恒:CH3COONa溶液中c(OH-) =c(H+) + c(CH3COOH)Na2S溶液c(Na+ ) +c(H+) = c(OH-) +2c(S 2- ) +c(HS - )c(OH-) = c(H+) +c (HS - ) + 2c(H2S ) c(Na+ ) =2c(S 2- ) +2c(HS - ) +2c(H2S )NaHCO3溶液c(Na+ ) =c(HCO3-) +c(H2CO3) +c(CO32 -)c(Na+) +c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)c(OH-) = c(H+) + c(H2CO3 )例1、在CH3COONa溶液中滴加醋酸,溶液的酸碱性如何变化?碱性→中性→酸性pH=7时,c(Ac-)=c(Na+ )例2、强酸与弱碱的反应或弱酸与强碱的反应,溶液的酸碱性如何变化?注意:“恰好完全反应”与“溶液呈中性”两句话的区别。恰好完全反应:pH不等于7,n反应物相等溶液呈中性:pH=7,n弱的反应物大于n强的反应物有关指示剂的选择终点的PH甲基橙酚酞酚酞或甲基橙所选指示剂pH=7pH<7pH>7例3、下列说法与盐的水解无关的是 ( ) ①明矾可以做净水剂; ②实验室配制FeCl3溶液时,溶液时往往在FeCl3溶液中加入少量的盐酸; ③用NaHCO3和Al2(SO4)3两种溶液可作泡沫灭火剂; ④在NH4Cl溶液中加入金属镁会产生氢气; ⑤草木灰与氨态氮肥不能混合施用; ⑥比较NH4Cl和Na2S等某些盐溶液的酸碱性
A. ① ③ ⑥ B. ② ③ ⑤
C. ③ ④ ⑤ D.全有关D例4、表示0.1mol/LNaHCO3溶液中有关微粒的关系式,正确的是( ) A.c(Na+)>c(HCO3-)>c(CO32-)>c( H+)>c(OH-) B. c(Na+) +c( H+) =c(HCO3-)+ c(CO32-) +c(OH-) C. c(Na+) +c( H+) =c(HCO3-)+2c(CO32-)+c(OH-) D. c(Na+) =c (HCO3-) +c (CO32-) +c(H2CO3) CD 例5、在硫化钠溶液中存在多种离子和分子,下列关系正确的是( ) A.c(Na+)>c(S2-)>c(OH-)>c(HS-) B.c(OH-)=2c(HS-)+c(H+)+c(H2S) C. c(OH-) =c(HS-) +c(H+) +c(H2S) D. c(Na+)+c(H+)=c (OH-) +c(HS-) +c(S2-)A例6、将10mL0.1mol/L氨水和10mL0.1mol/L盐酸混合后, 溶液里各种离子物质的量浓度的关系是 ( ) A.c(Cl--)+c(OH--)=c(NH4+)+c(H+) B. c(Cl--)> c(NH4+)> c(H+) > c(OH-) C. c(H+) >c (OH--)> c(Cl--)> c(NH4+) D. c(Cl--)> c(H+) > c(NH4+)>c (OH-)AB例7、⑴将pH=3的盐酸和pH=11的氨水等体积混合后,溶液中离子浓度大小关系是
c(NH4+)>c(Cl-)>c(OH-)>c(H+)⑵0.1mol/LNaOH和0.2mol/LCH3COOH等体积混合后溶液中各离子浓度由大到小的顺序是c(CH3COO- )>c(Na+)>c( H+)>c(OH-)例8、物质的量浓度相同的下列物质,其离子浓度的比较中错误 的是( )
A.c(PO43-):Na3PO4 > Na2HPO4 > NaH2PO4 > H3PO4
B.c(CO32-): (NH4)2CO3>Na2CO3>NaHCO3>NH4HCO3
C.c(NH4+):
(NH4)2SO4 > (NH4)2CO3 > NH4HSO4 > NH4Cl
D. c (S2-):Na2S > H2S > NaHS > (NH4)2SBD
NH4Cl、Al2(SO4)3、溶液的酸碱性。实验目的:测定不同盐溶液的酸碱性及盐溶液的酸碱性与盐的类型间的关系。
实验用具:PH试纸,比色卡,玻璃棒,试剂。实验步骤:用玻璃棒蘸取少量溶液,涂在PH试纸上,然后将显示出的颜色与比色卡对照,再将所得的PH数值填写在表格中。归纳实验结论。实验记录中性 =7强酸强碱盐碱性>7强碱弱酸盐>7碱性强碱弱酸盐酸性<7强酸弱碱盐<7强酸弱碱盐酸性溶液酸碱性与盐的类型间的关系:酸性碱性中性还能得到一个规律:谁强显谁性,都强显中性。第二幕 探究原因(1)CH3COONa溶液中存在着几种离子?
(2)哪些离子可能相互结合,对水的电离平衡有何影响?
(3)为什么CH3COONa溶液显碱性?探讨与交流 :以CH3COONa溶液例 大多数盐,既不会电离出H+,也不会电离出OH-,为什么也会显示出酸碱性?疑问?盐类水解的定义: 在盐溶液中,盐电离出的离子(弱酸阴离子或弱碱阳离子)跟水所电离出的H+或OH-结合生成弱电解质分子的反应就叫做盐类的水解。 第三幕 得出结论2、NH4Cl等强酸弱碱盐,其中发生水解的离子为________,溶液显_____性;CH3COONa等强碱弱酸盐中,发生水解的离子_________,溶液显_____性。
可总结为:谁____谁水解,谁____显谁性。分析:1、NaCl能否水解,NaCl溶液为什么显中性?水解的条件:水解的实质:破坏了水的电离平衡,
促进了水的电离。水解的规律:谁弱谁水解,无弱不水解,谁强显谁性,都强显中性。在水溶液中、易溶于水、电离出弱酸阴离子或弱碱阳离子。常见的弱酸阴离子:CH3COO - 、CO3 2- 、F - 、S 2- 等
常见的弱碱阳离子:NH4+ 、Al3+ 、Cu2+ 、Fe3+ 、Ag+等1. 下列溶液PH小于7的是 A、KBr B、CuSO4 C、NaF D、Ba(NO3)2
2.下列离子在水溶液中不会发生水解的是 A 、 NH4+ B、 SO42_ C 、 Al3+ D 、 F_练习:3.? 氯化铵溶液中离子浓度从大到小排列正确的是:A NH4+ 、H + 、OH-、Cl_
B Cl _ 、 NH4+ 、H + 、OH _
C H +、 Cl_ 、 NH4+ 、OH _
D Cl、 NH4+ 、 OH- 、H +1、盐类水解的特点:⑴是中和反应的逆反应,存在水解平衡⑵是吸热反应,升温促进水解(4)水解程度很小,故水解产物极少,盐溶液的酸碱性极弱水解反应的表示(P75)2、水解离子方程式的书写 2、一般不用“ ↑、↓ ”3、多元弱酸根离子的水解分步写,一般只写第一步4、多元弱碱阳离子的水解一步到位(3)稀释促进水解练一练:1 判断下列溶液的酸碱性,能水解的写出其水解离子方程式
(1)FeCl3 (2) NaF (3)CuSO4
(4)K2CO3 (5)KI (6)Al2(SO4)3 C、NaNO3 向水中加入下列哪些物质,可使水的电离平衡发生移动?怎样移动?抑制水的电离促进水的电离不 移 动抑制水的电离促进水的电离A、H2SO4习 题 1 :B、FeCl3E、KOHD、K2CO3下列盐的水溶液中,离子浓度比正确的是: D、NaF c(Na+) : c(F-) < 1 : 1B、K2SO4 c(K+) : c(SO42-) = 2 : 1C、(NH4)2SO4 c(NH4+) : c(SO42-) < 2 : 1A、NaClO c(Na+) : c(ClO-) = 1 : 1习 题 2 :B C影响盐类水解的因素影响盐类水解的主要因素是盐本身的性质。另外还受外在因素影响:
1、温度:盐的水解反应是吸热反应,升高温度水解程度增大。
2、浓度:盐的浓度越小,一般水解程度越大。加水稀释盐的溶液,可以促进水解。
3、溶液的酸、碱性:盐类水解后,溶液会呈不同的酸、碱性,因此控制溶液的酸、碱性,可以促进或抑制盐的水解,故在盐溶液中加入酸或碱都能影响盐的水解。 思考:正反应增加降增大颜色变深逆反应正反应逆反应正反应增加增加减少减少降升升升减小增大减小增大颜色变浅颜色变浅颜色变浅红褐色沉淀,无色气体相同浓度的下列溶液中,[CO32-]的大小关系依次为( )
①Na2CO3 ②NaHCO3 ③H2CO3
盐类水解第二课时复习上一节课的内容一、盐类水解的定义有弱必水解,无弱不水解;越弱越水解,弱弱双水解;
谁强显谁性,强强定中性;越稀越水解,越高越水解; 二、水解的特点:三、水解反应的方程式书写 CuCl2,NaF,NH4Cl,Na2CO3,Mg3N2,Al2S3是中和反应的逆反应,升温促进水解稀释促进水解,水解程度很小四、水解平衡的影响因素(一)内因:盐的本性(越弱越水解)其酸性越弱酸越难电离酸根离子与H+的
结 合 能 力 越 强水解后OH-浓度越大溶液碱性越强pH值越大①不同弱酸对应的盐NaClO> NaHCO3NH4Cl< MgCl2
Na2SO3>Na2SO4 >NaHSO3 >NaHSO4Na3PO4>Na2HPO4>NaH2PO4 >H3PO4除NaH2PO4和NaHSO3 是电离大于水解外,其余的均为水解大于电离。能生成沉淀或气体的双水解可以进行到底⑤弱酸弱碱盐:水解程度较大。(二)外因:符合勒夏特列原理。1、温度:升温促进水解,降温抑制水解。CH3COONa的酚酞溶液加热后颜色:加深2、浓度:稀释促进水解3、加酸或碱(一) 判断溶液的酸碱性(相同温度、浓度下)NaHCO3 Na2CO3 NaClO Na2SO4 Na2HPO4 NaH2PO4 NaHSO3 NaHSO4 AgNO3 CH3COONH4 (二) 某些盐的无水物,不能用蒸发溶液或灼烧晶体的方法制取。五、盐类水解的应用(定性)FeCl3 溶液→ Fe(NO3)3 溶液→
Na2CO3 溶液→ CuSO4·5H2O →
Fe2(SO4)3 溶液→
Na2SO3 溶液→ Ca(HCO3)2 溶液→Fe2O3Fe2O3Na2CO3CuSO4Fe2(SO4)3Na2SO4CaO(三) 某些盐溶液的配制与保存:FeCl3 :加少量稀盐酸FeCl2 :加少量稀盐酸和铁屑加相应的酸或碱,以抑制水解。配制FeCl2加入Fe是为了防止Fe2+氧化成Fe3+:思考:Na2CO3、Na2SiO3、Na3PO4等溶液的保存能否在磨口试剂瓶中?并说明原因?4Fe2++O2+4H+==4Fe3++2H2ONH4F溶液 :铅容器或塑料瓶。Fe + 2Fe3+ == 2Fe2+(四) 某些物质的用途1、用盐作净水剂:明矾、FeCl3等胶体可以吸附不溶性杂质。2、用盐作洗涤剂:Na2CO3、C17H35COONa等加热:平衡正向移动,碱性增强,去污效果好。3、除杂:除去KNO3溶液中少量的Fe3+离子可用加热的方法?草木灰不能和铵态氮肥混合使用,为什么?4、肥料的混用 “焊药”—金属焊接时常用于除去金属表面的氧化膜,常用ZnCl2、NH4Cl。5、Al2(SO4)3和NaHCO3溶液反应:
双水解反应----用于泡沫灭火器。Al3+ + 3HCO3 - =Al(OH)3 ↓ + 3CO2↑ 灭火器原理泡沫灭火器里的药品是NaHCO3溶液和Al2(SO4)3溶液。 (五) 溶液中微粒浓度以CH3COONa为例说明:1、一个不等式(除水外):c(Na+) >c(CH3COO -) >c(OH-)> c(CH3COOH)>c (H+) 2、三个守恒:(1)物料守恒:(2)电荷守恒:c(Na+) +c(H+)=c(CH3COO - ) +c(OH-)c(Na+) =c(CH3COO-) +c(CH3COOH)(3)水电离的H+ 与OH-守恒:CH3COONa溶液中c(OH-) =c(H+) + c(CH3COOH)Na2S溶液c(Na+ ) +c(H+) = c(OH-) +2c(S 2- ) +c(HS - )c(OH-) = c(H+) +c (HS - ) + 2c(H2S ) c(Na+ ) =2c(S 2- ) +2c(HS - ) +2c(H2S )NaHCO3溶液c(Na+ ) =c(HCO3-) +c(H2CO3) +c(CO32 -)c(Na+) +c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)c(OH-) = c(H+) + c(H2CO3 )例1、在CH3COONa溶液中滴加醋酸,溶液的酸碱性如何变化?碱性→中性→酸性pH=7时,c(Ac-)=c(Na+ )例2、强酸与弱碱的反应或弱酸与强碱的反应,溶液的酸碱性如何变化?注意:“恰好完全反应”与“溶液呈中性”两句话的区别。恰好完全反应:pH不等于7,n反应物相等溶液呈中性:pH=7,n弱的反应物大于n强的反应物有关指示剂的选择终点的PH甲基橙酚酞酚酞或甲基橙所选指示剂pH=7pH<7pH>7例3、下列说法与盐的水解无关的是 ( ) ①明矾可以做净水剂; ②实验室配制FeCl3溶液时,溶液时往往在FeCl3溶液中加入少量的盐酸; ③用NaHCO3和Al2(SO4)3两种溶液可作泡沫灭火剂; ④在NH4Cl溶液中加入金属镁会产生氢气; ⑤草木灰与氨态氮肥不能混合施用; ⑥比较NH4Cl和Na2S等某些盐溶液的酸碱性
A. ① ③ ⑥ B. ② ③ ⑤
C. ③ ④ ⑤ D.全有关D例4、表示0.1mol/LNaHCO3溶液中有关微粒的关系式,正确的是( ) A.c(Na+)>c(HCO3-)>c(CO32-)>c( H+)>c(OH-) B. c(Na+) +c( H+) =c(HCO3-)+ c(CO32-) +c(OH-) C. c(Na+) +c( H+) =c(HCO3-)+2c(CO32-)+c(OH-) D. c(Na+) =c (HCO3-) +c (CO32-) +c(H2CO3) CD 例5、在硫化钠溶液中存在多种离子和分子,下列关系正确的是( ) A.c(Na+)>c(S2-)>c(OH-)>c(HS-) B.c(OH-)=2c(HS-)+c(H+)+c(H2S) C. c(OH-) =c(HS-) +c(H+) +c(H2S) D. c(Na+)+c(H+)=c (OH-) +c(HS-) +c(S2-)A例6、将10mL0.1mol/L氨水和10mL0.1mol/L盐酸混合后, 溶液里各种离子物质的量浓度的关系是 ( ) A.c(Cl--)+c(OH--)=c(NH4+)+c(H+) B. c(Cl--)> c(NH4+)> c(H+) > c(OH-) C. c(H+) >c (OH--)> c(Cl--)> c(NH4+) D. c(Cl--)> c(H+) > c(NH4+)>c (OH-)AB例7、⑴将pH=3的盐酸和pH=11的氨水等体积混合后,溶液中离子浓度大小关系是
c(NH4+)>c(Cl-)>c(OH-)>c(H+)⑵0.1mol/LNaOH和0.2mol/LCH3COOH等体积混合后溶液中各离子浓度由大到小的顺序是c(CH3COO- )>c(Na+)>c( H+)>c(OH-)例8、物质的量浓度相同的下列物质,其离子浓度的比较中错误 的是( )
A.c(PO43-):Na3PO4 > Na2HPO4 > NaH2PO4 > H3PO4
B.c(CO32-): (NH4)2CO3>Na2CO3>NaHCO3>NH4HCO3
C.c(NH4+):
(NH4)2SO4 > (NH4)2CO3 > NH4HSO4 > NH4Cl
D. c (S2-):Na2S > H2S > NaHS > (NH4)2SBD
