化学平衡常数(浙江省杭州市)
图片预览






文档简介
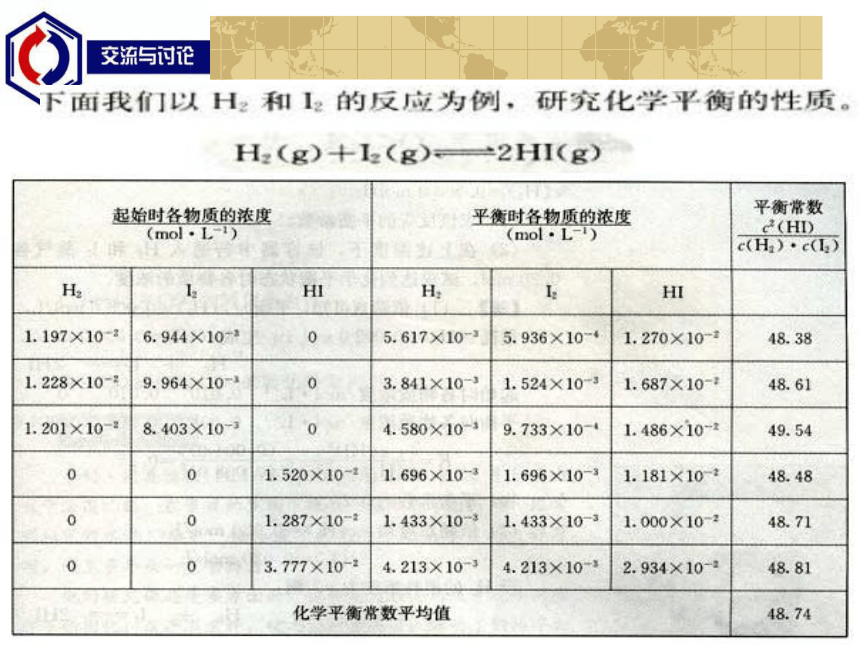
课件17张PPT。化学平衡常数第二单元 化学反应的方向和限度我们知道,在一定条件下的可逆反应存在化学平衡状态。那么,当达到化学平衡状态是,究竟有多少反应物转化成了生成物,平衡体系中各物质的浓度之间是否有一定的关系?请大家完成 P44页的问题解决。
讨论、小结:是一个定值。即:一定温度下,生成物浓度的系数次方的乘积与反应物浓度系数次方的乘积之比为一常数。与反应物或生成物的浓度无关,也与反应是正向进行还是从逆向进行无关化学平衡常数——K其中c为各组分的平衡浓度,温度一定,K为定值。1. K的表达式 大量实验事实表明,对下列可逆反应:
aA + bB cC + dD
在一定温度下,无论反应物的起始浓度如何,反应达到平衡状态后,将各物质的物质的量浓度满足下面关系:N2+3H2 2NH32NH3 N2+ 3H2根据平衡常数的定义,请大家写出下列可逆反应的平衡常数表达式。化学平衡常数2. 使用平衡常数应注意的问题化学平衡常数(1)必须指明温度,反应必须达到平衡状态(2)平衡常数表示反应进行的程度,不表示反应的
快慢,即速率大,K值不一定大(3)在进行K值的计算时,固体、纯液体不作考虑,表达式中不需表达如:一定温度下2.使用平衡常数应注意的问题(4)在进行K值的计算时,稀溶液中的H2O的浓
度可不表达一定温度下化学平衡常数(5)平衡常数的表达式与方程式的书写方式有关K1 = 1/K2 = K322.使用平衡常数应注意的问题例如,在某温度下:N2+3H2 2NH32NH3 N2+3H2化学平衡常数练习(6)利用K 值可判断某状态是否处于平衡状态2.使用平衡常数应注意的问题 K′< K , v正> v逆,反应向正方向进行K′= K , v正= v逆,反应处于平衡状态K′>K , v正< v逆,反应向逆方向进行则:如某温度下,可逆反应mA(g) + nB(g) pC(g) + qD(g)
平衡常数为K,若某时刻时,反应物和生成物的浓度关系如下:化学平衡常数 K值的大小,表示在一定温度下,反应达到平衡时该反应进行的程度(反应的限度)。(1)K值越大,表明反应进行的程度越大;反之则越小,一般K>105时,该反应可以认为反应完全了,若在10-5左右,则认为这个反应很难进行。(2)K值与浓度无关,随温度变化而变化2.平衡常数的意义化学平衡常数aA + bB cC + dD平衡转化率×100%? =反应物的起始浓度-反应物的平衡浓度该反应物的起始浓度可逆反应在一定条件下达到平衡时,某一反应物的平衡转化率为:除了化学平衡常数外,还有没有其他方法能用来表示化学反应进行的限度呢?注意:若用气体,则反应前后要保持压强相同【例1】某温度下,向10L真空容器中注入1.00 mol H2(g) 和 1.00 mol I2(g),反应平衡后H2(g)的浓度为0.0200 mol·L-1。试求该温度下 H2(g)+I2(g) 2HI(g)的平衡常数。平衡常数和转化率的计算H2(g) + I2(g) 2HI(g)起始时各物质的浓度0.100 0.100 0变化的各物质的浓度平衡时各物质的浓度0.0800 0.160 0.0200 0.160 K =(0.160)2(0.0200)2= 64.0 c2(HI) c(H2) · c(I2)=答:平衡常数为64.0。 0.02000.0800【例2】在一密闭容器中,CO与H2O混合加热到800℃达到下列平衡:CO(g)+H2O(g) CO2(g)+H2(g) K=1.00 ,若反应开始时CO和H2O的浓度分别为0.200 mol·L-1 和1.00mol·L-1,求达到平衡时CO转化为CO2转化率是多少?平衡常数和转化率的计算 c(平)/mol·L-1 0.200-x 1.00-x x x 解:设CO反应的浓度为x mol·L-1CO(g) + H2O(g) CO2(g) + H2(g)c(始) /mol·L-1 0.200 1.00 0 0c(变)/mol·L-1 x x x x解得: x = 0.166K =x2(0.200-x)(1.00-x)= 1.00c(CO2) · c(H2) c(CO) ·c(H2O)= 850K时,在一密闭容器中充入一定量的SO2和O2,当反应达到平衡后测得:SO2、O2和SO3的浓度分别为6.0×10-3 mol·L-1 、8.0×10-3 mol·L-1 和 4.4×10-2 mol·L-1。计算:
(1)该温度下反应 的平衡常数。
(2)达平衡状态时, SO2的转化率。2SO2+O2 2SO3平衡常数和转化率的计算例:高炉炼铁中发生的基本反应如下:
FeO(s)+CO(g) Fe(s)+CO2(g)―Q。其平衡常数可表达为: K=c(CO2)/c(CO),已知1100℃,K=0.263
(1)若要使反应向右进行,高炉内CO2和CO的体积比值______,平衡常数K值______(填“增大”“减小”或“不变”)
(2)1100℃时,测得高炉中c(CO2)=0.025mol·L-1,c(CO)=0.1mol·L-1,在这种情况下该反应是否处于平衡状态_______(填“是”或“否”),此时化学反应速率是V正____V逆(填“大于”、“小于”或“等于”),其原因是
。增大不变否大于c(CO2)/c(CO)=0.25<0.263,说明不是平衡状态,且向正反应方向进行 平衡常数和转化率的计算
讨论、小结:是一个定值。即:一定温度下,生成物浓度的系数次方的乘积与反应物浓度系数次方的乘积之比为一常数。与反应物或生成物的浓度无关,也与反应是正向进行还是从逆向进行无关化学平衡常数——K其中c为各组分的平衡浓度,温度一定,K为定值。1. K的表达式 大量实验事实表明,对下列可逆反应:
aA + bB cC + dD
在一定温度下,无论反应物的起始浓度如何,反应达到平衡状态后,将各物质的物质的量浓度满足下面关系:N2+3H2 2NH32NH3 N2+ 3H2根据平衡常数的定义,请大家写出下列可逆反应的平衡常数表达式。化学平衡常数2. 使用平衡常数应注意的问题化学平衡常数(1)必须指明温度,反应必须达到平衡状态(2)平衡常数表示反应进行的程度,不表示反应的
快慢,即速率大,K值不一定大(3)在进行K值的计算时,固体、纯液体不作考虑,表达式中不需表达如:一定温度下2.使用平衡常数应注意的问题(4)在进行K值的计算时,稀溶液中的H2O的浓
度可不表达一定温度下化学平衡常数(5)平衡常数的表达式与方程式的书写方式有关K1 = 1/K2 = K322.使用平衡常数应注意的问题例如,在某温度下:N2+3H2 2NH32NH3 N2+3H2化学平衡常数练习(6)利用K 值可判断某状态是否处于平衡状态2.使用平衡常数应注意的问题 K′< K , v正> v逆,反应向正方向进行K′= K , v正= v逆,反应处于平衡状态K′>K , v正< v逆,反应向逆方向进行则:如某温度下,可逆反应mA(g) + nB(g) pC(g) + qD(g)
平衡常数为K,若某时刻时,反应物和生成物的浓度关系如下:化学平衡常数 K值的大小,表示在一定温度下,反应达到平衡时该反应进行的程度(反应的限度)。(1)K值越大,表明反应进行的程度越大;反之则越小,一般K>105时,该反应可以认为反应完全了,若在10-5左右,则认为这个反应很难进行。(2)K值与浓度无关,随温度变化而变化2.平衡常数的意义化学平衡常数aA + bB cC + dD平衡转化率×100%? =反应物的起始浓度-反应物的平衡浓度该反应物的起始浓度可逆反应在一定条件下达到平衡时,某一反应物的平衡转化率为:除了化学平衡常数外,还有没有其他方法能用来表示化学反应进行的限度呢?注意:若用气体,则反应前后要保持压强相同【例1】某温度下,向10L真空容器中注入1.00 mol H2(g) 和 1.00 mol I2(g),反应平衡后H2(g)的浓度为0.0200 mol·L-1。试求该温度下 H2(g)+I2(g) 2HI(g)的平衡常数。平衡常数和转化率的计算H2(g) + I2(g) 2HI(g)起始时各物质的浓度0.100 0.100 0变化的各物质的浓度平衡时各物质的浓度0.0800 0.160 0.0200 0.160 K =(0.160)2(0.0200)2= 64.0 c2(HI) c(H2) · c(I2)=答:平衡常数为64.0。 0.02000.0800【例2】在一密闭容器中,CO与H2O混合加热到800℃达到下列平衡:CO(g)+H2O(g) CO2(g)+H2(g) K=1.00 ,若反应开始时CO和H2O的浓度分别为0.200 mol·L-1 和1.00mol·L-1,求达到平衡时CO转化为CO2转化率是多少?平衡常数和转化率的计算 c(平)/mol·L-1 0.200-x 1.00-x x x 解:设CO反应的浓度为x mol·L-1CO(g) + H2O(g) CO2(g) + H2(g)c(始) /mol·L-1 0.200 1.00 0 0c(变)/mol·L-1 x x x x解得: x = 0.166K =x2(0.200-x)(1.00-x)= 1.00c(CO2) · c(H2) c(CO) ·c(H2O)= 850K时,在一密闭容器中充入一定量的SO2和O2,当反应达到平衡后测得:SO2、O2和SO3的浓度分别为6.0×10-3 mol·L-1 、8.0×10-3 mol·L-1 和 4.4×10-2 mol·L-1。计算:
(1)该温度下反应 的平衡常数。
(2)达平衡状态时, SO2的转化率。2SO2+O2 2SO3平衡常数和转化率的计算例:高炉炼铁中发生的基本反应如下:
FeO(s)+CO(g) Fe(s)+CO2(g)―Q。其平衡常数可表达为: K=c(CO2)/c(CO),已知1100℃,K=0.263
(1)若要使反应向右进行,高炉内CO2和CO的体积比值______,平衡常数K值______(填“增大”“减小”或“不变”)
(2)1100℃时,测得高炉中c(CO2)=0.025mol·L-1,c(CO)=0.1mol·L-1,在这种情况下该反应是否处于平衡状态_______(填“是”或“否”),此时化学反应速率是V正____V逆(填“大于”、“小于”或“等于”),其原因是
。增大不变否大于c(CO2)/c(CO)=0.25<0.263,说明不是平衡状态,且向正反应方向进行 平衡常数和转化率的计算
