鲁科版高中化学必修一第二章《元素与物质世界》单元测试题(解析版)
文档属性
| 名称 | 鲁科版高中化学必修一第二章《元素与物质世界》单元测试题(解析版) |  | |
| 格式 | zip | ||
| 文件大小 | 113.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-12-28 21:21:11 | ||
图片预览




文档简介
第二章《元素与物质世界》单元测试题
一、单选题(每小题只有一个正确答案)
1.难溶于水的金属氧化物是( )
A.SiO2 B.CO2 C.Na2O2 D.MnO2
2.下列物质是你在生活中经常用到的物质,其中属于纯净物的是( )
A. 煤 B. 生铁 C. 蒸馏水 D. 矿泉水
3.下表是某矿泉水的部分标签说明
主要成分
钾离子 K+ 20~27.3 mg/L
氯离子 Cl- 30~34.2 mg/L
镁离子 Mg2+ 20.2~24.9 mg/L
硫酸根离子SO42- 24~27.5 mg/L
主要成分
钾离子 K+ 20~27.3 mg/L
氯离子 Cl- 30~34.2 mg/L
镁离子 Mg2+ 20.2~24.9 mg/L
硫酸根离子SO42- 24~27.5 mg/L
则该饮用水中还可能较大量存在( )
A. OH- B. Ag+ C. Na+ D. Ca2+
4.下列物质中,其水溶液能导电、溶于水时化学键被破坏,且该物质属于非电解质的是( )
A.I2 B.BaCO3 C.CO2 D.C6H12O6(葡萄糖)
5.中国传统的文房四宝是“笔墨纸砚”,下列对应的主要材料所属物质、物质分类有误的是( )
文房四宝 材料所属物质 物质分类
A 毛笔(纯狼毫) 蛋白质 化学纤维
B 墨 碳 单质
C 宣纸 纤维素 糖
D 石砚 石英、云母、石灰石 氧化物、盐
A. A B. B C. C D. D
6.下列反应的离子方程式正确的是 ( )
A. 电解氯化镁溶液:2Cl-+2H2OCl2↑+H2↑+2OH-
B. 氢氧化铁与足量的氢溴酸溶液反应:Fe(OH)3+3H+=Fe3++3H2O
C. 氢氧化钡溶液中加入硫酸:Ba2++OH—+H++SO42—=BaSO4↓+H2O
D. 鸡蛋壳浸泡在盐酸中产生气泡:CO32—+2H+=CO2↑+H2O
7.Na2FeO4是一种高效多功能水处理剂,应用前景十分看好。一种制备Na2FeO4的方法可用化学方程式表示如下:2FeSO4 + 6Na2O2 = 2Na2FeO4 + 2Na2O + 2Na2SO4 + O2↑,对此反应下列说法中正确的是( )
A.Na2O2只作氧化剂
B.2 mol FeSO4发生反应时,反应中共有8 mol电子转移
C.每生成16g氧气就有1mol Fe2+ 被还原
D.Na2FeO4既是还原产物又是氧化产物
8.下列反应的离子方程式正确的是
A.硝酸银与氯化钠溶液的反应:AgNO3+Cl—=AgCl↓+NO3-
B.硫酸与氢氧化钡溶液反应:H++OH-=H2O
C.氯气与溴化钠溶液反应:C12+2Br-=Br2+2Cl-
D.铝与硫酸铜溶液的反应:Al+Cu2+=Al3++Cu
9.下列反应的离子方程式正确的是 ( )
A. 磁性氧化铁溶于稀硝酸:3FeO+4H++ NO3-=3Fe3++NO↑+2H2O
B. 向含有0.4mol?FeBr2的溶液中通入0.3mol?Cl2充分反应:4Fe2++2Br-+3Cl2═4Fe3++Br2+6Cl-
C. NaAlO2溶液中通入过量CO2:2AlO2—+CO2+3H2O=2Al(OH)3↓+CO32-
D. 向Ba(OH)2溶液中滴加NaHSO4溶液至中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O
10.下列离子方程式书写正确的是
A.实验室制备CO2的反应为:CaCO3+2HCl=CaCl2+H2O+CO2↑
B.向氯化铜溶液中滴加硝酸银溶液:Ag++Cl-=AgCl↓
C.氢氧化钡和稀硫酸反应的离子方程式:Ba2++OH-+H++SO42-=BaSO4↓+H2O
D.稀硫酸滴到铜片上:Cu+2H+=Cu2++H2?
11.菜谱中记载:河虾不能与西红柿同食,主要原因是因为河虾中含有+5价砷(As),西红柿中含有比较多的维生素C,两者同食会产生有毒的+3价砷,下列说法中正确的是( )
A.中毒过程中+5价砷体现出一定的还原性
B.中毒过程中,维生素C作氧化剂
C.因为河虾中含有砷元素,所以不能食用
D.+3价砷具有还原性
12.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A. 在含0.1mol/LHClO溶液中:Cu2+、Fe2+、Cl-、SO42-
B. 水电离产生的c(OH-)=1×10-11 mol·L-1的溶液:Cu2+、SO42-、NO3-、Cl-
C. 中性溶液中:Fe3+、Al3+、NO3-、SO42-
D. 澄清透明溶液中:Cl-、NO3-、Cu2+、NH4+
13.以下成语本意涉及氧化还原反应的是( )
A. 百炼成钢 B. 刻舟求剑 C. 水滴石穿 D. 暗香浮动
14.某同学设计下列方案对A盐的水解液进行鉴定:由此得出的结论中,不正确的是
A. D溶液中存在Fe(SCN)3 B. A一定为无氧酸盐FeBr2 C. B为AgBr D. 滤液中有Fe3+
15.已知下列实验事实:
①Cr2O3固体既能溶于KOH溶液得到KCrO2溶液,又能溶于硫酸得到Cr2(SO4)3溶液;
②向KCrO2溶液中滴加H2O2溶液,再酸化,可得K2Cr2O7溶液;
③将K2Cr2O7溶液滴加到淀粉和KI的混合溶液中,溶液变蓝.
下列判断正确的是( )
A.化合物KCrO2溶于水可电离出Cr3+ B.实验①证明Cr2O3是酸性氧化物
C.实验②证明H2O2既有氧化性又有还原性 D.实验③证明氧化性:Cr2O72﹣>I2
二、填空题
16.现有盐酸、铁、氢气、碳酸氢钠、氢氧化钡。根据要求回答下列问题:
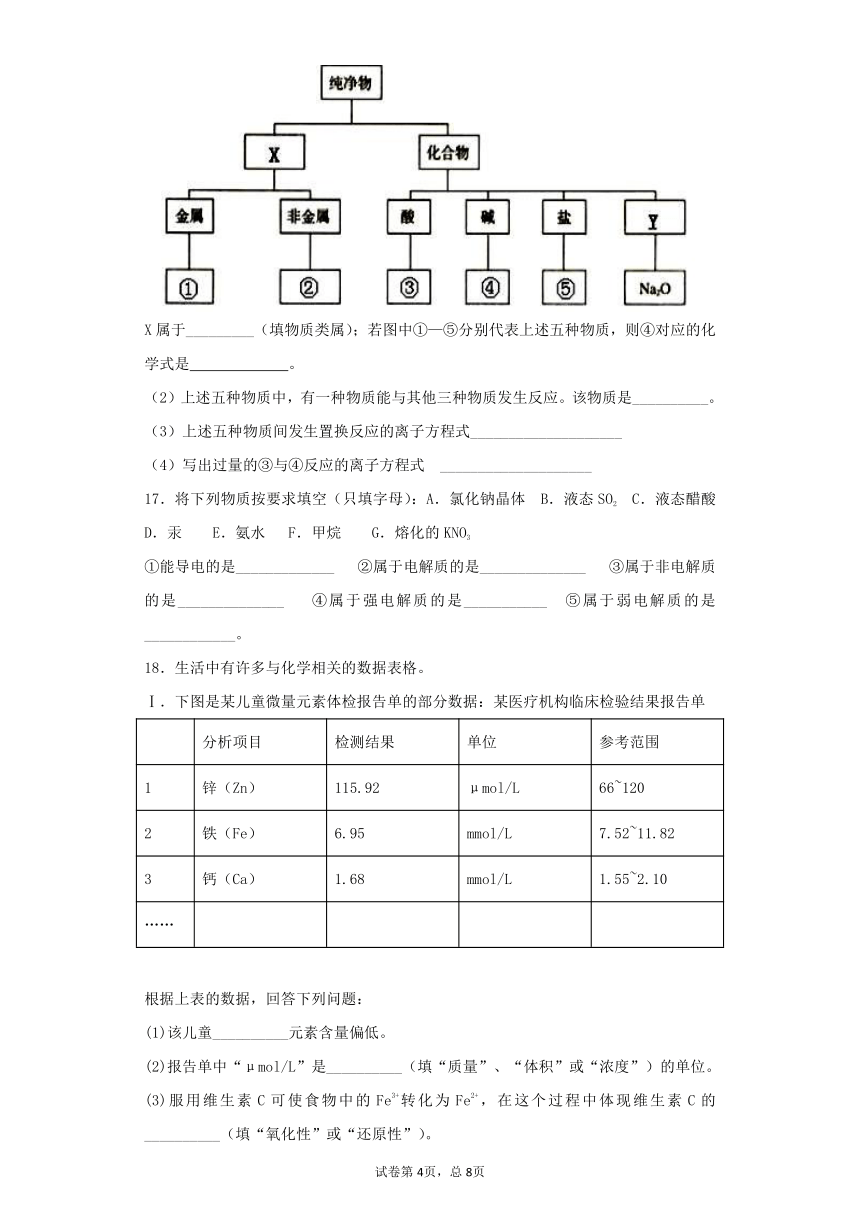
(1)下图为常见物质的树状分类图:
X属于_________(填物质类属);若图中①—⑤分别代表上述五种物质,则④对应的化学式是 。
(2)上述五种物质中,有一种物质能与其他三种物质发生反应。该物质是__________。
(3)上述五种物质间发生置换反应的离子方程式____________________
(4)写出过量的③与④反应的离子方程式 ____________________
17.将下列物质按要求填空(只填字母):A.氯化钠晶体 B.液态SO2 C.液态醋酸 D.汞 E.氨水 F.甲烷 G.熔化的KNO3
①能导电的是_____________ ②属于电解质的是______________ ③属于非电解质的是______________ ④属于强电解质的是___________ ⑤属于弱电解质的是____________。
18.生活中有许多与化学相关的数据表格。
Ⅰ.下图是某儿童微量元素体检报告单的部分数据:某医疗机构临床检验结果报告单
分析项目 检测结果 单位 参考范围
1 锌(Zn) 115.92 μmol/L 66~120
2 铁(Fe) 6.95 mmol/L 7.52~11.82
3 钙(Ca) 1.68 mmol/L 1.55~2.10
……
根据上表的数据,回答下列问题:
(1)该儿童__________元素含量偏低。
(2)报告单中“μmol/L”是__________(填“质量”、“体积”或“浓度”)的单位。
(3)服用维生素C可使食物中的Fe3+转化为Fe2+,在这个过程中体现维生素C的__________(填“氧化性”或“还原性”)。
Ⅱ.生活中为了延长鲜花的寿命,通常会在花瓶中加入鲜花保鲜剂。下表是0.5L某种鲜花保鲜剂中含有的成分及含量,阅读后回答下列问题:
成分 质量(g) 摩尔质量(g/mol)
①蔗糖(C12H22O11) 25.00 342
②硫酸钾(K2SO4) 0.25 174
③高锰酸钾(KMnO4) 0.25 158
④阿司匹林(C9H8O4) 0.17 180
⑤硝酸银(AgNO3) 0.02 170
(4)上述鲜花保鲜剂成分中,属于盐的是__________(填序号)。
(5)欲配制500mL该鲜花保鲜剂,有如下操作步骤:
a.把称量好的保鲜剂放入小烧杯中,加适量蒸馏水溶解;
b.把a所得溶液小心转入500mL容量瓶中;
c.继续向容量瓶中加蒸馏水至液面距刻度1cm~2cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面最低处与刻度线相切;
d.用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤液都小心转入容量瓶,并轻轻摇匀;
e.将容量瓶塞紧,反复上下颠倒摇匀。
①操作步骤的正确顺序为(填序号)__________。
②在容量瓶的使用方法中,下列操作不正确的是__________。
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,需要干燥
C.盖好瓶塞,用一只手的食指顶住瓶塞,另一只手的手指托住瓶底,把容量瓶倒转和摇动几次
(6)写出该鲜花保鲜剂中K+的物质的量浓度的计算式c(K+)=__________ mol·L?1。
19.离子反应和氧化还原反应在生产、生活中应用广泛,用所学知识回答问题:
(1)新制氢氧化亚铁被氧气氧化,其化学方程式为______________。
(2)氯化铝溶液中滴加四羟基合铝酸钠溶液的离子方程式________。
(3)向硫酸铜溶液中逐滴滴加氨水至过量的离子方程式是____、______。
(4)向硫酸铝钾溶液中逐滴加入Ba(OH)2溶液至SO42-全部沉淀时的离子方程式_______;
20.现有以下六种物质:①KNO3;②液态HCl;③铜丝;④NaHCO3;⑤Fe(OH)3胶体;⑥CO2
(1)①既是钾盐又是硝酸盐,对该物质的分类方法是___________________________。
(2)既不是电解质也不是非电解质的是(填序号)___________。
(3)实验室制备Fe(OH)3胶体的化学方程式为________________________。将橘红色的硫化锑(Sb2S3)胶体装入U型管,插入电极后通直流电,发现阳极附近橘红色加深,证明Sb2S3胶粒带_____电荷。Fe(OH)3与硫化锑胶体混合,发现体系变浑浊,这是发生了___________。
(4)胃酸中含有盐酸,NaHCO3能治疗胃酸过多,请写出其反应的离子方程式_____________;若患有胃溃疡,此时最好服用含Al(OH)3的胃药,它与胃酸反应的离子方程式为______________;浑浊石灰水中通入过量的CO2,时发生反应的离子方程式是______________________________。
三、推断题
21.某溶液中可能含有Ag+、Al3+、Ba2+、Mg2+中的一种或几种.根据以下实验所得的现象,将适当的结论填入空格中.
(1)向溶液中加入过量的盐酸,有白色沉淀生成.则肯定含有的离子是______________.离子方程式是______________________;
(2)将(1)所得的溶液过滤后,往滤液中逐渐加入NaOH溶液,有白色沉淀生成,继续加入NaOH溶液,沉淀全部溶解,得到澄清溶液.则又可肯定含有的离子是___________,肯定不含的离子是__________,离子方程式是_________________﹑____________________.
(3)在(2)所得的澄清溶液中加入Na2SO4溶液,产生白色沉淀.则肯定含有的离子是__________________,离子方程式是______________________.
22.有一混合物水溶液,可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Fe3+、CO32—、SO42—,现各取100ml溶液三份进行如下实验:①向第一份加入AgNO3溶液,有白色沉淀产生②向第二份加入足量NaOH溶液后加热,收集到气体0.896L(标准状况)③向第三份加入足量BaCl2溶液,得到沉淀6.27克,沉淀经足量盐酸洗涤后,剩余2.33克。
试回答下列问题:
(1)肯定存在的离子有 ,肯定不存在的离子有 ,
(2)可能存在的离子是 ,
(3)试分别确定肯定存在的阳离子在原溶液中各自的物质的量浓度 。
四、实验题
23.(1)实验室配制500mL 0.2 mol·L-1 FeSO4溶液,需要称量FeSO4·7H2O__________g。
若实验遇到下列情况,对FeSO4溶液的物质的量浓度有何影响?(填“偏高”“偏低”或“不变”)
①用以溶解FeSO4·7H2O烧杯未洗涤,_______________。
②摇匀后发现液面低于刻度线再加水,_________________。
(2)把少量Na2O2投入含有HCO3-、CO32-、S2-、Na+的溶液中,上述溶液中离子数目增加的是________,离子数目减少的是____________。
24.有一瓶澄清的溶液,其中可能含有NH、K+、Ba2+、Al3+、Fe3+、I-、NO、CO、SO、AlO。取该溶液进行以下实验:
①用pH试纸检验,溶液呈强酸性。
②取溶液适量,加入少量CCl4和数滴新制氯水,振荡,CCl4层呈紫红色。
③另取溶液适量,逐滴加入NaOH溶液:A溶液从酸性变为碱性;B溶液逐渐产生沉淀;C沉淀完全溶解;D最后加热溶液,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
④取适量③得到的碱性溶液,加入Na2CO3溶液,有白色沉淀生成。
根据上述实验现象,回答下列问题。
(1)由①可以排除________________的存在。
(2)由②可以证明________的存在;同时排除__________的存在;理由是_________ ______。
(3)由③可以证明________的存在;写出c、d所涉及的化学方程式,是离子反应的用离子方程式表示:
c________________;d________________。
(4)由④可以证明____________的存在,同时排除____________的存在。
五、计算题
25.把5.1 g铝镁合金的粉末放入100 mL某盐酸中,恰好完全反应得到5.6 L H2(标准
状况下)。试计算:
(1) 上述反应过程中,转移电子的物质的量;
(2) 该盐酸的物质的量浓度;
(3) 该合金中铝的质量分数。
26.在实验室里,用50mL的浓盐酸与一定量的MnO2反应,来制取氯气。
(1)用“双线桥法”标出电子转移情况
MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
(2)若生成2.8L标准状况时的氯气,请计算:
①理论上需要多少克MnO2参加反应?
②被氧化的HCl的物质的量为多少?
试卷第8页,总8页
参考答案
1.D
【解析】
试题分析:A、二氧化硅是难溶于水的氧化物,但是非金属氧化物,错误;B、二氧化碳能溶于水,错误;C、过氧化钠与水反应,生成氢氧化钠、氧气,错误;D、二氧化锰是金属氧化物且难溶于水,正确,答案选D。
考点:考查对氧化物溶解性的判断
2.C
【解析】
【详解】
A.煤是由含有碳、硫等多种物质构成的混合物,故A错误;
B.生铁是由铁和碳组成的一种合金,是混合物,故B错误;
C. 蒸馏水是由一种物质构成,是纯净物,故C正确;
D. 矿泉水中除含有水外,还有其他多种矿物质,是混合物,故D错误;
答案选C。
3.C
【解析】
【详解】
因为A.Mg2+与OH- 反应,故A错误;B.Cl-与Ag+反应故B错误;C. Na+与Cl-、SO42+都不反应,能大量共存,故C正确;SO42-与Ca2+均能发生反应,不能大量共存,故D错误;答案:C。
4.C
【解析】碘为单质,既不是电解质,也不是非电解质,排除;BaCO3为强电解质,排除;葡萄糖为非电解质,水溶液也不能导电,排除;答案为C:由于CO2溶于水后可生成碳酸,其水溶液可导电,但其自身并不能电离出离子,为非电解质
5.A
【解析】
【分析】
A.毛笔(纯狼毫)用的是动物毛,属于蛋白质,是天然纤维;
B.墨是烧制的碳黑,主要成分是碳;
C. 宣纸中的纤维是竹木纤维或竹木纤维再生得到,是纤维素;
D. 石砚的材料是石英、云母、石灰石等矿物,属于氧化物、盐类。
【详解】
A.毛笔(纯狼毫)用的是黄鼠狼的尾毛,属于蛋白质,是天然纤维;而化学纤维包括人造纤维和合成纤维;A错误;
B.墨是烧制的碳黑,是碳,为单质;
C. 宣纸中的纤维是竹木纤维或竹木纤维再生得到,是纤维素,属于糖类;
D. 石砚的材料是石英、云母、石灰石等矿物,属于氧化物、盐类。
故选A。
6.B
【解析】试题分析:A、缺少Mg2+和OH-的反应,生成Mg(OH)2沉淀,故错误;B、氢氧化铁是难溶物,不能拆写,HBr是强酸,需拆写成离子,故正确;C、不符合物质组成,应是Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,故错误;D、碳酸钙是难溶物,不能拆写成离子,故错误。
考点:考查离子反应方程式正误判断等知识。
7.D
【解析】
试题分析:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑反应中,Fe元素的化合价升高,由+2价升高到+6价,Na2O2中O元素的化合价既升高又降低。A、Na2O2中O元素的化合价既升高又降低,反应中既是氧化剂又是还原剂,故A错误;B、反应中化合价升高的元素有Fe,由+2价→+6价,化合价升高的元素还有O元素,由-1价→0价,2molFeSO4发生反应时,共有2mol×4+1mol×2=10mol电子转移,故B错误.C、16g氧气的物质的量为0.5mol,根据B的分析,生成0.5mol O2,有1mol Fe2+ 被氧化,故C错误;D、FeSO4→Na2FeO4,Fe的化合价升高,Na2FeO4是氧化产物,Na2O2→Na2FeO4,O元素化合价降低,Na2FeO4是还原产物,故D正确;故选D。
【考点定位】考查氧化还原反应
【名师点晴】本题考查了氧化还原反应,侧重于基础知识的考查。注意根据化合价的变化分析,物质起还原作用,则该物质作还原剂,其化合价要升高,在反应中失去电子,被氧化,发生氧化反应,得到的产物为氧化产物,可以用口诀:失高氧,低得还:失电子,化合价升高,被氧化(氧化反应),还原剂;得电子,化合价降低,被还原(还原反应),氧化剂。
8.C
【解析】
试题分析:A.硝酸银是易溶、易电离的,应该用离子表示,故A错误;B.氢氧化钡溶液与稀硫酸反应生成的硫酸钡难溶,应用化学式表示,离子反应为Ba2++SO42-+2H++2OH-=BaSO4↓+2H2O,故B错误;C.氯气与溴化钠溶液的离子反应为2Br-+Cl2=Br2+2Cl-,故C正确;D.电荷不守恒,铝与硫酸铜溶液的离子反应为2Al + 3Cu2+ = 2Al3+ + 3Cu,故D错误;故答案为C。
考点:离子方程式的书写
9.B
【解析】A、将磁性氧化铁溶于足量稀硝酸中的离子反应为3Fe3O4+NO3-+28H+═9Fe3++14H2O+NO↑,故A错误;B、向含有0.4 mol FeBr2的溶液中含有0.4mol亚铁离子、0.8mol溴离子,0.4mol亚铁离子完全反应消耗0.2mol氯气,剩余的0.1mol氯气能够氧化0.2mol溴离子,则参加反应的亚铁离子与溴离子的物质的量之比为2:1,该反应的离子方程式为4Fe2++2Br-+3Cl2═4Fe3++6Cl-+Br2,故B正确;C、过量CO2应生成NaHCO3,故C错误;D、向Ba(OH)2溶液中滴加NaHSO4溶液至中性:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,故D错误;故选B。
10.B
【解析】
试题分析:A、氯化氢黑氯化钙均是完全电离,用离子符号表示,A错误;B、离子方程式正确,B正确;C、氢氧化钡和稀硫酸反应的离子方程式:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,C错误;D、稀硫酸和铜不反应,D错误,答案选B。
考点:考查离子方程式正误判断
11.D
【解析】
试题分析:A.由信息可知,反应中砷元素的化合价降低生成+3砷,作氧化剂,则维生素C中某元素的化合价升高,则维生素C在反应中作还原剂,故A、B错误;C.河虾中含有五价砷,无毒,则能够食用,故C错误;D.反应中砷元素的化合价降低,则维生素C中某元素的化合价升高,则维生素C在反应中作还原剂,生成的+3砷,处于中间价态,既有氧化性又有还原性,故D正确,答案选D.
考点:氧化还原反应
12.D
【解析】
【详解】
A. HClO溶液具有强氧化性,能够把Fe2+氧化为Fe3+,所以Fe2+不能大量存在,选项A错误;
B、若溶液中由水电离产生的c(OH-)=1×10-11mol?L-1<10-7mol?L-1,说明该溶液呈酸性或碱性,若碱性条件下则Cu2+与OH-反应产生氢氧化铜沉淀而不能大量共存,选项B错误;
C、Fe3+、Al3+水解呈酸性,不能大量存在于中性溶液中,选项C错误;
D.澄清透明溶液中Cl-、NO3-、Cu2+、NH4+之间不反应,可以大量共存,选项D正确;
答案选D。
13.A
【解析】炼钢是用氧气将碳元素氧化成二氧化碳,故A正确;刻舟求剑是物理变化,故B错误;水滴石穿是碳酸钙、水、二氧化碳反应生成碳酸氢钙,属于非氧化还原反应,故C错误;暗香浮动涉及分子运动,属于物理变化,故D错误。
14.B
【解析】
【分析】
由图中转化可以知道,B为A与硝酸银反应生成的浅黄色沉淀,根据元素守恒知则B为AgBr,所以A中含有Br-,C中加KSCN溶液变为血红色溶液,所以D为Fe(SCN)3溶液,则C中含有Fe3+,A中含有铁元素,硝酸具有强氧化性,能氧化亚铁离子生成铁离子,所以A为可能含有Fe3+或Fe2+。
【详解】
A、通过以上分析知,D中含有Fe(SCN)3,故A正确;
B、硝酸具有强氧化性,能将亚铁离子氧化生成铁离子,所以A中可能是FeBr2,也可能是FeBr3,也可能是二者的混合物,故B错误;
C、B为A与硝酸银反应生成的浅黄色沉淀,根据元素守恒知则B为AgBr,故C正确;
D、能和硫氰化钾溶液反应生成血红色溶液,说明C中含有Fe3+,故D正确。
综上所述,本题选B。
【点睛】
由图中转化可以知道,B为A与硝酸银反应生成的浅黄色沉淀,根据元素守恒知则B为AgBr,所以A中含有Br-,C中加KSCN溶液变为血红色溶液,所以D为Fe(SCN)3溶液,则C中含有Fe3+,A中含有铁元素,硝酸具有强氧化性,能氧化亚铁离子生成铁离子,所以A为可能含有Fe3+或Fe2+,据此解答。
15.D
【解析】A.化合物KCrO2中,K为+1价,O为﹣2价,由化合物中正负化合价的倒数和为0,则Cr元素为+3价,但KCrO2溶于水不能电离出Cr3+,故A错误;
B.由反应①可知,氧化铬与酸、碱反应生成盐和水,为两性氧化物,故B错误;
C.实验②中发生氧化还原反应,Cr元素的化合价由+3价升高为+6价,则过氧化氢中O元素的化合价降低,所以证明H2O2有氧化性,故C错误;
D.由③中溶液变蓝,生成碘单质可知,发生氧化还原反应,Cr元素的化合价降低,I元素的化合价升高,由氧化剂的氧化性大于氧化产物的氧化性可知,证明氧化性为Cr2O72﹣>I2,故D正确;
【点评】本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重基本概念及分析能力、知识迁移应用能力的考查,选项B为解答的易错点,题目难度不大.
16.8分,
(1)单质;Ba(OH)2;
(2)盐酸;
(3)Fe + 2H+=Fe2+ + H2;
(4)H++OH-=H2O;
【解析】
试题分析:(1)纯净物分为单质和化合物; Ba(OH)2是由钡离子和氢氧根离子组成的化合物,属于碱;故答案为:单质;Ba(OH)2;
(2)上述五种物质分别是①铁②氢气③盐酸⑤碳酸氢钠④氢氧化钡;有一种物质盐酸能与其他三种物质:金属铁、碳酸氢钠、氢氧化钡之间发生反应.故答案为:盐酸;
(3)盐酸和铁发生置换反应,离子方程式为:Fe+2H+=Fe2++H2↑;故答案为:Fe+2H+=Fe2++H2↑;
(4)过量的盐酸和氢氧化钡反应的离子方程式为:H++OH-=H2O,故答案为:H++OH-=H2O。
考点:考查了物质的分类、物质间性质的反应的相关知识。
17.
【解析】略
18.铁(或Fe) 浓度 还原性 ②③⑤ abdce B
【解析】
【详解】
(1)由题中数据可知:铁(或Fe)元素含量偏低,故答案为:铁(或Fe);
(2)报告单中μmol/L是浓度的单位,故答案为:浓度;
(3)服用维生素C可使食物中的Fe3+转化为Fe2+,Fe元素的化合价降低被还原,则维生素C所起还原作用,故答案为:还原性;
(4)盐是由金属阳离子或铵根离子与酸根阴离子组成的化合物,属于盐的是K2SO4、 KMnO4 、AgNO3,故答案为:②③⑤;
(5)①溶液配制的操作步骤为:计算、称量、溶解、冷却、转移、洗涤、定容、摇匀等,
所以操作步骤的正确顺序为abdce,故答案为:abdce;
②A.使用容量瓶前要检查它是否漏水,故A正确;B. 容量瓶在使用前未干燥,里面有少量蒸馏水,对溶液的浓度无影响,故B错误;C.溶液配制好以后要摇匀,摇匀的操作方法为:盖好瓶塞,用一只手的食指顶住瓶塞,另一只手的手指托住瓶底,把容量瓶倒转和摇动几次,故C正确;故答案为:B;
(6)在“鲜花保鲜剂”中,含有K+的物质为硫酸钾和高锰酸钾,利用二者的含量进行计算,则有K+的物质的量浓度=mol/L,故答案为:。
19.4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3Al3+ + 3[Al(OH)4]- = 4Al(OH)3↓Cu2+ + 2NH3?H2O = Cu(OH)2↓+ 2NH4+Cu(OH)2 + 4NH3?H2O = [Cu(NH3)4]2+ + 2OH- + 4H2OAl3+ + 2SO42- + 2Ba2+ + 4OH-=[Al(OH)4]- + 2BaSO4↓
【解析】
【详解】
(1)新制氢氧化亚铁被氧气氧化为氢氧化铁,其化学方程式为 4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3;因此本题答案是:4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3 。
(2)氯化铝溶液水解显酸性,四羟基合铝酸钠溶液水解显碱性,二者混合相互促进水解生成Al(OH)3,离子方程式:Al3+ + 3[Al(OH)4]- =4Al(OH)3↓;因此本题答案是:Al3+ + 3[Al(OH)4]- = 4Al(OH)3↓。
(3)向硫酸铜溶液中逐滴滴加氨水先生成氢氧化铜蓝色沉淀,氨水过量后,氢氧化铜溶于过量的氨水中生成络合物,离子方程式是Cu2+ +2NH3?H2O = Cu(OH)2↓+ 2NH4+; Cu(OH)2 + 4NH3?H2O = [Cu(NH3)4]2+ +2OH- + 4H2O;综上所述,本题答案是: Cu2+ + 2NH3?H2O = Cu(OH)2↓+ 2NH4+; Cu(OH)2 + 4NH3?H2O = [Cu(NH3)4]2+ + 2OH- + 4H2O。
(4)假设硫酸铝钾物质的量为1mol, SO42-的量为2mol,需要2mol Ba(OH)2至SO42-全部沉淀,同时生成偏铝酸钾,离子方程式Al3++2SO42-+2Ba2+ + 4OH-=[Al(OH)4]- +2BaSO4↓;综上所述,本题答案是:Al3++2SO42-+2Ba2+ +4OH-=[Al(OH)4]- +2BaSO4↓。
20.交叉分类法 ③⑤ FeCl3+ 3H2OFe(OH)3(胶体)+3HCl 负 胶体聚沉 H+ +HCO3- = CO2 + H2O 3H+ +Al(OH)3 =Al3+ + 3H2O Ca(OH)2 + 2CO2 = Ca2++2HCO3-
【解析】
【分析】
(1)由交叉分类法可知,KNO3既是钾盐又是硝酸盐;
(2)六种物质中属于电解质的是KNO3、液态HCl、NaHCO3,属于非电解质的是CO2,既不是电解质也不是非电解质的是铜丝、Fe(OH)3胶体;
(3)实验室制备氢氧化铁胶体是在沸腾的蒸馏水中加入饱和氯化铁溶液,当溶液变为红褐色时立即停止加热;阳极附近橘红色加深,说明Sb2S3胶粒带负电荷;带相反电荷Fe(OH)3与硫化锑胶体混合会发生聚沉;
(4)胃酸中含有盐酸,盐酸能与NaHCO3、Al(OH)3反应,治疗胃酸过多;氢氧化钙与二氧化碳反应生成难溶性的碳酸钙,通入过量的二氧化碳,二氧化碳和碳酸钙和水反应生成易溶于水的碳酸氢钙,浑浊变澄清。
【详解】
(1)由交叉分类法可知,KNO3既是钾盐又是硝酸盐,故答案为:交叉分类法;
(2)六种物质中属于电解质的是KNO3、液态HCl、NaHCO3,属于非电解质的是CO2,铜丝是金属单质、Fe(OH)3胶体是化合物,既不是电解质也不是非电解质,故答案为:③⑤;
(3)实验室制备氢氧化铁胶体是在沸腾的蒸馏水中加入饱和氯化铁溶液,当溶液变为红褐色时立即停止加热,反应的化学方程式为FeCl3+ 3H2OFe(OH)3(胶体)+3HCl;插入电极后通直流电,发现阳极附近橘红色加深,说明Sb2S3胶粒带负电荷;Fe(OH)3与硫化锑胶体混合,带正电荷的Fe(OH)3胶粒与带负电荷Sb2S3胶粒发生聚沉,体系变浑浊,故答案为:FeCl3+ 3H2OFe(OH)3(胶体)+3HCl;负;胶体聚沉;
(4)胃酸中含有盐酸,NaHCO3能治疗胃酸过多,是因为盐酸与碳酸氢钠反应生成氯化钠和水、二氧化碳,反应的离子方程式:H++HCO3-=H2O+CO2↑;氢氧化铝与盐酸反应生成氯化铝和水,反应的离子方程式:Al(OH)3+3H+=Al3++3H2O;向浑浊石灰水中通入二氧化碳,氢氧化钙与二氧化碳反应生成难溶性的碳酸钙,通入过量的二氧化碳,二氧化碳和碳酸钙和水反应生成易溶于水的碳酸氢钙,浑浊变澄清,反应的总离子方程式为:Ca(OH)2 + 2CO2 = Ca2++2HCO3-,故答案为:H++HCO3-=H2O+CO2↑;Al(OH)3+3H+=Al3++3H2O;Ca(OH)2 + 2CO2 = Ca2++2HCO3-。
21.(1)Ag+;Ag++Cl-==AgCl↓;
(2)Al3+ ;Mg2+ ;Al3++3OH-==Al(OH)3↓;Al(OH)3 +OH-==AlO2-+2H2O;
(3)Ba2+ ; Ba2++SO42-==BaSO4↓
【解析】
试题分析:(1)向溶液中加入过量的盐酸,有白色沉淀生成.则肯定含有的离子是Ag+,因为只有氯化银不溶于酸中,答案为:Ag+ ; Ag+ + Cl- ==AgCl ↓;(2)将(1)所得的溶液过滤后,往滤液中逐渐加入NaOH溶液,有白色沉淀生成,可能是Mg(OH)2和Al(OH)3沉淀,但是继续加入NaOH溶液,沉淀全部溶解,得到澄清溶液,Mg(OH)2不能溶于氢氧化钠中,所以只可能是Al(OH)3,肯定含有的离子是Al3+,肯定不含的是Mg2+,发生的离子方程式为:Al3+ + 3OH- ==Al(OH)3 ↓; Al(OH)3 + OH- -== AlO2- +2H2O;答案为:Al3+ ; Mg2+ ;Al3+ + 3OH- ==Al(OH)3 ↓;Al(OH)3 + OH- -== AlO2- +2H2O;(3)在(2)所得的澄清溶液中加入Na2SO4溶液,产生白色沉淀.则肯定含有的离子是Ba2+,离子方程式为:Ba2+ + SO42-==BaSO4↓,答案为:Ba2+ ; Ba2+ + SO42-==BaSO4 ↓。
考点:考查离子的鉴别
22.
(1)K+、NH4+、CO32-、SO42-;Mg2+、Fe3+;
(2)Cl—
(3)c(K+)≥0.2mol/L、c(NH4+)=0.4mol/L
【解析】
试题分析:由I实验可知,向第一份溶液中加入AgNO3溶液,有白色沉淀产生,白色沉淀为AgCl或碳酸银、硫酸银;由Ⅱ可知,向第二份溶液中加入足量NaOH 溶液后加热,收集到0.896L(标准状况)气体,气体为氨气,其物质的量为=0.04mol,原溶液中一定含NH4+;由Ⅲ可知,向第三份溶液中加入足量BaCl2溶液,得到沉淀6.27g,沉淀经足量盐酸洗涤后剩余2.33g,则含SO42-的物质的量为=0.01mol,含CO32-的物质的量为=0.02mol,由离子共存可知,一定不存在Fe3+、Mg2+,由电荷守恒可知,0.01mol×2+0.02mol×2>0.04mol,可知一定含阳离子K+,不能确定是否含Cl-。
(1)由上述分析可知,一定存在K+、NH4+、CO32-、SO42-,一定不存在Fe3+、Mg2+,故答案为:K+、NH4+、CO32-、SO42;Fe3+、Mg2+;
(2)由上述分析可知,可能存在Cl-;故答案为:Cl-;
(3)根据电荷守恒,正电荷为:n(+)=n(NH4+)=0.04mol,c(-)=2c(CO32-)+2c(SO42-)=0.06mol,总正电荷小于负电荷,则原溶液中一定含有K+,至少为0.02mol, c(K+)≥0.2mol/L;根据上述分析,NH4+的物质的量为0.04mol,c(NH4+)=0.4mol/L,故答案为:c(K+)≥0.2mol/L、c(NH4+)=0.4mol/L。
考点:考查了常见离子的检验方法的相关知识。
23.(10分)
(1)27.8 g ①偏低 ②偏低
(2)CO32-、Na+;HCO3-、S2-
【解析】
试题分析:
(1)配制500mL 0.2 mol·L-1 FeSO4溶液,需要称取绿矾(FeSO4·7H2O)的质量m=0.500L×0.2 mol·L-1 × 278g/mol=27.8g,故答案为:27.8g;①用以溶解FeSO4·7H2O烧杯未洗涤,则溶质物质的量减小,FeSO4溶液的物质的量浓度偏低;②摇匀后发现液面低于刻度线再加水,则溶液体积偏大,FeSO4溶液的物质的量浓度偏低;
(2)过氧化钠先和水反应生成NaOH和O2,NaOH在水溶液中能电离出自由移动的OH-,OH-能和HCO3-反应生成CO32-和水。除此之外,过氧化钠也能氧化S2-为S单质,所以溶液中增加的离子为CO32-、Na+,减少的离子为HCO3-、S2-。
考点:溶液配制,离子反应
24.(1)CO、AlO(2)I-Fe3+、NO
CCl4层呈紫红色,则原溶液中存在I-;Fe3+、NO在该环境中与I-不能共存
(3)Al3+、NH;Al(OH)3+OH-===AlO+2H2O;NH+OH-NH3↑+H2O
(4)Ba2+;SO
【解析】
试题分析:(1)①溶液呈强酸性肯定含有氢离子,所以一定不含有CO、AlO;
(2)②加入少量CCl4及数滴新制的氯水,经振荡CCl4层呈紫红色,一定含有碘离子,一定不含有NO3-、Fe3+;理由是CCl4层呈紫红色,则原溶液中存在I-;Fe3+、NO在该环境中与I-不能共存
(3)③逐滴加入NaOH溶液,A.溶液从酸性变为碱性;B.溶液逐渐产生沉淀;C.沉淀完全溶解;说明溶液中一定含有Al3+,D.最后加热溶液,有气体放出,该气体能使湿润的红色石蕊试纸变蓝,该气体为氨气,则原溶液中一定含有NH4+ ;c、d发生反应的离子方程式为Al(OH)3+OH-===AlO+2H2O 、NH+OH-NH3↑+H2O。
(4)④另取③的部分碱性溶液,向其中加入Na2CO3溶液,有白色沉淀产生,肯定含有Ba2+,一定不含有SO42-。
【考点定位】考查离子检验
【名师点睛】本题考查常见离子的检验方法。要求熟练掌握常见离子的检验方法,能够根据反应现象推断存在的离子。①溶液呈强酸性肯定含有氢离子,与氢离子反应的离子不能共存;②入少量CCl4及数滴新制的氯水,经振荡CCl4层呈紫红色,一定含有碘离子,与碘离子反应的离子不能共存;③加入NaOH溶液,A.溶液从酸性变为碱性性;B.溶液逐渐产生沉淀;C.沉淀完全溶解;说明溶液中一定含有Al3+,D.最后加热溶液,有气体放出,该气体能使湿润的红色石蕊试纸变蓝,该气体为氨气,则原溶液中一定含有NH4+ ;④取取③的部分碱性溶液,向其中加入Na2CO3溶液,有白色沉淀产生,肯定含有Ba2+,能够与钡离子反应的离子不能存在,根据以上分析完成各题即可。
25.
(1)0.5mol;(2)5mol/L;(3)52.9%
【解析】
试题分析:(1)标准状况下5.6L氢气的物质的量为:n(H2)==0.25mol,
根据电子守恒,生成0.25mol氢气转移的电子的物质的量为:0.25mol×2=0.5mol,答:反应过程中,转移电子的物质的量为0.5mol;
(2)设5.1g镁铝合金中含有镁xmol,含有铝ymol,则
Mg+2HCl=MgCl2+H2↑,
1 2 1
x 2x x
2Al+6HCl=2AlCl3+3H2↑,
2 6 3
y 3y y
x+y=0.25,24x+27y=5.1,解得:x=0.1,y=0.1,
反应消耗的盐酸的总物质的量为:2x+3y=0.1mol×2+0.1mol×3=0.5mol,
盐酸的物质的量浓度为:c(HCl)==5mol/L,
答:该盐酸的物质的量浓度为5mol/L;
(3)该合金中铝的质量分数为:w(Al)=×100%≈52.9%,
故:该合金中铝的质量分数为52.9%。
【考点定位】考查混合物的计算
【名师点晴】本题考查了有关混合物的计算,题目难度中等,注意掌握物质的量浓度、质量分数的表达式,明确反应原理为解答本题的关键,试题培养了学生的分析、理解能力及计算能力。
26.
(1)
(2)①10.88g②0.25mol
【解析】
试题分析:(1)反应中Mn元素化合价降低,化合价由+4价降低到+2价,Cl元素化合价升高,由-1价升高到0价,氧化还原反应中得失电子数目相等,表现为化合价升降的总数相等,可表示为;
(2)n(Cl2)==0.125mol,
①MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
87g1mol
m0.125mol
m=10.88g;
②MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O被氧化HCl
1mol2mol
0.125moln
n=0.25mol。
考点:考查氧化还原反应
一、单选题(每小题只有一个正确答案)
1.难溶于水的金属氧化物是( )
A.SiO2 B.CO2 C.Na2O2 D.MnO2
2.下列物质是你在生活中经常用到的物质,其中属于纯净物的是( )
A. 煤 B. 生铁 C. 蒸馏水 D. 矿泉水
3.下表是某矿泉水的部分标签说明
主要成分
钾离子 K+ 20~27.3 mg/L
氯离子 Cl- 30~34.2 mg/L
镁离子 Mg2+ 20.2~24.9 mg/L
硫酸根离子SO42- 24~27.5 mg/L
主要成分
钾离子 K+ 20~27.3 mg/L
氯离子 Cl- 30~34.2 mg/L
镁离子 Mg2+ 20.2~24.9 mg/L
硫酸根离子SO42- 24~27.5 mg/L
则该饮用水中还可能较大量存在( )
A. OH- B. Ag+ C. Na+ D. Ca2+
4.下列物质中,其水溶液能导电、溶于水时化学键被破坏,且该物质属于非电解质的是( )
A.I2 B.BaCO3 C.CO2 D.C6H12O6(葡萄糖)
5.中国传统的文房四宝是“笔墨纸砚”,下列对应的主要材料所属物质、物质分类有误的是( )
文房四宝 材料所属物质 物质分类
A 毛笔(纯狼毫) 蛋白质 化学纤维
B 墨 碳 单质
C 宣纸 纤维素 糖
D 石砚 石英、云母、石灰石 氧化物、盐
A. A B. B C. C D. D
6.下列反应的离子方程式正确的是 ( )
A. 电解氯化镁溶液:2Cl-+2H2OCl2↑+H2↑+2OH-
B. 氢氧化铁与足量的氢溴酸溶液反应:Fe(OH)3+3H+=Fe3++3H2O
C. 氢氧化钡溶液中加入硫酸:Ba2++OH—+H++SO42—=BaSO4↓+H2O
D. 鸡蛋壳浸泡在盐酸中产生气泡:CO32—+2H+=CO2↑+H2O
7.Na2FeO4是一种高效多功能水处理剂,应用前景十分看好。一种制备Na2FeO4的方法可用化学方程式表示如下:2FeSO4 + 6Na2O2 = 2Na2FeO4 + 2Na2O + 2Na2SO4 + O2↑,对此反应下列说法中正确的是( )
A.Na2O2只作氧化剂
B.2 mol FeSO4发生反应时,反应中共有8 mol电子转移
C.每生成16g氧气就有1mol Fe2+ 被还原
D.Na2FeO4既是还原产物又是氧化产物
8.下列反应的离子方程式正确的是
A.硝酸银与氯化钠溶液的反应:AgNO3+Cl—=AgCl↓+NO3-
B.硫酸与氢氧化钡溶液反应:H++OH-=H2O
C.氯气与溴化钠溶液反应:C12+2Br-=Br2+2Cl-
D.铝与硫酸铜溶液的反应:Al+Cu2+=Al3++Cu
9.下列反应的离子方程式正确的是 ( )
A. 磁性氧化铁溶于稀硝酸:3FeO+4H++ NO3-=3Fe3++NO↑+2H2O
B. 向含有0.4mol?FeBr2的溶液中通入0.3mol?Cl2充分反应:4Fe2++2Br-+3Cl2═4Fe3++Br2+6Cl-
C. NaAlO2溶液中通入过量CO2:2AlO2—+CO2+3H2O=2Al(OH)3↓+CO32-
D. 向Ba(OH)2溶液中滴加NaHSO4溶液至中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O
10.下列离子方程式书写正确的是
A.实验室制备CO2的反应为:CaCO3+2HCl=CaCl2+H2O+CO2↑
B.向氯化铜溶液中滴加硝酸银溶液:Ag++Cl-=AgCl↓
C.氢氧化钡和稀硫酸反应的离子方程式:Ba2++OH-+H++SO42-=BaSO4↓+H2O
D.稀硫酸滴到铜片上:Cu+2H+=Cu2++H2?
11.菜谱中记载:河虾不能与西红柿同食,主要原因是因为河虾中含有+5价砷(As),西红柿中含有比较多的维生素C,两者同食会产生有毒的+3价砷,下列说法中正确的是( )
A.中毒过程中+5价砷体现出一定的还原性
B.中毒过程中,维生素C作氧化剂
C.因为河虾中含有砷元素,所以不能食用
D.+3价砷具有还原性
12.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A. 在含0.1mol/LHClO溶液中:Cu2+、Fe2+、Cl-、SO42-
B. 水电离产生的c(OH-)=1×10-11 mol·L-1的溶液:Cu2+、SO42-、NO3-、Cl-
C. 中性溶液中:Fe3+、Al3+、NO3-、SO42-
D. 澄清透明溶液中:Cl-、NO3-、Cu2+、NH4+
13.以下成语本意涉及氧化还原反应的是( )
A. 百炼成钢 B. 刻舟求剑 C. 水滴石穿 D. 暗香浮动
14.某同学设计下列方案对A盐的水解液进行鉴定:由此得出的结论中,不正确的是
A. D溶液中存在Fe(SCN)3 B. A一定为无氧酸盐FeBr2 C. B为AgBr D. 滤液中有Fe3+
15.已知下列实验事实:
①Cr2O3固体既能溶于KOH溶液得到KCrO2溶液,又能溶于硫酸得到Cr2(SO4)3溶液;
②向KCrO2溶液中滴加H2O2溶液,再酸化,可得K2Cr2O7溶液;
③将K2Cr2O7溶液滴加到淀粉和KI的混合溶液中,溶液变蓝.
下列判断正确的是( )
A.化合物KCrO2溶于水可电离出Cr3+ B.实验①证明Cr2O3是酸性氧化物
C.实验②证明H2O2既有氧化性又有还原性 D.实验③证明氧化性:Cr2O72﹣>I2
二、填空题
16.现有盐酸、铁、氢气、碳酸氢钠、氢氧化钡。根据要求回答下列问题:
(1)下图为常见物质的树状分类图:
X属于_________(填物质类属);若图中①—⑤分别代表上述五种物质,则④对应的化学式是 。
(2)上述五种物质中,有一种物质能与其他三种物质发生反应。该物质是__________。
(3)上述五种物质间发生置换反应的离子方程式____________________
(4)写出过量的③与④反应的离子方程式 ____________________
17.将下列物质按要求填空(只填字母):A.氯化钠晶体 B.液态SO2 C.液态醋酸 D.汞 E.氨水 F.甲烷 G.熔化的KNO3
①能导电的是_____________ ②属于电解质的是______________ ③属于非电解质的是______________ ④属于强电解质的是___________ ⑤属于弱电解质的是____________。
18.生活中有许多与化学相关的数据表格。
Ⅰ.下图是某儿童微量元素体检报告单的部分数据:某医疗机构临床检验结果报告单
分析项目 检测结果 单位 参考范围
1 锌(Zn) 115.92 μmol/L 66~120
2 铁(Fe) 6.95 mmol/L 7.52~11.82
3 钙(Ca) 1.68 mmol/L 1.55~2.10
……
根据上表的数据,回答下列问题:
(1)该儿童__________元素含量偏低。
(2)报告单中“μmol/L”是__________(填“质量”、“体积”或“浓度”)的单位。
(3)服用维生素C可使食物中的Fe3+转化为Fe2+,在这个过程中体现维生素C的__________(填“氧化性”或“还原性”)。
Ⅱ.生活中为了延长鲜花的寿命,通常会在花瓶中加入鲜花保鲜剂。下表是0.5L某种鲜花保鲜剂中含有的成分及含量,阅读后回答下列问题:
成分 质量(g) 摩尔质量(g/mol)
①蔗糖(C12H22O11) 25.00 342
②硫酸钾(K2SO4) 0.25 174
③高锰酸钾(KMnO4) 0.25 158
④阿司匹林(C9H8O4) 0.17 180
⑤硝酸银(AgNO3) 0.02 170
(4)上述鲜花保鲜剂成分中,属于盐的是__________(填序号)。
(5)欲配制500mL该鲜花保鲜剂,有如下操作步骤:
a.把称量好的保鲜剂放入小烧杯中,加适量蒸馏水溶解;
b.把a所得溶液小心转入500mL容量瓶中;
c.继续向容量瓶中加蒸馏水至液面距刻度1cm~2cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面最低处与刻度线相切;
d.用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤液都小心转入容量瓶,并轻轻摇匀;
e.将容量瓶塞紧,反复上下颠倒摇匀。
①操作步骤的正确顺序为(填序号)__________。
②在容量瓶的使用方法中,下列操作不正确的是__________。
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,需要干燥
C.盖好瓶塞,用一只手的食指顶住瓶塞,另一只手的手指托住瓶底,把容量瓶倒转和摇动几次
(6)写出该鲜花保鲜剂中K+的物质的量浓度的计算式c(K+)=__________ mol·L?1。
19.离子反应和氧化还原反应在生产、生活中应用广泛,用所学知识回答问题:
(1)新制氢氧化亚铁被氧气氧化,其化学方程式为______________。
(2)氯化铝溶液中滴加四羟基合铝酸钠溶液的离子方程式________。
(3)向硫酸铜溶液中逐滴滴加氨水至过量的离子方程式是____、______。
(4)向硫酸铝钾溶液中逐滴加入Ba(OH)2溶液至SO42-全部沉淀时的离子方程式_______;
20.现有以下六种物质:①KNO3;②液态HCl;③铜丝;④NaHCO3;⑤Fe(OH)3胶体;⑥CO2
(1)①既是钾盐又是硝酸盐,对该物质的分类方法是___________________________。
(2)既不是电解质也不是非电解质的是(填序号)___________。
(3)实验室制备Fe(OH)3胶体的化学方程式为________________________。将橘红色的硫化锑(Sb2S3)胶体装入U型管,插入电极后通直流电,发现阳极附近橘红色加深,证明Sb2S3胶粒带_____电荷。Fe(OH)3与硫化锑胶体混合,发现体系变浑浊,这是发生了___________。
(4)胃酸中含有盐酸,NaHCO3能治疗胃酸过多,请写出其反应的离子方程式_____________;若患有胃溃疡,此时最好服用含Al(OH)3的胃药,它与胃酸反应的离子方程式为______________;浑浊石灰水中通入过量的CO2,时发生反应的离子方程式是______________________________。
三、推断题
21.某溶液中可能含有Ag+、Al3+、Ba2+、Mg2+中的一种或几种.根据以下实验所得的现象,将适当的结论填入空格中.
(1)向溶液中加入过量的盐酸,有白色沉淀生成.则肯定含有的离子是______________.离子方程式是______________________;
(2)将(1)所得的溶液过滤后,往滤液中逐渐加入NaOH溶液,有白色沉淀生成,继续加入NaOH溶液,沉淀全部溶解,得到澄清溶液.则又可肯定含有的离子是___________,肯定不含的离子是__________,离子方程式是_________________﹑____________________.
(3)在(2)所得的澄清溶液中加入Na2SO4溶液,产生白色沉淀.则肯定含有的离子是__________________,离子方程式是______________________.
22.有一混合物水溶液,可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Fe3+、CO32—、SO42—,现各取100ml溶液三份进行如下实验:①向第一份加入AgNO3溶液,有白色沉淀产生②向第二份加入足量NaOH溶液后加热,收集到气体0.896L(标准状况)③向第三份加入足量BaCl2溶液,得到沉淀6.27克,沉淀经足量盐酸洗涤后,剩余2.33克。
试回答下列问题:
(1)肯定存在的离子有 ,肯定不存在的离子有 ,
(2)可能存在的离子是 ,
(3)试分别确定肯定存在的阳离子在原溶液中各自的物质的量浓度 。
四、实验题
23.(1)实验室配制500mL 0.2 mol·L-1 FeSO4溶液,需要称量FeSO4·7H2O__________g。
若实验遇到下列情况,对FeSO4溶液的物质的量浓度有何影响?(填“偏高”“偏低”或“不变”)
①用以溶解FeSO4·7H2O烧杯未洗涤,_______________。
②摇匀后发现液面低于刻度线再加水,_________________。
(2)把少量Na2O2投入含有HCO3-、CO32-、S2-、Na+的溶液中,上述溶液中离子数目增加的是________,离子数目减少的是____________。
24.有一瓶澄清的溶液,其中可能含有NH、K+、Ba2+、Al3+、Fe3+、I-、NO、CO、SO、AlO。取该溶液进行以下实验:
①用pH试纸检验,溶液呈强酸性。
②取溶液适量,加入少量CCl4和数滴新制氯水,振荡,CCl4层呈紫红色。
③另取溶液适量,逐滴加入NaOH溶液:A溶液从酸性变为碱性;B溶液逐渐产生沉淀;C沉淀完全溶解;D最后加热溶液,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
④取适量③得到的碱性溶液,加入Na2CO3溶液,有白色沉淀生成。
根据上述实验现象,回答下列问题。
(1)由①可以排除________________的存在。
(2)由②可以证明________的存在;同时排除__________的存在;理由是_________ ______。
(3)由③可以证明________的存在;写出c、d所涉及的化学方程式,是离子反应的用离子方程式表示:
c________________;d________________。
(4)由④可以证明____________的存在,同时排除____________的存在。
五、计算题
25.把5.1 g铝镁合金的粉末放入100 mL某盐酸中,恰好完全反应得到5.6 L H2(标准
状况下)。试计算:
(1) 上述反应过程中,转移电子的物质的量;
(2) 该盐酸的物质的量浓度;
(3) 该合金中铝的质量分数。
26.在实验室里,用50mL的浓盐酸与一定量的MnO2反应,来制取氯气。
(1)用“双线桥法”标出电子转移情况
MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
(2)若生成2.8L标准状况时的氯气,请计算:
①理论上需要多少克MnO2参加反应?
②被氧化的HCl的物质的量为多少?
试卷第8页,总8页
参考答案
1.D
【解析】
试题分析:A、二氧化硅是难溶于水的氧化物,但是非金属氧化物,错误;B、二氧化碳能溶于水,错误;C、过氧化钠与水反应,生成氢氧化钠、氧气,错误;D、二氧化锰是金属氧化物且难溶于水,正确,答案选D。
考点:考查对氧化物溶解性的判断
2.C
【解析】
【详解】
A.煤是由含有碳、硫等多种物质构成的混合物,故A错误;
B.生铁是由铁和碳组成的一种合金,是混合物,故B错误;
C. 蒸馏水是由一种物质构成,是纯净物,故C正确;
D. 矿泉水中除含有水外,还有其他多种矿物质,是混合物,故D错误;
答案选C。
3.C
【解析】
【详解】
因为A.Mg2+与OH- 反应,故A错误;B.Cl-与Ag+反应故B错误;C. Na+与Cl-、SO42+都不反应,能大量共存,故C正确;SO42-与Ca2+均能发生反应,不能大量共存,故D错误;答案:C。
4.C
【解析】碘为单质,既不是电解质,也不是非电解质,排除;BaCO3为强电解质,排除;葡萄糖为非电解质,水溶液也不能导电,排除;答案为C:由于CO2溶于水后可生成碳酸,其水溶液可导电,但其自身并不能电离出离子,为非电解质
5.A
【解析】
【分析】
A.毛笔(纯狼毫)用的是动物毛,属于蛋白质,是天然纤维;
B.墨是烧制的碳黑,主要成分是碳;
C. 宣纸中的纤维是竹木纤维或竹木纤维再生得到,是纤维素;
D. 石砚的材料是石英、云母、石灰石等矿物,属于氧化物、盐类。
【详解】
A.毛笔(纯狼毫)用的是黄鼠狼的尾毛,属于蛋白质,是天然纤维;而化学纤维包括人造纤维和合成纤维;A错误;
B.墨是烧制的碳黑,是碳,为单质;
C. 宣纸中的纤维是竹木纤维或竹木纤维再生得到,是纤维素,属于糖类;
D. 石砚的材料是石英、云母、石灰石等矿物,属于氧化物、盐类。
故选A。
6.B
【解析】试题分析:A、缺少Mg2+和OH-的反应,生成Mg(OH)2沉淀,故错误;B、氢氧化铁是难溶物,不能拆写,HBr是强酸,需拆写成离子,故正确;C、不符合物质组成,应是Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,故错误;D、碳酸钙是难溶物,不能拆写成离子,故错误。
考点:考查离子反应方程式正误判断等知识。
7.D
【解析】
试题分析:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑反应中,Fe元素的化合价升高,由+2价升高到+6价,Na2O2中O元素的化合价既升高又降低。A、Na2O2中O元素的化合价既升高又降低,反应中既是氧化剂又是还原剂,故A错误;B、反应中化合价升高的元素有Fe,由+2价→+6价,化合价升高的元素还有O元素,由-1价→0价,2molFeSO4发生反应时,共有2mol×4+1mol×2=10mol电子转移,故B错误.C、16g氧气的物质的量为0.5mol,根据B的分析,生成0.5mol O2,有1mol Fe2+ 被氧化,故C错误;D、FeSO4→Na2FeO4,Fe的化合价升高,Na2FeO4是氧化产物,Na2O2→Na2FeO4,O元素化合价降低,Na2FeO4是还原产物,故D正确;故选D。
【考点定位】考查氧化还原反应
【名师点晴】本题考查了氧化还原反应,侧重于基础知识的考查。注意根据化合价的变化分析,物质起还原作用,则该物质作还原剂,其化合价要升高,在反应中失去电子,被氧化,发生氧化反应,得到的产物为氧化产物,可以用口诀:失高氧,低得还:失电子,化合价升高,被氧化(氧化反应),还原剂;得电子,化合价降低,被还原(还原反应),氧化剂。
8.C
【解析】
试题分析:A.硝酸银是易溶、易电离的,应该用离子表示,故A错误;B.氢氧化钡溶液与稀硫酸反应生成的硫酸钡难溶,应用化学式表示,离子反应为Ba2++SO42-+2H++2OH-=BaSO4↓+2H2O,故B错误;C.氯气与溴化钠溶液的离子反应为2Br-+Cl2=Br2+2Cl-,故C正确;D.电荷不守恒,铝与硫酸铜溶液的离子反应为2Al + 3Cu2+ = 2Al3+ + 3Cu,故D错误;故答案为C。
考点:离子方程式的书写
9.B
【解析】A、将磁性氧化铁溶于足量稀硝酸中的离子反应为3Fe3O4+NO3-+28H+═9Fe3++14H2O+NO↑,故A错误;B、向含有0.4 mol FeBr2的溶液中含有0.4mol亚铁离子、0.8mol溴离子,0.4mol亚铁离子完全反应消耗0.2mol氯气,剩余的0.1mol氯气能够氧化0.2mol溴离子,则参加反应的亚铁离子与溴离子的物质的量之比为2:1,该反应的离子方程式为4Fe2++2Br-+3Cl2═4Fe3++6Cl-+Br2,故B正确;C、过量CO2应生成NaHCO3,故C错误;D、向Ba(OH)2溶液中滴加NaHSO4溶液至中性:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,故D错误;故选B。
10.B
【解析】
试题分析:A、氯化氢黑氯化钙均是完全电离,用离子符号表示,A错误;B、离子方程式正确,B正确;C、氢氧化钡和稀硫酸反应的离子方程式:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,C错误;D、稀硫酸和铜不反应,D错误,答案选B。
考点:考查离子方程式正误判断
11.D
【解析】
试题分析:A.由信息可知,反应中砷元素的化合价降低生成+3砷,作氧化剂,则维生素C中某元素的化合价升高,则维生素C在反应中作还原剂,故A、B错误;C.河虾中含有五价砷,无毒,则能够食用,故C错误;D.反应中砷元素的化合价降低,则维生素C中某元素的化合价升高,则维生素C在反应中作还原剂,生成的+3砷,处于中间价态,既有氧化性又有还原性,故D正确,答案选D.
考点:氧化还原反应
12.D
【解析】
【详解】
A. HClO溶液具有强氧化性,能够把Fe2+氧化为Fe3+,所以Fe2+不能大量存在,选项A错误;
B、若溶液中由水电离产生的c(OH-)=1×10-11mol?L-1<10-7mol?L-1,说明该溶液呈酸性或碱性,若碱性条件下则Cu2+与OH-反应产生氢氧化铜沉淀而不能大量共存,选项B错误;
C、Fe3+、Al3+水解呈酸性,不能大量存在于中性溶液中,选项C错误;
D.澄清透明溶液中Cl-、NO3-、Cu2+、NH4+之间不反应,可以大量共存,选项D正确;
答案选D。
13.A
【解析】炼钢是用氧气将碳元素氧化成二氧化碳,故A正确;刻舟求剑是物理变化,故B错误;水滴石穿是碳酸钙、水、二氧化碳反应生成碳酸氢钙,属于非氧化还原反应,故C错误;暗香浮动涉及分子运动,属于物理变化,故D错误。
14.B
【解析】
【分析】
由图中转化可以知道,B为A与硝酸银反应生成的浅黄色沉淀,根据元素守恒知则B为AgBr,所以A中含有Br-,C中加KSCN溶液变为血红色溶液,所以D为Fe(SCN)3溶液,则C中含有Fe3+,A中含有铁元素,硝酸具有强氧化性,能氧化亚铁离子生成铁离子,所以A为可能含有Fe3+或Fe2+。
【详解】
A、通过以上分析知,D中含有Fe(SCN)3,故A正确;
B、硝酸具有强氧化性,能将亚铁离子氧化生成铁离子,所以A中可能是FeBr2,也可能是FeBr3,也可能是二者的混合物,故B错误;
C、B为A与硝酸银反应生成的浅黄色沉淀,根据元素守恒知则B为AgBr,故C正确;
D、能和硫氰化钾溶液反应生成血红色溶液,说明C中含有Fe3+,故D正确。
综上所述,本题选B。
【点睛】
由图中转化可以知道,B为A与硝酸银反应生成的浅黄色沉淀,根据元素守恒知则B为AgBr,所以A中含有Br-,C中加KSCN溶液变为血红色溶液,所以D为Fe(SCN)3溶液,则C中含有Fe3+,A中含有铁元素,硝酸具有强氧化性,能氧化亚铁离子生成铁离子,所以A为可能含有Fe3+或Fe2+,据此解答。
15.D
【解析】A.化合物KCrO2中,K为+1价,O为﹣2价,由化合物中正负化合价的倒数和为0,则Cr元素为+3价,但KCrO2溶于水不能电离出Cr3+,故A错误;
B.由反应①可知,氧化铬与酸、碱反应生成盐和水,为两性氧化物,故B错误;
C.实验②中发生氧化还原反应,Cr元素的化合价由+3价升高为+6价,则过氧化氢中O元素的化合价降低,所以证明H2O2有氧化性,故C错误;
D.由③中溶液变蓝,生成碘单质可知,发生氧化还原反应,Cr元素的化合价降低,I元素的化合价升高,由氧化剂的氧化性大于氧化产物的氧化性可知,证明氧化性为Cr2O72﹣>I2,故D正确;
【点评】本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重基本概念及分析能力、知识迁移应用能力的考查,选项B为解答的易错点,题目难度不大.
16.8分,
(1)单质;Ba(OH)2;
(2)盐酸;
(3)Fe + 2H+=Fe2+ + H2;
(4)H++OH-=H2O;
【解析】
试题分析:(1)纯净物分为单质和化合物; Ba(OH)2是由钡离子和氢氧根离子组成的化合物,属于碱;故答案为:单质;Ba(OH)2;
(2)上述五种物质分别是①铁②氢气③盐酸⑤碳酸氢钠④氢氧化钡;有一种物质盐酸能与其他三种物质:金属铁、碳酸氢钠、氢氧化钡之间发生反应.故答案为:盐酸;
(3)盐酸和铁发生置换反应,离子方程式为:Fe+2H+=Fe2++H2↑;故答案为:Fe+2H+=Fe2++H2↑;
(4)过量的盐酸和氢氧化钡反应的离子方程式为:H++OH-=H2O,故答案为:H++OH-=H2O。
考点:考查了物质的分类、物质间性质的反应的相关知识。
17.
【解析】略
18.铁(或Fe) 浓度 还原性 ②③⑤ abdce B
【解析】
【详解】
(1)由题中数据可知:铁(或Fe)元素含量偏低,故答案为:铁(或Fe);
(2)报告单中μmol/L是浓度的单位,故答案为:浓度;
(3)服用维生素C可使食物中的Fe3+转化为Fe2+,Fe元素的化合价降低被还原,则维生素C所起还原作用,故答案为:还原性;
(4)盐是由金属阳离子或铵根离子与酸根阴离子组成的化合物,属于盐的是K2SO4、 KMnO4 、AgNO3,故答案为:②③⑤;
(5)①溶液配制的操作步骤为:计算、称量、溶解、冷却、转移、洗涤、定容、摇匀等,
所以操作步骤的正确顺序为abdce,故答案为:abdce;
②A.使用容量瓶前要检查它是否漏水,故A正确;B. 容量瓶在使用前未干燥,里面有少量蒸馏水,对溶液的浓度无影响,故B错误;C.溶液配制好以后要摇匀,摇匀的操作方法为:盖好瓶塞,用一只手的食指顶住瓶塞,另一只手的手指托住瓶底,把容量瓶倒转和摇动几次,故C正确;故答案为:B;
(6)在“鲜花保鲜剂”中,含有K+的物质为硫酸钾和高锰酸钾,利用二者的含量进行计算,则有K+的物质的量浓度=mol/L,故答案为:。
19.4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3Al3+ + 3[Al(OH)4]- = 4Al(OH)3↓Cu2+ + 2NH3?H2O = Cu(OH)2↓+ 2NH4+Cu(OH)2 + 4NH3?H2O = [Cu(NH3)4]2+ + 2OH- + 4H2OAl3+ + 2SO42- + 2Ba2+ + 4OH-=[Al(OH)4]- + 2BaSO4↓
【解析】
【详解】
(1)新制氢氧化亚铁被氧气氧化为氢氧化铁,其化学方程式为 4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3;因此本题答案是:4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3 。
(2)氯化铝溶液水解显酸性,四羟基合铝酸钠溶液水解显碱性,二者混合相互促进水解生成Al(OH)3,离子方程式:Al3+ + 3[Al(OH)4]- =4Al(OH)3↓;因此本题答案是:Al3+ + 3[Al(OH)4]- = 4Al(OH)3↓。
(3)向硫酸铜溶液中逐滴滴加氨水先生成氢氧化铜蓝色沉淀,氨水过量后,氢氧化铜溶于过量的氨水中生成络合物,离子方程式是Cu2+ +2NH3?H2O = Cu(OH)2↓+ 2NH4+; Cu(OH)2 + 4NH3?H2O = [Cu(NH3)4]2+ +2OH- + 4H2O;综上所述,本题答案是: Cu2+ + 2NH3?H2O = Cu(OH)2↓+ 2NH4+; Cu(OH)2 + 4NH3?H2O = [Cu(NH3)4]2+ + 2OH- + 4H2O。
(4)假设硫酸铝钾物质的量为1mol, SO42-的量为2mol,需要2mol Ba(OH)2至SO42-全部沉淀,同时生成偏铝酸钾,离子方程式Al3++2SO42-+2Ba2+ + 4OH-=[Al(OH)4]- +2BaSO4↓;综上所述,本题答案是:Al3++2SO42-+2Ba2+ +4OH-=[Al(OH)4]- +2BaSO4↓。
20.交叉分类法 ③⑤ FeCl3+ 3H2OFe(OH)3(胶体)+3HCl 负 胶体聚沉 H+ +HCO3- = CO2 + H2O 3H+ +Al(OH)3 =Al3+ + 3H2O Ca(OH)2 + 2CO2 = Ca2++2HCO3-
【解析】
【分析】
(1)由交叉分类法可知,KNO3既是钾盐又是硝酸盐;
(2)六种物质中属于电解质的是KNO3、液态HCl、NaHCO3,属于非电解质的是CO2,既不是电解质也不是非电解质的是铜丝、Fe(OH)3胶体;
(3)实验室制备氢氧化铁胶体是在沸腾的蒸馏水中加入饱和氯化铁溶液,当溶液变为红褐色时立即停止加热;阳极附近橘红色加深,说明Sb2S3胶粒带负电荷;带相反电荷Fe(OH)3与硫化锑胶体混合会发生聚沉;
(4)胃酸中含有盐酸,盐酸能与NaHCO3、Al(OH)3反应,治疗胃酸过多;氢氧化钙与二氧化碳反应生成难溶性的碳酸钙,通入过量的二氧化碳,二氧化碳和碳酸钙和水反应生成易溶于水的碳酸氢钙,浑浊变澄清。
【详解】
(1)由交叉分类法可知,KNO3既是钾盐又是硝酸盐,故答案为:交叉分类法;
(2)六种物质中属于电解质的是KNO3、液态HCl、NaHCO3,属于非电解质的是CO2,铜丝是金属单质、Fe(OH)3胶体是化合物,既不是电解质也不是非电解质,故答案为:③⑤;
(3)实验室制备氢氧化铁胶体是在沸腾的蒸馏水中加入饱和氯化铁溶液,当溶液变为红褐色时立即停止加热,反应的化学方程式为FeCl3+ 3H2OFe(OH)3(胶体)+3HCl;插入电极后通直流电,发现阳极附近橘红色加深,说明Sb2S3胶粒带负电荷;Fe(OH)3与硫化锑胶体混合,带正电荷的Fe(OH)3胶粒与带负电荷Sb2S3胶粒发生聚沉,体系变浑浊,故答案为:FeCl3+ 3H2OFe(OH)3(胶体)+3HCl;负;胶体聚沉;
(4)胃酸中含有盐酸,NaHCO3能治疗胃酸过多,是因为盐酸与碳酸氢钠反应生成氯化钠和水、二氧化碳,反应的离子方程式:H++HCO3-=H2O+CO2↑;氢氧化铝与盐酸反应生成氯化铝和水,反应的离子方程式:Al(OH)3+3H+=Al3++3H2O;向浑浊石灰水中通入二氧化碳,氢氧化钙与二氧化碳反应生成难溶性的碳酸钙,通入过量的二氧化碳,二氧化碳和碳酸钙和水反应生成易溶于水的碳酸氢钙,浑浊变澄清,反应的总离子方程式为:Ca(OH)2 + 2CO2 = Ca2++2HCO3-,故答案为:H++HCO3-=H2O+CO2↑;Al(OH)3+3H+=Al3++3H2O;Ca(OH)2 + 2CO2 = Ca2++2HCO3-。
21.(1)Ag+;Ag++Cl-==AgCl↓;
(2)Al3+ ;Mg2+ ;Al3++3OH-==Al(OH)3↓;Al(OH)3 +OH-==AlO2-+2H2O;
(3)Ba2+ ; Ba2++SO42-==BaSO4↓
【解析】
试题分析:(1)向溶液中加入过量的盐酸,有白色沉淀生成.则肯定含有的离子是Ag+,因为只有氯化银不溶于酸中,答案为:Ag+ ; Ag+ + Cl- ==AgCl ↓;(2)将(1)所得的溶液过滤后,往滤液中逐渐加入NaOH溶液,有白色沉淀生成,可能是Mg(OH)2和Al(OH)3沉淀,但是继续加入NaOH溶液,沉淀全部溶解,得到澄清溶液,Mg(OH)2不能溶于氢氧化钠中,所以只可能是Al(OH)3,肯定含有的离子是Al3+,肯定不含的是Mg2+,发生的离子方程式为:Al3+ + 3OH- ==Al(OH)3 ↓; Al(OH)3 + OH- -== AlO2- +2H2O;答案为:Al3+ ; Mg2+ ;Al3+ + 3OH- ==Al(OH)3 ↓;Al(OH)3 + OH- -== AlO2- +2H2O;(3)在(2)所得的澄清溶液中加入Na2SO4溶液,产生白色沉淀.则肯定含有的离子是Ba2+,离子方程式为:Ba2+ + SO42-==BaSO4↓,答案为:Ba2+ ; Ba2+ + SO42-==BaSO4 ↓。
考点:考查离子的鉴别
22.
(1)K+、NH4+、CO32-、SO42-;Mg2+、Fe3+;
(2)Cl—
(3)c(K+)≥0.2mol/L、c(NH4+)=0.4mol/L
【解析】
试题分析:由I实验可知,向第一份溶液中加入AgNO3溶液,有白色沉淀产生,白色沉淀为AgCl或碳酸银、硫酸银;由Ⅱ可知,向第二份溶液中加入足量NaOH 溶液后加热,收集到0.896L(标准状况)气体,气体为氨气,其物质的量为=0.04mol,原溶液中一定含NH4+;由Ⅲ可知,向第三份溶液中加入足量BaCl2溶液,得到沉淀6.27g,沉淀经足量盐酸洗涤后剩余2.33g,则含SO42-的物质的量为=0.01mol,含CO32-的物质的量为=0.02mol,由离子共存可知,一定不存在Fe3+、Mg2+,由电荷守恒可知,0.01mol×2+0.02mol×2>0.04mol,可知一定含阳离子K+,不能确定是否含Cl-。
(1)由上述分析可知,一定存在K+、NH4+、CO32-、SO42-,一定不存在Fe3+、Mg2+,故答案为:K+、NH4+、CO32-、SO42;Fe3+、Mg2+;
(2)由上述分析可知,可能存在Cl-;故答案为:Cl-;
(3)根据电荷守恒,正电荷为:n(+)=n(NH4+)=0.04mol,c(-)=2c(CO32-)+2c(SO42-)=0.06mol,总正电荷小于负电荷,则原溶液中一定含有K+,至少为0.02mol, c(K+)≥0.2mol/L;根据上述分析,NH4+的物质的量为0.04mol,c(NH4+)=0.4mol/L,故答案为:c(K+)≥0.2mol/L、c(NH4+)=0.4mol/L。
考点:考查了常见离子的检验方法的相关知识。
23.(10分)
(1)27.8 g ①偏低 ②偏低
(2)CO32-、Na+;HCO3-、S2-
【解析】
试题分析:
(1)配制500mL 0.2 mol·L-1 FeSO4溶液,需要称取绿矾(FeSO4·7H2O)的质量m=0.500L×0.2 mol·L-1 × 278g/mol=27.8g,故答案为:27.8g;①用以溶解FeSO4·7H2O烧杯未洗涤,则溶质物质的量减小,FeSO4溶液的物质的量浓度偏低;②摇匀后发现液面低于刻度线再加水,则溶液体积偏大,FeSO4溶液的物质的量浓度偏低;
(2)过氧化钠先和水反应生成NaOH和O2,NaOH在水溶液中能电离出自由移动的OH-,OH-能和HCO3-反应生成CO32-和水。除此之外,过氧化钠也能氧化S2-为S单质,所以溶液中增加的离子为CO32-、Na+,减少的离子为HCO3-、S2-。
考点:溶液配制,离子反应
24.(1)CO、AlO(2)I-Fe3+、NO
CCl4层呈紫红色,则原溶液中存在I-;Fe3+、NO在该环境中与I-不能共存
(3)Al3+、NH;Al(OH)3+OH-===AlO+2H2O;NH+OH-NH3↑+H2O
(4)Ba2+;SO
【解析】
试题分析:(1)①溶液呈强酸性肯定含有氢离子,所以一定不含有CO、AlO;
(2)②加入少量CCl4及数滴新制的氯水,经振荡CCl4层呈紫红色,一定含有碘离子,一定不含有NO3-、Fe3+;理由是CCl4层呈紫红色,则原溶液中存在I-;Fe3+、NO在该环境中与I-不能共存
(3)③逐滴加入NaOH溶液,A.溶液从酸性变为碱性;B.溶液逐渐产生沉淀;C.沉淀完全溶解;说明溶液中一定含有Al3+,D.最后加热溶液,有气体放出,该气体能使湿润的红色石蕊试纸变蓝,该气体为氨气,则原溶液中一定含有NH4+ ;c、d发生反应的离子方程式为Al(OH)3+OH-===AlO+2H2O 、NH+OH-NH3↑+H2O。
(4)④另取③的部分碱性溶液,向其中加入Na2CO3溶液,有白色沉淀产生,肯定含有Ba2+,一定不含有SO42-。
【考点定位】考查离子检验
【名师点睛】本题考查常见离子的检验方法。要求熟练掌握常见离子的检验方法,能够根据反应现象推断存在的离子。①溶液呈强酸性肯定含有氢离子,与氢离子反应的离子不能共存;②入少量CCl4及数滴新制的氯水,经振荡CCl4层呈紫红色,一定含有碘离子,与碘离子反应的离子不能共存;③加入NaOH溶液,A.溶液从酸性变为碱性性;B.溶液逐渐产生沉淀;C.沉淀完全溶解;说明溶液中一定含有Al3+,D.最后加热溶液,有气体放出,该气体能使湿润的红色石蕊试纸变蓝,该气体为氨气,则原溶液中一定含有NH4+ ;④取取③的部分碱性溶液,向其中加入Na2CO3溶液,有白色沉淀产生,肯定含有Ba2+,能够与钡离子反应的离子不能存在,根据以上分析完成各题即可。
25.
(1)0.5mol;(2)5mol/L;(3)52.9%
【解析】
试题分析:(1)标准状况下5.6L氢气的物质的量为:n(H2)==0.25mol,
根据电子守恒,生成0.25mol氢气转移的电子的物质的量为:0.25mol×2=0.5mol,答:反应过程中,转移电子的物质的量为0.5mol;
(2)设5.1g镁铝合金中含有镁xmol,含有铝ymol,则
Mg+2HCl=MgCl2+H2↑,
1 2 1
x 2x x
2Al+6HCl=2AlCl3+3H2↑,
2 6 3
y 3y y
x+y=0.25,24x+27y=5.1,解得:x=0.1,y=0.1,
反应消耗的盐酸的总物质的量为:2x+3y=0.1mol×2+0.1mol×3=0.5mol,
盐酸的物质的量浓度为:c(HCl)==5mol/L,
答:该盐酸的物质的量浓度为5mol/L;
(3)该合金中铝的质量分数为:w(Al)=×100%≈52.9%,
故:该合金中铝的质量分数为52.9%。
【考点定位】考查混合物的计算
【名师点晴】本题考查了有关混合物的计算,题目难度中等,注意掌握物质的量浓度、质量分数的表达式,明确反应原理为解答本题的关键,试题培养了学生的分析、理解能力及计算能力。
26.
(1)
(2)①10.88g②0.25mol
【解析】
试题分析:(1)反应中Mn元素化合价降低,化合价由+4价降低到+2价,Cl元素化合价升高,由-1价升高到0价,氧化还原反应中得失电子数目相等,表现为化合价升降的总数相等,可表示为;
(2)n(Cl2)==0.125mol,
①MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
87g1mol
m0.125mol
m=10.88g;
②MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O被氧化HCl
1mol2mol
0.125moln
n=0.25mol。
考点:考查氧化还原反应
