课题1 海带中碘元素的分离及检验(浙江省杭州市)
文档属性
| 名称 | 课题1 海带中碘元素的分离及检验(浙江省杭州市) |

|
|
| 格式 | rar | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2008-05-09 00:00:00 | ||
图片预览







文档简介
课件29张PPT。一、物质的分离与提纯1、分离:将相互混在一起的不同物质彼此分开而得到相应的各个组分的过程。提纯:把物质中混有的杂质除去的过程。课题1、海带中碘元素的分离与检验“不增、不减、易行、复原”二、物质分离、提纯的基本原则(1)不增加新的杂质
(2)不减少主要成分的含量
(3)操作方法简单,易于进行
(4)如果将主要成分进行了转化,最后要能将其还原回顾根据必修二所学回顾物质分离提纯的方法有哪些?过滤、蒸发、结晶、萃取、 分液、蒸馏、渗析、盐析、升华1、适用范围 : 一贴 操作要点:二低三靠2、注意事项过滤固体(不溶)— 液体分离如除去粗盐中的泥沙。回顾结晶蒸发结晶:冷却热饱和溶液结晶:根据物质在溶剂中溶解度的不同,用来分离和提纯几种可溶性固体的混合物溶解度随温度的变化较大加热蒸发皿使溶液蒸发时,要用玻璃棒不断搅动溶液;当蒸发皿中出现较多的固体时,即停止加热,利用余热蒸干萃取、分液 1、适用范围 萃取——利用溶质在互不相溶的溶剂里的溶解度不同,用一种溶剂把溶质从它与另一种溶剂所组成的溶液中提取出来的方法分液——分离两种互不相溶的液体 (密度不同) 例如:从碘水中提取碘 2、主要操作步骤:
检漏、装液、震荡、静置、分液回顾3、注意事项 阅读课本P3页①分液漏斗的使用②萃取剂的要求: 与原溶剂互不相溶;溶质在其中的溶解度比在原溶剂中大的多;且易挥发。分液时打开上面的活塞,下层的液体从下口流出,上层液体从上面倒出。④萃取分液后得到的仍是溶液,
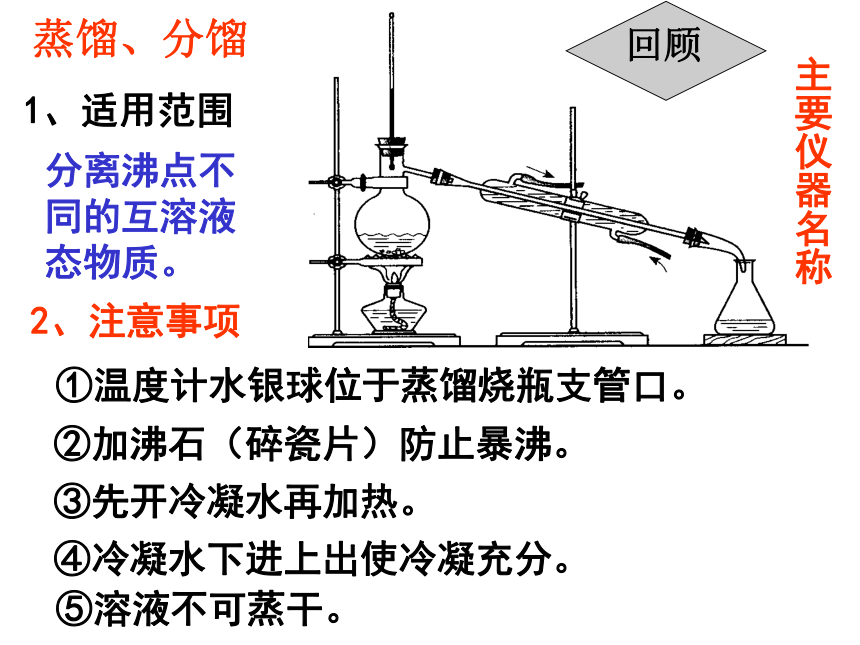
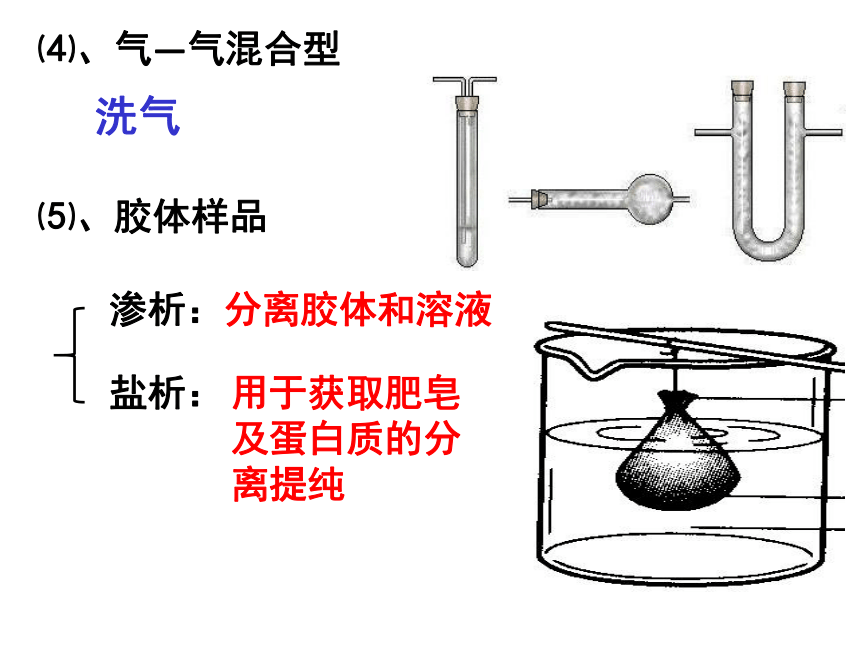
一般需蒸馏进一步分离。回顾③萃取、分液操作蒸馏、分馏 1、适用范围 分离沸点不同的互溶液态物质。 主要仪器名称回顾2、注意事项①温度计水银球位于蒸馏烧瓶支管口。②加沸石(碎瓷片)防止暴沸。③先开冷凝水再加热。④冷凝水下进上出使冷凝充分。⑤溶液不可蒸干。 三、物质分离、提纯的方法(P3)⑴、固—固混合分离型⑵、固—液混合分离型过滤:分离不溶性固体与液体蒸发、结晶(重结晶)部分溶解:过滤全溶解:②溶解:灼烧、升华、热分解法①加热:⑶、液—液混合分离型互不溶:互相溶:蒸馏(分馏)萃取、分液⑷、气—气混合型洗气⑸、胶体样品渗析:盐析:分离胶体和溶液用于获取肥皂及蛋白质的分离提纯课题1、海带中碘元素的分离与检验小知识碘是人体生长发育不可缺少的微量元素之一。人若摄入碘量不足,会引起甲状腺肿大病;儿童缺碘,则严重影响其智力发展,导致智商低下,因此,人们将碘称为智慧元素。
经常吃些海带、紫菜等海藻类植物,可以防治甲状腺肿大,这是由于海带中富含碘。 某些食物中的碘元素含量主要成分蛋白质、糖类、脂肪、纤维素、褐藻胶、甘露醇、维生素、有机碘化物等有机物。氯化钠、碳酸钠、硫酸钠、碘化钠等无机盐。次要成分海带的成分设计从海带中提取碘的实验方案活动探究干海带灰 烬浊 液滤 液
混合液上 层
下 层
碘单质
灼烧滤 渣二、从海带中提取碘的实验方案水浸过滤酸化CCl4
萃取分液蒸馏氧化淀粉溶液1、灼烧的作用是什么?
将干海带高温灼烧,使有机物转化为CO2和H2O,呈气态逸散。坩埚、坩埚钳、三角架、泥三角、酒精灯2、灼烧海带时用到哪些仪器?注意热坩埚不能放在桌面上!!!3、水浸时常常要将悬浊液煮沸2~3min,目的是什么?加快碘化物在水中的溶解,以使灰烬中的I-尽可能多的进入溶液。 4、酸化作用是什么?海带灰的浸出液中含有碳酸钠(碳酸钾)等使溶液显碱性的物质,酸化的目的是使溶液呈弱酸性,有利于氧化剂把I-氧化为I2。5、你认为最好选用哪种氧化剂?问3氧化2I- + H2O2 + 2H+ = I2 + 2H2O
2I- + Cl2 = 2Cl- + I2注意: 若氯水过量,则Cl2能进一步将碘单质氧化。 I- + 3Cl2+ 3H2O= 6Cl- + IO3-+6H+ 思考:若用碘盐中的KIO3作氧化剂,在酸性溶液中氧化I-,写出反应的离子方程式.5I- + IO3- + 6H+ = 3I2 + 3H2O氯水、双氧水等若要分离碘的CCl4溶液,分别得到碘和CCl4,应采用什么方法?
已知:四氯化碳的沸点:77℃
碘单质的沸点:184.35 ℃将碘的四氯化碳溶液进行蒸馏。三、海带中碘的提取实验1、实验原理2I- + 2H+ + H2O2 = I2 + 2H2O2I- + Cl2 = I2 + 2Cl-2、实验流程:称取样品灼烧灰化溶解过滤氧化检验萃取分液3、实验步骤及注意事项:(1)称取样品①操作要点:用托盘天平称取约2g干燥的海带,
放入坩埚中。②实验注意事项:托盘天平的正确使用。(2)灼烧灰化①操作要点:在通风处加热灼烧干海带,待海带完全
灰化后,冷却,再将灰分转移到小烧杯中。②实验现象:灼烧灰化的过程大约需要5-6分钟,干
海带逐渐变的更干燥、卷曲,最后变成
黑色粉末或细小颗粒。期间还会产生大
量白烟,并伴有焦糊味。③实验注意事项:应在通风处加热灼烧,或使用通风设备去除白烟和难闻的气味。应边加热边搅拌,用坩埚钳夹持坩埚,玻璃棒小心搅拌,使海带均匀受热,加快灰化的速度。 灼烧完毕,应将坩埚和玻璃棒放在石棉网上冷却,不可直接放在冷的实验台上,防止温度很高的坩埚
骤冷而破裂坩埚要倾斜加热灼烧(3)溶解过滤②实验现象:
煮沸时固体未见明显溶解,过滤后得到淡黄
色的溶液。①操作要点:
向小烧杯中加入约15ml蒸馏水,煮沸2-3min,
过滤,并用约1ml蒸馏水洗涤沉淀得滤液。③实验注意事项:
应隔着石棉网加热小烧杯中的混合物。
加热过程中应不断搅拌,加快溶解,同时防止液体受热不均而溅出。
过滤操作应注意“一贴、二低、三靠” 。 (4)氧化及检验①操作要点:
在滤液中加入2吸管2mol·L-1H2SO4溶液,再加入4吸管6%的H2O2溶液。取出少许混合液,用淀粉溶液检验碘单质。③实验注意事项:控制试剂的用量;检验碘元素应取少量样品,不要向所有滤液中直接加淀粉溶液,否则后续实验将无法操作。 ②实验现象: 加入氧化剂后溶液颜色变深,呈棕黄色。加淀粉,溶液变蓝色。(5)萃取分液①操作要点:
将氧化检验后的余液转入分液漏斗中,加入2mlCCl4,充分振荡,将上口塞子打开,静置,待完全分层后,分液。
②实验现象:加入CCl4振荡后,液体分层,且下层液体显紫红色,上层液体几乎无色。漏斗上口向下倾斜振荡、放气萃取打开上部旋塞,慢慢放液分液下层的液体从下口流出,上层液体从上面倒出【练习】海带中含有丰富的碘。为了从海中提取碘,某研究性学习小组设计并进行了以下实验:
海
藻①灼烧海
藻
灰海藻灰
悬浊液含碘离
子溶液含碘
水溶液含碘
苯溶液②浸泡③ ④MnO2+ 稀H2SO4⑤提取碘 ⑥单质碘(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是 A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥器BDE(2)步骤③的实验操作名称是 ;步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是 。 (3)步骤④反应的离子方程式是 。过滤蒸馏2I-+MnO2+4H+=Mn2++I2+2H2O【练习】海带中含有丰富的碘。为了从海中提取碘,某研究性学习小组设计并进行了以下实验:
海
藻①灼烧海
藻
灰海藻灰
悬浊液含碘离
子溶液含碘
水溶液含碘
苯溶液②浸泡③ ④MnO2+ 稀H2SO4⑤提取碘 ⑥单质碘【练习】海带中含有丰富的碘。为了从海中提取碘,某研究性学习小组设计并进行了以下实验:
海
藻①灼烧海
藻
灰海藻灰
悬浊液含碘离
子溶液含碘
水溶液含碘
苯溶液②浸泡③ ④MnO2+ 稀H2SO4⑤提取碘 ⑥单质碘(4)步骤⑤中,某学生选择用苯来提取碘的理由苯与水互不相溶;碘在苯中的溶解度比在水中大【练习】海带中含有丰富的碘。为了从海中提取碘,某研究性学习小组设计并进行了以下实验:
海
藻①灼烧海
藻
灰海藻灰
悬浊液含碘离
子溶液含碘
水溶液含碘
苯溶液②浸泡③ ④MnO2+ 稀H2SO4⑤提取碘 ⑥单质碘(5)请设计一种检验提取碘后的水溶液中是否还有单质碘的简单方法:取少量提取碘后的水溶液于试管中,加入几滴淀粉试液;观察是否出现蓝色。如果变蓝,说明还有单质碘;反之,说明没有单质碘。
(2)不减少主要成分的含量
(3)操作方法简单,易于进行
(4)如果将主要成分进行了转化,最后要能将其还原回顾根据必修二所学回顾物质分离提纯的方法有哪些?过滤、蒸发、结晶、萃取、 分液、蒸馏、渗析、盐析、升华1、适用范围 : 一贴 操作要点:二低三靠2、注意事项过滤固体(不溶)— 液体分离如除去粗盐中的泥沙。回顾结晶蒸发结晶:冷却热饱和溶液结晶:根据物质在溶剂中溶解度的不同,用来分离和提纯几种可溶性固体的混合物溶解度随温度的变化较大加热蒸发皿使溶液蒸发时,要用玻璃棒不断搅动溶液;当蒸发皿中出现较多的固体时,即停止加热,利用余热蒸干萃取、分液 1、适用范围 萃取——利用溶质在互不相溶的溶剂里的溶解度不同,用一种溶剂把溶质从它与另一种溶剂所组成的溶液中提取出来的方法分液——分离两种互不相溶的液体 (密度不同) 例如:从碘水中提取碘 2、主要操作步骤:
检漏、装液、震荡、静置、分液回顾3、注意事项 阅读课本P3页①分液漏斗的使用②萃取剂的要求: 与原溶剂互不相溶;溶质在其中的溶解度比在原溶剂中大的多;且易挥发。分液时打开上面的活塞,下层的液体从下口流出,上层液体从上面倒出。④萃取分液后得到的仍是溶液,
一般需蒸馏进一步分离。回顾③萃取、分液操作蒸馏、分馏 1、适用范围 分离沸点不同的互溶液态物质。 主要仪器名称回顾2、注意事项①温度计水银球位于蒸馏烧瓶支管口。②加沸石(碎瓷片)防止暴沸。③先开冷凝水再加热。④冷凝水下进上出使冷凝充分。⑤溶液不可蒸干。 三、物质分离、提纯的方法(P3)⑴、固—固混合分离型⑵、固—液混合分离型过滤:分离不溶性固体与液体蒸发、结晶(重结晶)部分溶解:过滤全溶解:②溶解:灼烧、升华、热分解法①加热:⑶、液—液混合分离型互不溶:互相溶:蒸馏(分馏)萃取、分液⑷、气—气混合型洗气⑸、胶体样品渗析:盐析:分离胶体和溶液用于获取肥皂及蛋白质的分离提纯课题1、海带中碘元素的分离与检验小知识碘是人体生长发育不可缺少的微量元素之一。人若摄入碘量不足,会引起甲状腺肿大病;儿童缺碘,则严重影响其智力发展,导致智商低下,因此,人们将碘称为智慧元素。
经常吃些海带、紫菜等海藻类植物,可以防治甲状腺肿大,这是由于海带中富含碘。 某些食物中的碘元素含量主要成分蛋白质、糖类、脂肪、纤维素、褐藻胶、甘露醇、维生素、有机碘化物等有机物。氯化钠、碳酸钠、硫酸钠、碘化钠等无机盐。次要成分海带的成分设计从海带中提取碘的实验方案活动探究干海带灰 烬浊 液滤 液
混合液上 层
下 层
碘单质
灼烧滤 渣二、从海带中提取碘的实验方案水浸过滤酸化CCl4
萃取分液蒸馏氧化淀粉溶液1、灼烧的作用是什么?
将干海带高温灼烧,使有机物转化为CO2和H2O,呈气态逸散。坩埚、坩埚钳、三角架、泥三角、酒精灯2、灼烧海带时用到哪些仪器?注意热坩埚不能放在桌面上!!!3、水浸时常常要将悬浊液煮沸2~3min,目的是什么?加快碘化物在水中的溶解,以使灰烬中的I-尽可能多的进入溶液。 4、酸化作用是什么?海带灰的浸出液中含有碳酸钠(碳酸钾)等使溶液显碱性的物质,酸化的目的是使溶液呈弱酸性,有利于氧化剂把I-氧化为I2。5、你认为最好选用哪种氧化剂?问3氧化2I- + H2O2 + 2H+ = I2 + 2H2O
2I- + Cl2 = 2Cl- + I2注意: 若氯水过量,则Cl2能进一步将碘单质氧化。 I- + 3Cl2+ 3H2O= 6Cl- + IO3-+6H+ 思考:若用碘盐中的KIO3作氧化剂,在酸性溶液中氧化I-,写出反应的离子方程式.5I- + IO3- + 6H+ = 3I2 + 3H2O氯水、双氧水等若要分离碘的CCl4溶液,分别得到碘和CCl4,应采用什么方法?
已知:四氯化碳的沸点:77℃
碘单质的沸点:184.35 ℃将碘的四氯化碳溶液进行蒸馏。三、海带中碘的提取实验1、实验原理2I- + 2H+ + H2O2 = I2 + 2H2O2I- + Cl2 = I2 + 2Cl-2、实验流程:称取样品灼烧灰化溶解过滤氧化检验萃取分液3、实验步骤及注意事项:(1)称取样品①操作要点:用托盘天平称取约2g干燥的海带,
放入坩埚中。②实验注意事项:托盘天平的正确使用。(2)灼烧灰化①操作要点:在通风处加热灼烧干海带,待海带完全
灰化后,冷却,再将灰分转移到小烧杯中。②实验现象:灼烧灰化的过程大约需要5-6分钟,干
海带逐渐变的更干燥、卷曲,最后变成
黑色粉末或细小颗粒。期间还会产生大
量白烟,并伴有焦糊味。③实验注意事项:应在通风处加热灼烧,或使用通风设备去除白烟和难闻的气味。应边加热边搅拌,用坩埚钳夹持坩埚,玻璃棒小心搅拌,使海带均匀受热,加快灰化的速度。 灼烧完毕,应将坩埚和玻璃棒放在石棉网上冷却,不可直接放在冷的实验台上,防止温度很高的坩埚
骤冷而破裂坩埚要倾斜加热灼烧(3)溶解过滤②实验现象:
煮沸时固体未见明显溶解,过滤后得到淡黄
色的溶液。①操作要点:
向小烧杯中加入约15ml蒸馏水,煮沸2-3min,
过滤,并用约1ml蒸馏水洗涤沉淀得滤液。③实验注意事项:
应隔着石棉网加热小烧杯中的混合物。
加热过程中应不断搅拌,加快溶解,同时防止液体受热不均而溅出。
过滤操作应注意“一贴、二低、三靠” 。 (4)氧化及检验①操作要点:
在滤液中加入2吸管2mol·L-1H2SO4溶液,再加入4吸管6%的H2O2溶液。取出少许混合液,用淀粉溶液检验碘单质。③实验注意事项:控制试剂的用量;检验碘元素应取少量样品,不要向所有滤液中直接加淀粉溶液,否则后续实验将无法操作。 ②实验现象: 加入氧化剂后溶液颜色变深,呈棕黄色。加淀粉,溶液变蓝色。(5)萃取分液①操作要点:
将氧化检验后的余液转入分液漏斗中,加入2mlCCl4,充分振荡,将上口塞子打开,静置,待完全分层后,分液。
②实验现象:加入CCl4振荡后,液体分层,且下层液体显紫红色,上层液体几乎无色。漏斗上口向下倾斜振荡、放气萃取打开上部旋塞,慢慢放液分液下层的液体从下口流出,上层液体从上面倒出【练习】海带中含有丰富的碘。为了从海中提取碘,某研究性学习小组设计并进行了以下实验:
海
藻①灼烧海
藻
灰海藻灰
悬浊液含碘离
子溶液含碘
水溶液含碘
苯溶液②浸泡③ ④MnO2+ 稀H2SO4⑤提取碘 ⑥单质碘(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是 A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥器BDE(2)步骤③的实验操作名称是 ;步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是 。 (3)步骤④反应的离子方程式是 。过滤蒸馏2I-+MnO2+4H+=Mn2++I2+2H2O【练习】海带中含有丰富的碘。为了从海中提取碘,某研究性学习小组设计并进行了以下实验:
海
藻①灼烧海
藻
灰海藻灰
悬浊液含碘离
子溶液含碘
水溶液含碘
苯溶液②浸泡③ ④MnO2+ 稀H2SO4⑤提取碘 ⑥单质碘【练习】海带中含有丰富的碘。为了从海中提取碘,某研究性学习小组设计并进行了以下实验:
海
藻①灼烧海
藻
灰海藻灰
悬浊液含碘离
子溶液含碘
水溶液含碘
苯溶液②浸泡③ ④MnO2+ 稀H2SO4⑤提取碘 ⑥单质碘(4)步骤⑤中,某学生选择用苯来提取碘的理由苯与水互不相溶;碘在苯中的溶解度比在水中大【练习】海带中含有丰富的碘。为了从海中提取碘,某研究性学习小组设计并进行了以下实验:
海
藻①灼烧海
藻
灰海藻灰
悬浊液含碘离
子溶液含碘
水溶液含碘
苯溶液②浸泡③ ④MnO2+ 稀H2SO4⑤提取碘 ⑥单质碘(5)请设计一种检验提取碘后的水溶液中是否还有单质碘的简单方法:取少量提取碘后的水溶液于试管中,加入几滴淀粉试液;观察是否出现蓝色。如果变蓝,说明还有单质碘;反之,说明没有单质碘。
同课章节目录
- 专题一 物质的分离与提纯
- 课题1 海带中碘元素的分离及检验
- 拓展课题1-1 茶叶中某些元素的鉴定
- 课题2 用纸层析法分离铁离子和铜离子
- 拓展课题1-2 菠菜的叶绿体中色素的提取和分离
- 拓展课题1-3 用粉笔进行层析分离
- 课题3 硝酸钾晶体的制备
- 拓展课题1-4 粗盐提纯
- 专题二 物质性质的研究
- 课题1 铝及其化合物的性质
- 拓展课题2-1 铝热反应
- 课题2 乙醇和苯酚的性质
- 拓展课题2-2 苯酚与甲醛的反应
- 专题三 物质的检验与鉴别
- 课题1 牙膏和火柴中某些成分的检验
- 拓展课题3-1 新装修居室内空气中甲醛浓度的检测
- 拓展课题3-2 汽车尾气成分的检验
- 课题2 亚硝酸钠和食盐的鉴别
- 拓展课题3-3 真假碘盐的鉴别
- 专题四 化学反应条件的控制
- 课题1 硫代硫酸钠与酸反应速率的影响因素
- 拓展课题4-1 “蓝瓶子”实验
- 课题2 催化剂对过氧化氢分解反应速率的影响
- 拓展课题4-2 过氧化氢酶的催化作用
- 拓展课题4-3 蔗糖的燃烧
- 课题3 反应条件对化学平衡的影响
- 拓展课题4-4 淀粉与碘显色现象的探究
- 拓展课题4-5 压强对化学平衡的影响
- 专题五 电化学问题研究
- 课题1 原电池
- 拓展课题5-1 干电池模拟实验
- 课题2 电解与电镀
- 拓展课题5-2 阿伏加德罗常数的测定
- 专题六 物质的定量分析
- 课题1 食醋总酸含量的测定
- 拓展课题6-1 配制并标定氢氧化钠溶液
- 课题2 镀锌铁皮锌镀层厚度的测定
- 拓展课题6-2 水果中维生素C含量的测定
- 专题七 物质的制备与合成
- 课题1 硫酸亚铁铵的制备
- 拓展课题7-1 用制氢废液制备硫酸锌晶体
- 课题2 阿司匹林的合成
- 拓展课题7-2 对氨基苯磺酸的合成
