课题3 硝酸钾晶体的制备(浙江省杭州市)
文档属性
| 名称 | 课题3 硝酸钾晶体的制备(浙江省杭州市) |

|
|
| 格式 | rar | ||
| 文件大小 | 23.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2008-05-09 00:00:00 | ||
图片预览





文档简介
课件12张PPT。专题1课题3 硝酸钾晶体的制备 一、实验目的 1、观察验证盐类溶解度和温度的关系;
2、利用物质溶解度随温度变化的差别,学
习用转化法制备硝酸钾;
3、熟悉溶解、蒸发、结晶、过滤等技术,学会用重结晶法提纯物质。 使晶体从溶液中析出的过程1、常见的结晶方式有哪几种?①蒸发结晶:二:结晶:通过蒸发浓缩溶液使溶质析出。适用于溶解度随温度变化不大的溶质(1)蒸发过程应不断搅拌 (2)出现较多固体时即停止加热,用余热蒸干 防止液体局部过热而使液滴或晶体飞溅。 先蒸发、浓缩溶液,再降温使溶解度随温度变化较大的溶质析出,此时杂质在溶剂中尚未饱和如KNO3中含有少量的NaCl②降温结晶(冷却热饱和溶液)过滤方法有3种 ① 常压过滤:用内衬滤纸的锥形玻璃漏斗过滤,滤液靠自身的重力透过滤纸流下,实现分离。 ② 减压过滤(抽气过滤): 包括布氏漏斗,抽滤瓶,安全瓶和抽气泵。 使过滤和洗涤的速度快,液体和固体分离得较完全,滤出的固体容易干燥。 装置:原理:滤液在内外压强差作用下通过滤纸实现分离优点:③ 加热过滤: 用锥形玻璃漏斗过滤热饱和溶液时,常因冷却导致在漏斗中或其颈部析出晶体,使过滤发生困难。此时用热水漏斗过滤。 热水漏斗是铜制的,内外壁间有空腔,可以盛水。热水漏斗中插一个玻璃漏斗。使用时在外壳支管处加热,可把夹层中的水烧热使漏斗保温。 三、实验原理 利用溶液中不同溶质的溶解度会随温度的变化而发生不同的变化,利用这一性质,将物质进行分离并提纯。
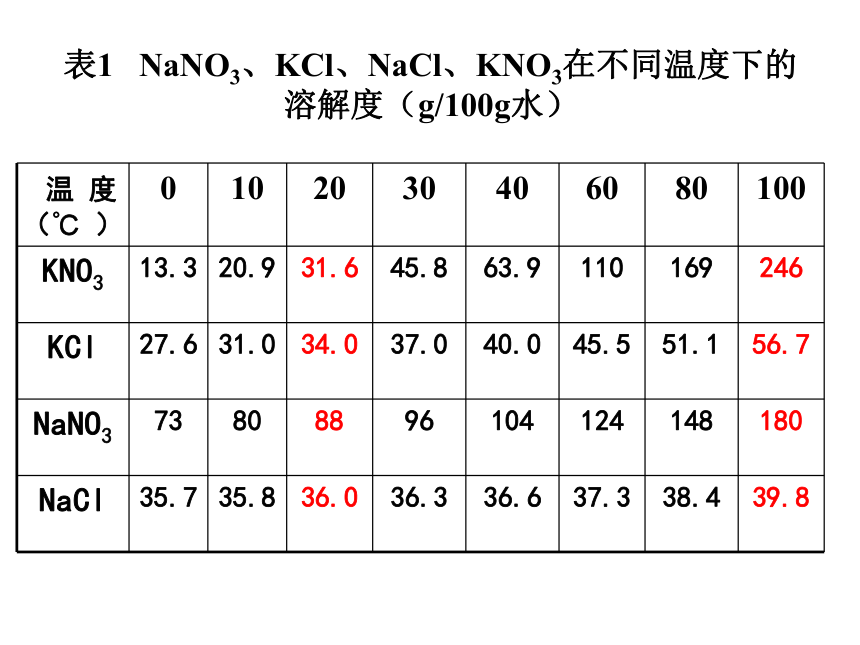
溶质溶解度随温度变化小的(如NaCl)采用蒸发结晶法;溶质溶解度随温度变化大的如(KNO3)采用冷却结晶法。表1 NaNO3、KCl、NaCl、KNO3在不同温度下的溶解度(g/100g水) 四、基本流程及所需仪器:1、固体溶解:天平、烧杯、玻璃棒、酒精灯2、蒸发、热过滤:铁架台、铜质保温漏斗3、冷却、减压过滤:吸滤瓶、
安全瓶、抽气泵、布氏漏斗4、重结晶:5、称量6、检验Cl-五、实验步骤 1、硝酸钾的制备
A、用小烧杯在天平上称取NaNO3 20g,KCl17g,加入35ml蒸馏水,加热至沸,使固体溶解。
B、继续加热、搅拌,待溶液蒸发至原来体积的1/2时,便可停止加热,趁热用热滤漏斗进行过滤。
C、将滤液冷却至室温,滤液中便有晶体析出。用减压过滤的方法分离并抽干此晶体,即得粗产品。 2、重结晶法提纯KNO3 将粗产品放在50ml烧杯中(留0.1g粗产品作纯度对比检验用),加入计算量的蒸馏水并搅拌之,用小火加热,直至晶体全部溶解为止。然后冷却溶液至室温,待大量晶体析出后减压过滤,晶体用滤纸吸干,放在表面皿上称重,并观察其外观。 3、产品纯度的检验 称取KNO3产品0.1g(剩余产品回收)放入盛有20ml蒸馏水的小烧杯中,溶解后取得1ml,稀释至100ml,取稀释液1ml放在试管中,加1~2滴0.1mol·L-1AgNO3溶液,观察有无AgCl白色沉淀产生。并与粗产品的纯度作比较。注意事项 1、将NaNO320g,KCl17g,放入烧杯中,加入35ml蒸馏水,使固体刚好全部溶解。
2、待溶液蒸发至原来体积的1/2时,便要停止加热,并趁热用热滤漏斗进行过滤。
3、重结晶法提纯KNO3中,将粗产品放在烧杯中,应加入计算量(2:1)的蒸馏水直至晶体刚好全部溶解为止。 思考1、能否将除去氯化钠后的滤液直接冷却制取硝酸钾? 思考2、实验中为何要乘热过滤除去NaCl晶体?六、实验操作要点热过滤:
趁热过滤,
得KNO3饱和溶液
(回收NaCl晶体)结晶:
KNO3溶液冷却有KNO3晶体析出蒸发:
小火加热
至有较多
晶体析出 溶解:
20g NaNO3
17g KCl
35ml水抽滤:得KNO3晶体,
用少量饱和KNO3溶液淋洗晶体称量:
称量得 ,
粗KNO3质量(1)制备KNO3粗品溶解:
按KNO3∶H2O= 2∶1
加适量水溶解2、KNO3提纯(重结晶)加热:
沸腾
即止冷却:
有针状
KNO3析出抽滤:
得KNO3晶体
用饱和KNO3淋洗烘干:
水浴烘干
(在表面皿中)称重:
精品
KNO3 g 将所得晶体溶于少量溶剂中,然后进行蒸发(或冷却)、结晶、过滤,如此反复的操作称为重结晶。
2、利用物质溶解度随温度变化的差别,学
习用转化法制备硝酸钾;
3、熟悉溶解、蒸发、结晶、过滤等技术,学会用重结晶法提纯物质。 使晶体从溶液中析出的过程1、常见的结晶方式有哪几种?①蒸发结晶:二:结晶:通过蒸发浓缩溶液使溶质析出。适用于溶解度随温度变化不大的溶质(1)蒸发过程应不断搅拌 (2)出现较多固体时即停止加热,用余热蒸干 防止液体局部过热而使液滴或晶体飞溅。 先蒸发、浓缩溶液,再降温使溶解度随温度变化较大的溶质析出,此时杂质在溶剂中尚未饱和如KNO3中含有少量的NaCl②降温结晶(冷却热饱和溶液)过滤方法有3种 ① 常压过滤:用内衬滤纸的锥形玻璃漏斗过滤,滤液靠自身的重力透过滤纸流下,实现分离。 ② 减压过滤(抽气过滤): 包括布氏漏斗,抽滤瓶,安全瓶和抽气泵。 使过滤和洗涤的速度快,液体和固体分离得较完全,滤出的固体容易干燥。 装置:原理:滤液在内外压强差作用下通过滤纸实现分离优点:③ 加热过滤: 用锥形玻璃漏斗过滤热饱和溶液时,常因冷却导致在漏斗中或其颈部析出晶体,使过滤发生困难。此时用热水漏斗过滤。 热水漏斗是铜制的,内外壁间有空腔,可以盛水。热水漏斗中插一个玻璃漏斗。使用时在外壳支管处加热,可把夹层中的水烧热使漏斗保温。 三、实验原理 利用溶液中不同溶质的溶解度会随温度的变化而发生不同的变化,利用这一性质,将物质进行分离并提纯。
溶质溶解度随温度变化小的(如NaCl)采用蒸发结晶法;溶质溶解度随温度变化大的如(KNO3)采用冷却结晶法。表1 NaNO3、KCl、NaCl、KNO3在不同温度下的溶解度(g/100g水) 四、基本流程及所需仪器:1、固体溶解:天平、烧杯、玻璃棒、酒精灯2、蒸发、热过滤:铁架台、铜质保温漏斗3、冷却、减压过滤:吸滤瓶、
安全瓶、抽气泵、布氏漏斗4、重结晶:5、称量6、检验Cl-五、实验步骤 1、硝酸钾的制备
A、用小烧杯在天平上称取NaNO3 20g,KCl17g,加入35ml蒸馏水,加热至沸,使固体溶解。
B、继续加热、搅拌,待溶液蒸发至原来体积的1/2时,便可停止加热,趁热用热滤漏斗进行过滤。
C、将滤液冷却至室温,滤液中便有晶体析出。用减压过滤的方法分离并抽干此晶体,即得粗产品。 2、重结晶法提纯KNO3 将粗产品放在50ml烧杯中(留0.1g粗产品作纯度对比检验用),加入计算量的蒸馏水并搅拌之,用小火加热,直至晶体全部溶解为止。然后冷却溶液至室温,待大量晶体析出后减压过滤,晶体用滤纸吸干,放在表面皿上称重,并观察其外观。 3、产品纯度的检验 称取KNO3产品0.1g(剩余产品回收)放入盛有20ml蒸馏水的小烧杯中,溶解后取得1ml,稀释至100ml,取稀释液1ml放在试管中,加1~2滴0.1mol·L-1AgNO3溶液,观察有无AgCl白色沉淀产生。并与粗产品的纯度作比较。注意事项 1、将NaNO320g,KCl17g,放入烧杯中,加入35ml蒸馏水,使固体刚好全部溶解。
2、待溶液蒸发至原来体积的1/2时,便要停止加热,并趁热用热滤漏斗进行过滤。
3、重结晶法提纯KNO3中,将粗产品放在烧杯中,应加入计算量(2:1)的蒸馏水直至晶体刚好全部溶解为止。 思考1、能否将除去氯化钠后的滤液直接冷却制取硝酸钾? 思考2、实验中为何要乘热过滤除去NaCl晶体?六、实验操作要点热过滤:
趁热过滤,
得KNO3饱和溶液
(回收NaCl晶体)结晶:
KNO3溶液冷却有KNO3晶体析出蒸发:
小火加热
至有较多
晶体析出 溶解:
20g NaNO3
17g KCl
35ml水抽滤:得KNO3晶体,
用少量饱和KNO3溶液淋洗晶体称量:
称量得 ,
粗KNO3质量(1)制备KNO3粗品溶解:
按KNO3∶H2O= 2∶1
加适量水溶解2、KNO3提纯(重结晶)加热:
沸腾
即止冷却:
有针状
KNO3析出抽滤:
得KNO3晶体
用饱和KNO3淋洗烘干:
水浴烘干
(在表面皿中)称重:
精品
KNO3 g 将所得晶体溶于少量溶剂中,然后进行蒸发(或冷却)、结晶、过滤,如此反复的操作称为重结晶。
同课章节目录
- 专题一 物质的分离与提纯
- 课题1 海带中碘元素的分离及检验
- 拓展课题1-1 茶叶中某些元素的鉴定
- 课题2 用纸层析法分离铁离子和铜离子
- 拓展课题1-2 菠菜的叶绿体中色素的提取和分离
- 拓展课题1-3 用粉笔进行层析分离
- 课题3 硝酸钾晶体的制备
- 拓展课题1-4 粗盐提纯
- 专题二 物质性质的研究
- 课题1 铝及其化合物的性质
- 拓展课题2-1 铝热反应
- 课题2 乙醇和苯酚的性质
- 拓展课题2-2 苯酚与甲醛的反应
- 专题三 物质的检验与鉴别
- 课题1 牙膏和火柴中某些成分的检验
- 拓展课题3-1 新装修居室内空气中甲醛浓度的检测
- 拓展课题3-2 汽车尾气成分的检验
- 课题2 亚硝酸钠和食盐的鉴别
- 拓展课题3-3 真假碘盐的鉴别
- 专题四 化学反应条件的控制
- 课题1 硫代硫酸钠与酸反应速率的影响因素
- 拓展课题4-1 “蓝瓶子”实验
- 课题2 催化剂对过氧化氢分解反应速率的影响
- 拓展课题4-2 过氧化氢酶的催化作用
- 拓展课题4-3 蔗糖的燃烧
- 课题3 反应条件对化学平衡的影响
- 拓展课题4-4 淀粉与碘显色现象的探究
- 拓展课题4-5 压强对化学平衡的影响
- 专题五 电化学问题研究
- 课题1 原电池
- 拓展课题5-1 干电池模拟实验
- 课题2 电解与电镀
- 拓展课题5-2 阿伏加德罗常数的测定
- 专题六 物质的定量分析
- 课题1 食醋总酸含量的测定
- 拓展课题6-1 配制并标定氢氧化钠溶液
- 课题2 镀锌铁皮锌镀层厚度的测定
- 拓展课题6-2 水果中维生素C含量的测定
- 专题七 物质的制备与合成
- 课题1 硫酸亚铁铵的制备
- 拓展课题7-1 用制氢废液制备硫酸锌晶体
- 课题2 阿司匹林的合成
- 拓展课题7-2 对氨基苯磺酸的合成
