盐类水解(浙江省温州市)
图片预览









文档简介
课件38张PPT。盐类的水解第一课时什么叫做盐?CH3COONa:NH4Cl:NaCl:(强碱弱酸盐)(强酸弱碱盐)(强酸强碱盐)【课堂实验】 用PH试纸分别测定CH3COONa、NH4Cl
NaCl、AlCl3、 Na 2 CO3溶液的酸碱性。Ⅱ:取1 - 2ml 0.1mol/L的Na2CO3溶液于
试管中, 向试管中滴入酚酞试液,观察
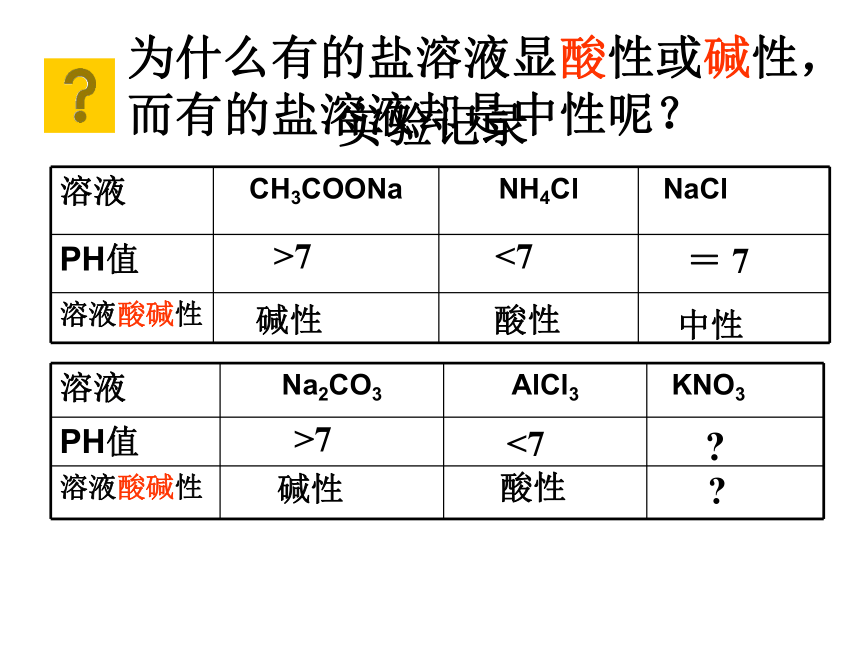
溶液颜色是否变化?实验记录 >7<7 = 7碱性酸性中性为什么有的盐溶液显酸性或碱性,
而有的盐溶液却是中性呢? >7<7 ?碱性酸性 ?(92全国化学)用pH试纸测定某无色溶液pH 值时 ,规范的操作是
(A)将pH试纸放入溶液中观察其颜色变化,跟标准比色卡比较
(B)将溶液倒在pH试纸上,跟标准比色卡比较
(C)用干燥的洁净玻璃棒蘸取溶液,滴在pH试纸上跟标准比色卡比较
(D)在试管内放入少量溶液,煮沸,把pH试纸放在管口,观察颜色,跟标准比色卡比较C盐类的水解【讨论 分析】CH3COONa溶液为什么显碱性?讨论:0.1mol/L的CH3COONa溶液
中CH3COO-浓度是否0.1mol/L? 分析过程CH3COONa = CH3COO_ +Na+
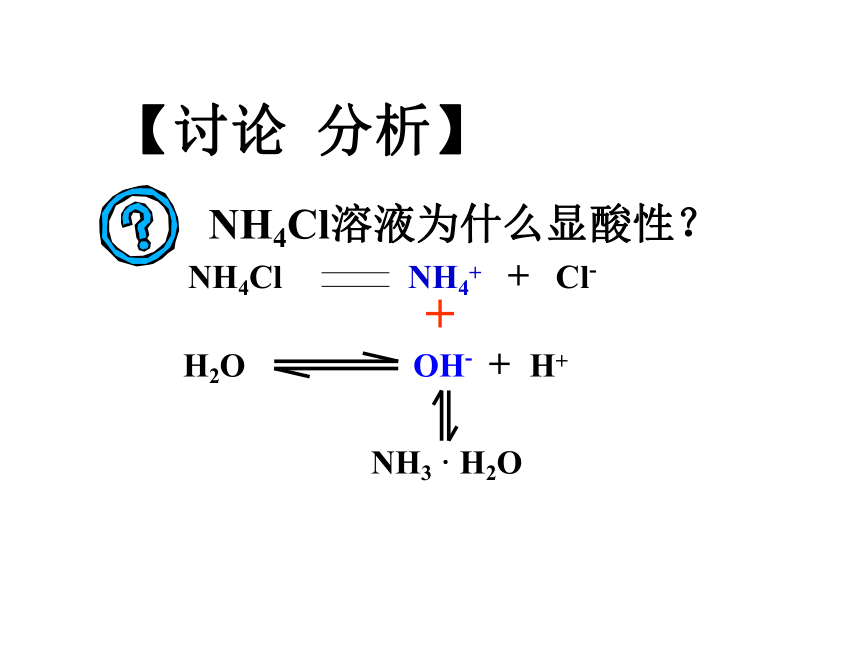
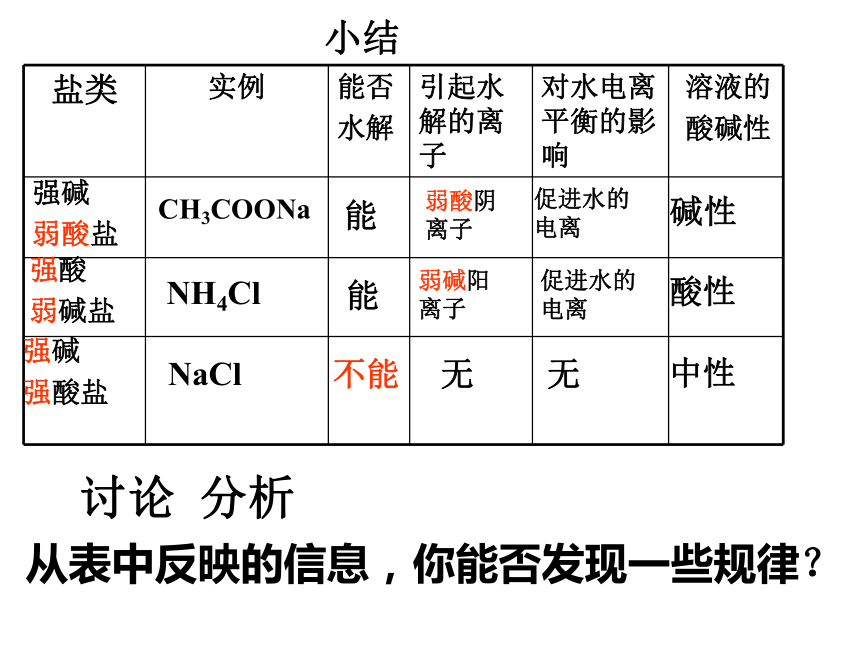
+ CH3COOH 思考:此时溶液中C(OH-)和C(H+)的大小关系C(OH-) C(H+)>溶液显碱性离子方程式:化学方程式:讨论:0.1mol/L的CH3COONa溶液中CH3COO-浓度为多少? 【讨论 分析】NH4Cl溶液为什么显酸性? H2O OH- + H++NH3 · H2O盐类的水解在溶液中盐电离出来的离子跟水所电离出来的H+ 或OH-结合生成弱电解质的反应,叫做盐类的水解。定义:实质: 水的电离平衡向正方向移动分析:NaCl能否水解,NaCl溶液为什么显中性?CH3COONa能弱酸阴
离子 促进水的电离碱性NH4Cl能弱碱阳
离子 促进水的电离酸性NaCl不能无无中性强碱
弱酸盐
强酸
弱碱盐
强碱
强酸盐
小结从表中反映的信息,你能否发现一些规律?讨论 分析判断:请大家利用水解规律推测Na2CO3,
Al2(SO4)3,KNO3溶液的酸碱性。水解规律有弱才水解无弱不水解谁弱谁水解谁强显谁性举例:你认为还有哪些盐溶液显酸性?哪些盐显碱性?PH试纸标准比色卡第二课时盐类的水解试比较同温同浓度的下列溶液的PH大小
(1)Na2CO3 NaHCO3
(2)CH3COONa NaClO归纳1:水解程度的比较:越弱越水解相同温度、相同物质的量浓度的四种溶液:
①CH3COONa、②NaHSO4、③NaCl、④NaClO,pH值由大到小的顺序排列,正确的
(A)④>①>③>② (B)①>④>③>② (C)①>②>③>④ (D)④>③>①>②A物质的量浓度相同的三种盐
NaX、NaY和NaZ的溶液,
其中pH值依次为8、9、10,
则HX、HY、HZ的酸性由
强到弱的顺序是 [ ]
(A)HX、HZ、HY (B)HZ、HY、HX (C)HX、HY、HZ (D)HY、HZ、HXC第三课时盐类的水解盐类水解规律:
1:有弱才水解,无弱不水解;
谁弱谁水解,谁强显谁性。
2:水解程度强弱的判定:
越弱越水解· [练习]将含0.l mol醋酸的溶液加水稀释,
下列说法正确的是
A.溶液中c(H+)和c(OH-)都减小
B.溶液中c(H+)增大
C.醋酸电离平衡向左移动
D.溶液的pH增大
D 1:盐类水解化学,离子方程式的书写:
试着写出NaF NaClO (NH4)2SO4 FeCl2
溶液水解方程式写出Na2CO3 Na2S溶液的水解方程式[归纳]2:多元弱酸的酸根离子的水解是
分步进行的,要分步写。NH4Cl溶液中,离子浓度由大到小的是( )
A.C(NH4+)> C(Cl-) > C(H+) > C(OH-)
B. C(Cl-) > C(NH4+) > C(H+) > C(OH-)
C.C(H+) > C(OH-) > C(NH4+) > C(Cl-)
D. C(Cl-) > C(NH4+) > C(OH-) > C(H+)
课堂练习:B[归纳]3:离子浓度大小比较原则:
不水解离子浓度>水解离子浓度>
水解后显性离子浓度>水解后隐性离子浓度练习:CH3COONa溶液、 Na2CO3溶液中
各离子浓度从大到小排列。
分析:NaHCO3 溶液中存在哪些离子?
NaHCO3溶液呈___性,能说明什么?
对其离子浓度进行由大到小排序。 第四课时盐类的水解 [练习]NH4Cl-NH3·H2O(1:1)混合溶液中各离子浓度大小关系。已知:同浓度的NH3·H2O的电离大于NH4+的水解。分析:由于是混合溶液,所以我们要考虑
离子的水解以及弱电解质的电离提示信息中可以知道:电离强于水解,所以溶液呈碱性。我们在考虑问题中中可以作如下处理:只考虑电离,而忽略离子的水解。C(NH4+)> C(Cl-)> C(OH-)>C(H+)思考:溶液中 C(NH4+)和C(NH3·H2O)的
浓度大小关系?前者大4:物料守恒:即原子个数或质量的守恒NaHCO3溶液中C(Na)=C(C),而C元素的存在
形式有HCO3- 、CO32- 、H2CO3 所以根据
守恒可以得到下列关系式:C(Na+)=C(HCO3-)+C(CO32-)+C(H2CO3)在KH2PO4 溶液中根据K和P元素的含量列出相关等式5:电荷守恒:阴离子带的负电量与
阳离子带的正电量相等离子电量=离子浓度×离子所带电荷数
浓度可以换成物质的量或者个数 练习:表示0.1mol/LNaHCO3溶液中有关微粒的浓度关系式正确的是 ( )
(A)c(Na+)>c(HCO3-)>c(CO32-)>c(H+)>c(OH-)
(B)c(Na+)+c(H+)=c(OH-)+c(CO32-) +c(HCO3-)
(C)c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-)
(D)c(Na+)=c(HCO3-)+c(H2CO3)+c(OH-)
(E)c(Na+)=c(HCO3-)+c(H2CO3)+c(CO32-)CE(2004江苏化学)草酸是二元弱酸,草酸氢钾溶液
呈酸性。在O.1mol·L-1 KHC2O4溶液中,
下列关系正确的是
A.c(K+)+c(H+)=c(HC2O4-)+c(OH-)+c(C2O42-)
B.c(HC2O4-)+c(C2O42-)=0.1 mol·L-1
C.c(C2O42-)>c(H2C2O4)
D.c(K+)=c(H2C2O4)+c(HC2O4-)+c(C2O42-)CD分析:A是想根据电荷守恒列出关系式,B则想根据HC2O4来列物料守恒式子第五课时盐类的水解6:质子守恒:盐类的水解导致溶液的酸碱性,
是促进水的电离的结果。水电离出的H+和
OH-相等,但是部分H+或者OH-被结合成
弱电解质之后,相等关系被破坏。Na2CO3溶液中根据质子守恒可列出C(OH-) = C(H+) +C(HCO3-) + 2C(H2CO3)[练习]:根据质子守恒列出K3PO4溶液中
的相等关系式 在Na2S的水溶液中存在着多种离子和分子,下列关系不正确的是 ( )
(A)c(OH-)=c(H+)+c(HS-)+c(H2S)
(B)c(Na+)+c(H+)=c(OH-)+2c(S2-)+c(HS-)
(C)c(OH-)=c(H+)+c(HS-)+2c(H2S)
(D)c(Na+)=2c(S2-)+2c(HS-)+2c(H2S)A25℃时,将稀氨水逐滴加入到稀硫酸中,
当溶液的pH=7时,下列关系正确的是
A c(NH4+)=c(SO42-)
B c(NH4+)>c(SO42-)
C c(NH4+)<c(SO42-)
D C(OH-)+C(SO42-)=C(H+)+C(NH4+)B二:影响盐类水解的因素1:盐类水解是部分酸碱中和反应的逆反应。
所以水解反应是吸热反应。故温度对水解
有影响。升高温度,水解程度增大。2:离子浓度的变化对水解的影响
[练习]见《导与练》P101页,应用1、2Fe3+ Fe(OH)3 Fe(SCN)3的溶液颜色
黄色 红褐色 血红色第六课时盐类的水解 三、盐类水解在实际生产和生活中的运用。 (1)配制溶液:容易水解的盐溶液配制时要抑制水解以防止浑浊。 问:①为什么配制AlCl3溶液时要加入适量的盐酸?
②配制Al2(SO4)3怎么做,要配制NH4Cl呢?
问:配制FeCl2溶液时要如何操作?加入盐酸 (为什么?),加入铁粉(为什么?) 问:将AlCl3溶液加热蒸发,最终析出的固体是什么?为什么?那么如何使AlCl3析出?如果是蒸发Al2(SO4)3和Na2CO3溶液有什么不同? (3)、用盐溶液来代替酸碱 例如:“焊药”—金属焊接时常用于除去金属表面的氧化膜,常用ZnCl2、NH4Cl。(2)蒸发结晶:若希望通过蒸发结晶来得
到溶质晶体,则要考虑水解因素。问:金属镁与水反应比较困难,若加一些
NH4Cl马上产生大量气体?为什么?写出
相应的方程式。问:制Al(OH)3时没有氨水可用什么
溶液来代替?三:阴阳离子的双水解阳离子水解呈酸性,阴离子水解呈碱性
而H+ 与OH-又会反应,使水解平衡破
坏,促进阴阳离子的水解,甚至趋近
完全.双水解作用的结果,是相互促进,
增大水解程度如Al3+和AlO2-的作用就是双水解 的结果 离子的共存要考虑盐类的双水解,
如Al3+和CO32-(HCO3-), Al3+和S2-,
Fe3+和CO32-(HCO3-), Al3+和AlO2-
在水溶液中都不能大量共存。但不是所有
弱碱阳离子和弱酸阴离子都要双水解
而不能共存, CH3COONH4,(NH4)2CO3。问:能在水溶液中制备Al2S3吗?灭火器原理玻璃筒里面放入的什么是药品?外筒(钢质)放入的是什么药品?泡沫灭火器里的药品是
NaHCO3溶液和Al2(SO4)3溶液。 课后探究该灭火器的灭火原理怎样?灭火器中发生了怎样的反应?
NaCl、AlCl3、 Na 2 CO3溶液的酸碱性。Ⅱ:取1 - 2ml 0.1mol/L的Na2CO3溶液于
试管中, 向试管中滴入酚酞试液,观察
溶液颜色是否变化?实验记录 >7<7 = 7碱性酸性中性为什么有的盐溶液显酸性或碱性,
而有的盐溶液却是中性呢? >7<7 ?碱性酸性 ?(92全国化学)用pH试纸测定某无色溶液pH 值时 ,规范的操作是
(A)将pH试纸放入溶液中观察其颜色变化,跟标准比色卡比较
(B)将溶液倒在pH试纸上,跟标准比色卡比较
(C)用干燥的洁净玻璃棒蘸取溶液,滴在pH试纸上跟标准比色卡比较
(D)在试管内放入少量溶液,煮沸,把pH试纸放在管口,观察颜色,跟标准比色卡比较C盐类的水解【讨论 分析】CH3COONa溶液为什么显碱性?讨论:0.1mol/L的CH3COONa溶液
中CH3COO-浓度是否0.1mol/L? 分析过程CH3COONa = CH3COO_ +Na+
+ CH3COOH 思考:此时溶液中C(OH-)和C(H+)的大小关系C(OH-) C(H+)>溶液显碱性离子方程式:化学方程式:讨论:0.1mol/L的CH3COONa溶液中CH3COO-浓度为多少? 【讨论 分析】NH4Cl溶液为什么显酸性? H2O OH- + H++NH3 · H2O盐类的水解在溶液中盐电离出来的离子跟水所电离出来的H+ 或OH-结合生成弱电解质的反应,叫做盐类的水解。定义:实质: 水的电离平衡向正方向移动分析:NaCl能否水解,NaCl溶液为什么显中性?CH3COONa能弱酸阴
离子 促进水的电离碱性NH4Cl能弱碱阳
离子 促进水的电离酸性NaCl不能无无中性强碱
弱酸盐
强酸
弱碱盐
强碱
强酸盐
小结从表中反映的信息,你能否发现一些规律?讨论 分析判断:请大家利用水解规律推测Na2CO3,
Al2(SO4)3,KNO3溶液的酸碱性。水解规律有弱才水解无弱不水解谁弱谁水解谁强显谁性举例:你认为还有哪些盐溶液显酸性?哪些盐显碱性?PH试纸标准比色卡第二课时盐类的水解试比较同温同浓度的下列溶液的PH大小
(1)Na2CO3 NaHCO3
(2)CH3COONa NaClO归纳1:水解程度的比较:越弱越水解相同温度、相同物质的量浓度的四种溶液:
①CH3COONa、②NaHSO4、③NaCl、④NaClO,pH值由大到小的顺序排列,正确的
(A)④>①>③>② (B)①>④>③>② (C)①>②>③>④ (D)④>③>①>②A物质的量浓度相同的三种盐
NaX、NaY和NaZ的溶液,
其中pH值依次为8、9、10,
则HX、HY、HZ的酸性由
强到弱的顺序是 [ ]
(A)HX、HZ、HY (B)HZ、HY、HX (C)HX、HY、HZ (D)HY、HZ、HXC第三课时盐类的水解盐类水解规律:
1:有弱才水解,无弱不水解;
谁弱谁水解,谁强显谁性。
2:水解程度强弱的判定:
越弱越水解· [练习]将含0.l mol醋酸的溶液加水稀释,
下列说法正确的是
A.溶液中c(H+)和c(OH-)都减小
B.溶液中c(H+)增大
C.醋酸电离平衡向左移动
D.溶液的pH增大
D 1:盐类水解化学,离子方程式的书写:
试着写出NaF NaClO (NH4)2SO4 FeCl2
溶液水解方程式写出Na2CO3 Na2S溶液的水解方程式[归纳]2:多元弱酸的酸根离子的水解是
分步进行的,要分步写。NH4Cl溶液中,离子浓度由大到小的是( )
A.C(NH4+)> C(Cl-) > C(H+) > C(OH-)
B. C(Cl-) > C(NH4+) > C(H+) > C(OH-)
C.C(H+) > C(OH-) > C(NH4+) > C(Cl-)
D. C(Cl-) > C(NH4+) > C(OH-) > C(H+)
课堂练习:B[归纳]3:离子浓度大小比较原则:
不水解离子浓度>水解离子浓度>
水解后显性离子浓度>水解后隐性离子浓度练习:CH3COONa溶液、 Na2CO3溶液中
各离子浓度从大到小排列。
分析:NaHCO3 溶液中存在哪些离子?
NaHCO3溶液呈___性,能说明什么?
对其离子浓度进行由大到小排序。 第四课时盐类的水解 [练习]NH4Cl-NH3·H2O(1:1)混合溶液中各离子浓度大小关系。已知:同浓度的NH3·H2O的电离大于NH4+的水解。分析:由于是混合溶液,所以我们要考虑
离子的水解以及弱电解质的电离提示信息中可以知道:电离强于水解,所以溶液呈碱性。我们在考虑问题中中可以作如下处理:只考虑电离,而忽略离子的水解。C(NH4+)> C(Cl-)> C(OH-)>C(H+)思考:溶液中 C(NH4+)和C(NH3·H2O)的
浓度大小关系?前者大4:物料守恒:即原子个数或质量的守恒NaHCO3溶液中C(Na)=C(C),而C元素的存在
形式有HCO3- 、CO32- 、H2CO3 所以根据
守恒可以得到下列关系式:C(Na+)=C(HCO3-)+C(CO32-)+C(H2CO3)在KH2PO4 溶液中根据K和P元素的含量列出相关等式5:电荷守恒:阴离子带的负电量与
阳离子带的正电量相等离子电量=离子浓度×离子所带电荷数
浓度可以换成物质的量或者个数 练习:表示0.1mol/LNaHCO3溶液中有关微粒的浓度关系式正确的是 ( )
(A)c(Na+)>c(HCO3-)>c(CO32-)>c(H+)>c(OH-)
(B)c(Na+)+c(H+)=c(OH-)+c(CO32-) +c(HCO3-)
(C)c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-)
(D)c(Na+)=c(HCO3-)+c(H2CO3)+c(OH-)
(E)c(Na+)=c(HCO3-)+c(H2CO3)+c(CO32-)CE(2004江苏化学)草酸是二元弱酸,草酸氢钾溶液
呈酸性。在O.1mol·L-1 KHC2O4溶液中,
下列关系正确的是
A.c(K+)+c(H+)=c(HC2O4-)+c(OH-)+c(C2O42-)
B.c(HC2O4-)+c(C2O42-)=0.1 mol·L-1
C.c(C2O42-)>c(H2C2O4)
D.c(K+)=c(H2C2O4)+c(HC2O4-)+c(C2O42-)CD分析:A是想根据电荷守恒列出关系式,B则想根据HC2O4来列物料守恒式子第五课时盐类的水解6:质子守恒:盐类的水解导致溶液的酸碱性,
是促进水的电离的结果。水电离出的H+和
OH-相等,但是部分H+或者OH-被结合成
弱电解质之后,相等关系被破坏。Na2CO3溶液中根据质子守恒可列出C(OH-) = C(H+) +C(HCO3-) + 2C(H2CO3)[练习]:根据质子守恒列出K3PO4溶液中
的相等关系式 在Na2S的水溶液中存在着多种离子和分子,下列关系不正确的是 ( )
(A)c(OH-)=c(H+)+c(HS-)+c(H2S)
(B)c(Na+)+c(H+)=c(OH-)+2c(S2-)+c(HS-)
(C)c(OH-)=c(H+)+c(HS-)+2c(H2S)
(D)c(Na+)=2c(S2-)+2c(HS-)+2c(H2S)A25℃时,将稀氨水逐滴加入到稀硫酸中,
当溶液的pH=7时,下列关系正确的是
A c(NH4+)=c(SO42-)
B c(NH4+)>c(SO42-)
C c(NH4+)<c(SO42-)
D C(OH-)+C(SO42-)=C(H+)+C(NH4+)B二:影响盐类水解的因素1:盐类水解是部分酸碱中和反应的逆反应。
所以水解反应是吸热反应。故温度对水解
有影响。升高温度,水解程度增大。2:离子浓度的变化对水解的影响
[练习]见《导与练》P101页,应用1、2Fe3+ Fe(OH)3 Fe(SCN)3的溶液颜色
黄色 红褐色 血红色第六课时盐类的水解 三、盐类水解在实际生产和生活中的运用。 (1)配制溶液:容易水解的盐溶液配制时要抑制水解以防止浑浊。 问:①为什么配制AlCl3溶液时要加入适量的盐酸?
②配制Al2(SO4)3怎么做,要配制NH4Cl呢?
问:配制FeCl2溶液时要如何操作?加入盐酸 (为什么?),加入铁粉(为什么?) 问:将AlCl3溶液加热蒸发,最终析出的固体是什么?为什么?那么如何使AlCl3析出?如果是蒸发Al2(SO4)3和Na2CO3溶液有什么不同? (3)、用盐溶液来代替酸碱 例如:“焊药”—金属焊接时常用于除去金属表面的氧化膜,常用ZnCl2、NH4Cl。(2)蒸发结晶:若希望通过蒸发结晶来得
到溶质晶体,则要考虑水解因素。问:金属镁与水反应比较困难,若加一些
NH4Cl马上产生大量气体?为什么?写出
相应的方程式。问:制Al(OH)3时没有氨水可用什么
溶液来代替?三:阴阳离子的双水解阳离子水解呈酸性,阴离子水解呈碱性
而H+ 与OH-又会反应,使水解平衡破
坏,促进阴阳离子的水解,甚至趋近
完全.双水解作用的结果,是相互促进,
增大水解程度如Al3+和AlO2-的作用就是双水解 的结果 离子的共存要考虑盐类的双水解,
如Al3+和CO32-(HCO3-), Al3+和S2-,
Fe3+和CO32-(HCO3-), Al3+和AlO2-
在水溶液中都不能大量共存。但不是所有
弱碱阳离子和弱酸阴离子都要双水解
而不能共存, CH3COONH4,(NH4)2CO3。问:能在水溶液中制备Al2S3吗?灭火器原理玻璃筒里面放入的什么是药品?外筒(钢质)放入的是什么药品?泡沫灭火器里的药品是
NaHCO3溶液和Al2(SO4)3溶液。 课后探究该灭火器的灭火原理怎样?灭火器中发生了怎样的反应?
