2008年佛山高考化学科指导意见(广东省佛山市)
文档属性
| 名称 | 2008年佛山高考化学科指导意见(广东省佛山市) |  | |
| 格式 | rar | ||
| 文件大小 | 156.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2008-05-26 19:01:00 | ||
图片预览



文档简介
2008年佛山高考化学科指导意见
一、建议做好以下几件事情
1. 注意对后期各地交流的试题中有新意的试题的研究和拓展,鼓励老师对重要知识点或题型做考试方向性的预测,关注近三年广东、上海的高考试题,特别是广东2007年试题及高考年报,注意近两年考纲,对比考纲异同点,关注和思考变化点。
2. 考前所组的练习或热身卷不宜太难,要尽量针对学生的易错点进行强化,要求学生做到“快而准”。
3. 讲评时注意突出重点和注重规范性,关注学生容易失分的地方,切忌眉毛胡子一把抓。
4. 加强个别辅导,解决一部分学生的个体知识缺陷问题,提高每一位学生的得分能力和减少每一位学生的失分点,特别是最后两周时间,更适于使用个别辅导的形式。
5. 加强应试心理和应试技能教育,对学生以鼓励为主,特别是对尖子生,不要表现出对学生的不放心,要尽量树立学生的自信,减轻学生的心理压力。
6. 建议学生在老师指导下回归课本,重点关注STSE、基础实验等记忆性内容。
二、对2008广东化学高考试题几个题型的预测(仅供参考)
估计今年高考整卷难度0.6左右,选择题难度0.8左右,非选择题难度0.46左右。不同类型的学校应针对难度自行思考本校实际,比较本校和广东省整体水平的高低,制定本校各层次学生的得分方案,特别是尖子的拔尖策略。
1. 选择题有少部分题稍难,只要细心就能得高分,优生力争拿满分。
2. 实验题会有一道“实验探究”题,融方案设计、结果预测、实验评价于一体,成为一道体现新课标的亮点题目,注意总体思路的分析和书面表达。
3. 无机题应关注氧化——还原的离子方程式书写(包括配平),表格或者图像题,计算和平衡(化学平衡、电离平衡、水解平衡、沉淀溶解平衡)结合题。化工生产的试题应关注包括平衡原理的应用,数据处理和化工条件的选择等。
4. 有机题(非选做题)将较简单,关注拼盘式的有机组合,关注以实验为载体考查有机基础知识,要注意结构式书写的准确性和酯化反应等有机化学方程式书写的完整性。
5. 选作题将不会超过课本内容,难度不大,但由于在试卷末尾,很多学生将没时间做完,最后统计得分将仍然不高,最好提醒中档成绩和平常答卷较慢的学生注意答题顺序,以提高分数。
三、要关注的常考点和热点
第一部分(选择题):
常考知识点:
1.阿伏加德罗常数和物质的量的单位
2.离子反应、离子共存
3.离子浓度大小比较、弱电解质、离子积常数、溶解平衡
4.电化学(新型电池、电解原理和金属腐蚀等)
5.平衡常数和图像
6.化学键、氢键
7.热化学反应方程式(含盖斯定律)和能量问题
8.氧化还原
9.STSE热点问题
10.原子结构、分子结构、周期律、周期表
11.有机(官能团及性质)、应用
12.小实验(实验安全、操作、药品保存、物质检验、控制条件的方法)
13.简单计算
要突破的是:
1.速率平衡图象
2.新型电池
3.离子浓度比较
4.盖斯定律
5.社会热点问题
第二部分(非选择题):
实验题:
某些无机气体的制备(包括选择仪器或者绘制仪器)
探究性实验
定性实验和定量实验的结合(比如中和滴定、氧化还原滴定、百分含量测定等,关注近年上海题)
某些课本实验的适当延伸
制备某种无机盐
无机题:
关注次典型的主族元素(如Li、Si、Al、As、Sn、Pb等),继续关注第四、五周期的过渡元素(如Zn、Cd、Fe、Cu等),预测主要与新课标与化工生产相联系命题的可能性较大。
图像类
周期表类
有机题:
其中一题比较简单,注重简单方程式书写、官能团性质、反应类型和有机材料的应用。
四、提供参考的相关试题:
1、定量实验、作图
【题目】为测定碳酸钙样品(含杂质二氧化硅)的纯度,某兴趣小组的同学设计了如下几个实验方案:
方案Ⅰ:①称取碳酸钙样品m g ②用c1 mol·L—1盐酸V1mL(过量)溶解样品 ③取溶解后的溶液体积的十分之一,用c2 mol·L—1NaOH溶液滴定,恰好用去V2mL
方案Ⅱ:①称取碳酸钙样品m g ②高温煅烧直至质量不再改变,冷却后称量,剩余固体质量为m1 g
方案Ⅲ:①称取碳酸钙样品m g ②加入c1 mol·L—1盐酸V1mL(过量)溶解样品 ③过滤并取出滤液 ④在滤液中加入过量c3mol·L—1Na2CO3溶液V3mL ⑤将步骤④中的沉淀滤出、洗涤、干燥、称重为m2 g。
根据以上实验方案,回答下列问题:
(1)方案I中碳酸钙纯度计算公式为 。
(2)方案Ⅱ中高温锻烧样品应在 (填写仪器名称)中进行;为保证实验的准确性,整个实验过程中至少要称量 次。
(3)方案Ⅲ中不需要的数据是 (填选填编号)。
A.c3、V3 B.c1、V1 C.m2 D.m
(4)方案Ⅲ中为减少实验误差,必要的操作是 (填选项编号)。
A.精确测定Na2CO3溶液中体积为V3mL
B.精确配制Na2CO3溶液浓度为c3mol·L—1
C.将步骤③所得沉淀洗涤,洗液并入④中
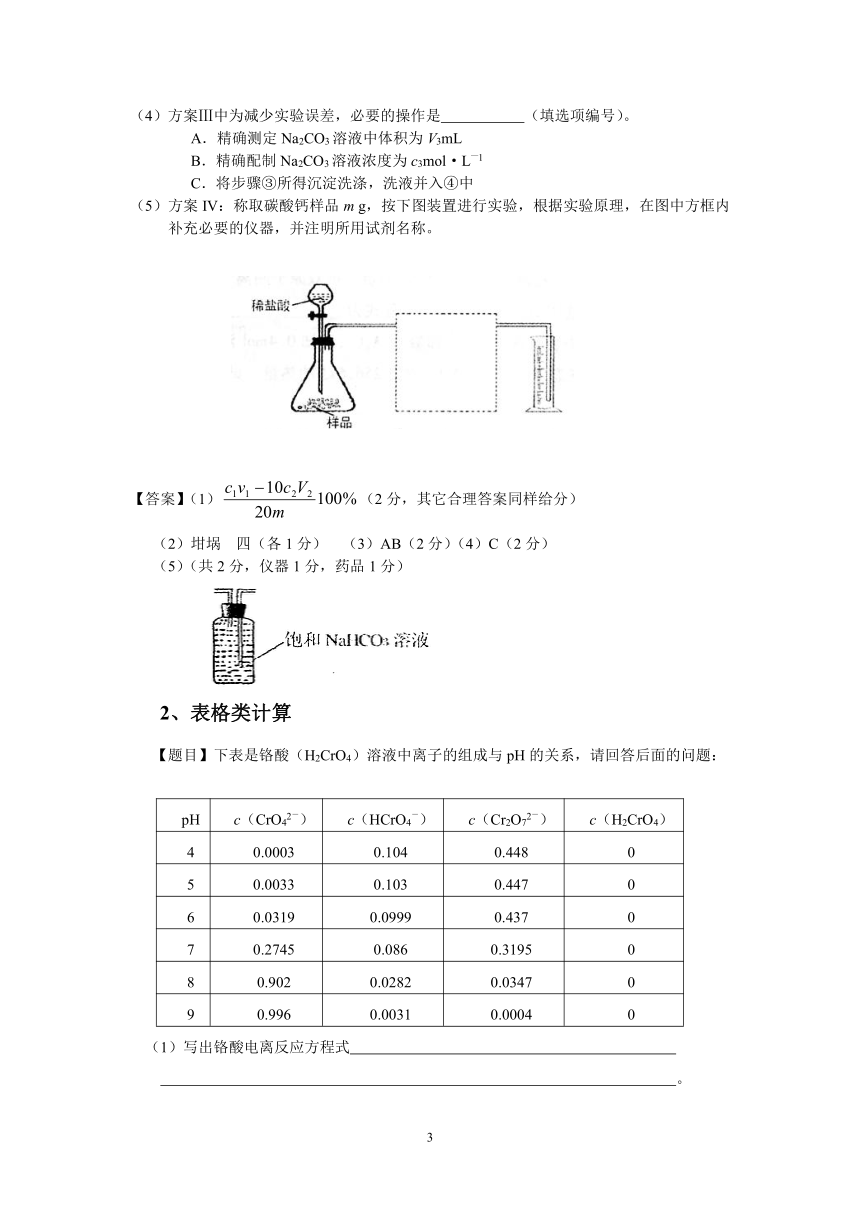
(5)方案IV:称取碳酸钙样品m g,按下图装置进行实验,根据实验原理,在图中方框内补充必要的仪器,并注明所用试剂名称。
【答案】(1)(2分,其它合理答案同样给分)
(2)坩埚 四(各1分) (3)AB(2分)(4)C(2分)
(5)(共2分,仪器1分,药品1分)
2、表格类计算
【题目】下表是铬酸(H2CrO4)溶液中离子的组成与pH的关系,请回答后面的问题:
pH c(CrO42-) c(HCrO4-) c(Cr2O72-) c(H2CrO4)
4 0.0003 0.104 0.448 0
5 0.0033 0.103 0.447 0
6 0.0319 0.0999 0.437 0
7 0.2745 0.086 0.3195 0
8 0.902 0.0282 0.0347 0
9 0.996 0.0031 0.0004 0
(1)写出铬酸电离反应方程式
。
(2)若要得到CrO42-应控制的条件是 。
(3)电离出CrO42-电离平衡常数为K2,电离出Cr2O72-电离平衡常数为K3,则K2 K3(填>、=、<)
(4)铬酸的物质的量浓度为 。(精确到2位小数点)
【答案】(1)H2CrO4=H++HCrO4- HCrO4- H++CrO42-
2HCrO4- H2O+Cr2O72-(3分) (2)pH>9(2分)(3)<(2分)(4)1.00mol/L(2分)
3、物质制备和探究实验
【题目】用粗锌(含少量Fe等杂质)与稀硫酸反应制氢气,其废液中含有大量的硫酸锌。同学们用制氢气的废液来制取皓矾(ZnSO4·7H2O),并探究其性质。
(l)制备皓矾 实验流程如下图所示:
氢氧化物 Fe(OH)3 Fe(OH)2 Zn(OH)2
开始沉淀pH 2.7 7.6 5.7
完全沉淀pH 3.7 9.6 8.0
已知:氢氧化物沉淀的pH范围见右表。
请回答下列问题:
① 加入的试剂a,供选择使用的有:氨水、NaClO溶液、20%的H2O2、浓硫酸、浓硝酸等,应选用 ,其理由是 。
② 加入的试剂b,供选择使用的有: Zn粉、ZnO、Zn(OH)2、ZnCO3、ZnSO4等,应选用 ,其理由是
。
③从晶体l→晶体2,该过程的名称是 。
④在得到皓矾时,向晶体中加入少量酒精洗涤而不用水的原因是
。
(2)探究皓矾的性质
温度(℃) 60 240 930 1000
残留固体质量(g) 19.7 16.1 8.1 8.1
⑤称取28.7g ZnSO4·7H2O研细后置于坩埚中小心加热,其固体质量与温度的对应数据见右表。则1000℃时皓矾的化学反应方程式为 。
⑥取少量ZnSO4·7H2O配成溶液向其中逐滴加入NaOH溶液,发现先产生白色沉淀后又逐渐溶解;若改用氨水得到相同的现象。查资料知,氢氧化锌与氢氧化铝均有两性,且锌离子可与NaOH溶液反应得到ZnO22-,锌离子可与氨水形成络合离子[Zn(NH3)4]2+。则Zn (OH)2沉淀中加入NaOH溶液和加氨水均得到无色溶液的离子反应方程式分别为 、
。
【答案】(1)(10分)
①(2分)20%的H2O2(1分) 将废液中的Fe2+氧化为Fe3+,同时避免引入新的杂质(1分)
②(3分)ZnO [或Zn(OH)2或ZnCO3](1分) 调节溶液的pH至3.7~5.7(1分),使Fe3+全部转化为Fe(OH)3沉淀,同时避免Zn2+损失和引入其它杂质(1分)[若只答调节pH不给分]
③(1分)重结晶 ④(2分)为了冲洗掉晶体表面的杂质离子(1分),同时防止晶体溶解影响产率(1分)
(2)(6分)⑤(2分)ZnSO4·7H2O====== ZnO+SO3↑+7H2O↑
⑥ (4分)Zn (OH)2+2OH-=ZnO22- +2H2O Zn (OH)2+4NH3·H2O= [Zn(NH3)4]2++2H2O+2OH-
4、工业综合题、盖斯定律、溶度积
【题目】水煤气 (主要成分:CO、H2 ) 是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得。己知:
C (s) + H2O(g) CO (g) +H2 (g);△H =+131.3kJ mol-1
C (s) + O2(g)=CO (g);△H = -110.5kJ·mo1-1
CO(g) + O2(g) =CO2 (g);△H =-283.0 kJ·mo1-1
H2 (g) + O2 (g) =H2O (g);△H = -241.8kJ·mo1-1
H2 (g) + O2 (g) =H2O (l);△H = -285.8kJ·mo1-1
(1) 将2.4 g 炭转化为水煤气,再完全燃烧,整个过程的△H = kJ·mo1-1。
⑵ 最近有科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使之变为可再生燃料甲醇。“绿色自由”构想技术流程如下:
①分解池中反应的化学方程式为 。
②在合成塔中,若有4.4kg CO2与足量H2恰好完全反应,可放出4947kJ的热量,试写出合成塔中发生反应的热化学方程式 。
⑶ 小亮同学拟用沉淀法测定空气中CO2的体积分数,他查得CaCO3、BaCO3的溶度积(Ksp)分别为4.96×10-9、2.58×10-9。
小亮应该选用的试剂是 ,实验时测定的数据除空气的体积外,还需要测定 。
【答案】(10分)(1) —78.7 ⑵①2KHCO3K2CO3+CO2↑+H2O
②CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.47kJ/mol
⑶Ba(OH)2(或NaOH溶液和BaCl2溶液) 实验时的温度、压强,沉淀的质量
(每空2分,共10分)
5、图像分析题
【题目】污水处理分析时,常用双硫腙(H2Dz,二元弱酸)把金属离子络合成电中性的物质,再用CCl4萃取络合物,把金属离子从水溶液中完全分离出来。如用双硫腙(H2Dz)~CCl4分离污水中的Cu2+时,先发生络合反应:Cu2++2 H2DzCu(HDz)2+2H+,再加入CCl4,Cu(HDz)2就很容易被萃取到CCl4中。
(1)写出双硫腙和Fe3+络合的离子方程式 。萃取过程中要控制适宜的酸度。如果溶液的pH过大,其后果是 。
下图是用双硫腙(H2Dz)~CCl4络合萃取某些金属离子的酸度曲线。它反映了萃取某些金属离子时适宜的pH范围。E%表示某种金属离子以络合物形式被萃取分离的百分率。
某工业废水中含有Hg2+、Bi3+、Zn2+,用双硫腙(H2Dz)~CCl4络合萃取法处理废水。
请根据上图回答问题:
(2)欲完全将废水中的Hg2+分离出来,须控制溶液pH=
(3)当调节pH=2时,铋(Bi)的存在形式有: ,其物质的量之比为
______ 。
(4)萃取到CCl4中的Zn(HDz)2分液后,加入足量的NaOH溶液,充分振荡后,锌又转到水溶液中。写出反应的离子方程式 。
【答案】(1)Fe3++3H2DzFe(HDz)3+3H+ (2分) 。Fe3+ 会形成Fe(OH)3 沉淀 (2分)
(2)1 (1分)
(3)Bi3+ Bi(HDz)3 (2分) ; 3:2 (1分)
(4)Zn(HDz)2 + 6OH- = Zn(OH)4- + 2Dz2- + 2H2O (2分)
6、作图题、平衡
【题目】373K时,某1L密闭容器中发生如下可逆反应:A(g)2B(g)。其中物质B的物质的量变化如图所示。试填空:
⑴ 已知373K时60s达到平衡,则前60s内A的平均反应速率为 。
⑵ 若373K时B的平衡浓度为是A的3倍,473K时(其他条件不变),B的平衡浓度为A的2倍,请在上图中画出473K时A的物质的量随时间的变化曲线。
⑶ 若反应在373K进行,在1L密闭容器中加入1mol B、0.2molHe,达到平衡时B的转化率应 。
A.等于60% B.等于40% C.小于40% D.介于40%~60%之间
⑷ 已知曲线上任意两点之间连线的斜率表示该时段内B的平均反应速率(例如直线EF的斜率表示20s~60s内B的平均反应速率),试猜想曲线上任意一点的切线斜率的意义 。
答案:⑴ 0.005mol·L-1·s-1
⑵ 曲线注意2点:A的起始及平衡时的物质的量;达到平衡所需时间应小于60s:
⑶ B
⑷ 某一时刻的反应速率(或即时速率、瞬时速率)(每空2分)
7、选做题
【题目】对羟基苯甲醛是一种合成医药、香料、液晶材料的重要中间体,以对甲基苯酚
为主要原料 合成对羟基苯甲醛 的工艺流程如图所示。
(已知对羟基苯甲醛的熔点≥115.5℃,在水中的溶解度为1.38g)
⑴ 写出反应Ⅱ化学方程式_________________________________________________ ,
在生产中不直接用氧气氧化对甲基苯酚的原因是___________________________ 。
⑵ 写出对羟基苯甲醛在一定条件下与足量氢气反应的化学方程式__________________。
⑶ 用核磁共振氢谱对产品进行纯度分析,发现核磁共振氢谱上有四个吸收峰,由此可判断产品______ _(填纯净或混有杂质)
⑷ 对羟基苯甲醛有多种同分异构体,其中苯环上只有一个侧链的同分异构体的结构简式为_____________________________________________ _。
⑸在工艺流程中“操作Ⅰ”的方法是____________ ,“操作Ⅱ”的方法是____________
“真空干燥”的主要目的是_______________________ _。
【答案】(1)(2分)防止酚羟基氧化(1分)
(2)(2分)
(3)纯净物(2分)
(4)(1分)(1分)
(5)蒸馏(1分)、过滤(1分)防止对羟基苯甲醛的氧化、有利水蒸气的除去(1分,答出一点即可)。
1000℃
甲醇
高温水蒸气
N2、O2
H2
溶液
空气
盛有饱和K2CO3
溶液的吸收池
分解池
合成塔
(2×105Pa、300℃、
铬锌触媒)
t(s)
n(mol)
0
60
0.5
0.4
0.3
0.2
0.1
0.6
20
40
0.8
F
E
时间(s)
物质的量(mol)
0
60
0.5
0.4
0.3
0.2
0.1
0.6
20
40
0.8
F
E
PAGE
7
一、建议做好以下几件事情
1. 注意对后期各地交流的试题中有新意的试题的研究和拓展,鼓励老师对重要知识点或题型做考试方向性的预测,关注近三年广东、上海的高考试题,特别是广东2007年试题及高考年报,注意近两年考纲,对比考纲异同点,关注和思考变化点。
2. 考前所组的练习或热身卷不宜太难,要尽量针对学生的易错点进行强化,要求学生做到“快而准”。
3. 讲评时注意突出重点和注重规范性,关注学生容易失分的地方,切忌眉毛胡子一把抓。
4. 加强个别辅导,解决一部分学生的个体知识缺陷问题,提高每一位学生的得分能力和减少每一位学生的失分点,特别是最后两周时间,更适于使用个别辅导的形式。
5. 加强应试心理和应试技能教育,对学生以鼓励为主,特别是对尖子生,不要表现出对学生的不放心,要尽量树立学生的自信,减轻学生的心理压力。
6. 建议学生在老师指导下回归课本,重点关注STSE、基础实验等记忆性内容。
二、对2008广东化学高考试题几个题型的预测(仅供参考)
估计今年高考整卷难度0.6左右,选择题难度0.8左右,非选择题难度0.46左右。不同类型的学校应针对难度自行思考本校实际,比较本校和广东省整体水平的高低,制定本校各层次学生的得分方案,特别是尖子的拔尖策略。
1. 选择题有少部分题稍难,只要细心就能得高分,优生力争拿满分。
2. 实验题会有一道“实验探究”题,融方案设计、结果预测、实验评价于一体,成为一道体现新课标的亮点题目,注意总体思路的分析和书面表达。
3. 无机题应关注氧化——还原的离子方程式书写(包括配平),表格或者图像题,计算和平衡(化学平衡、电离平衡、水解平衡、沉淀溶解平衡)结合题。化工生产的试题应关注包括平衡原理的应用,数据处理和化工条件的选择等。
4. 有机题(非选做题)将较简单,关注拼盘式的有机组合,关注以实验为载体考查有机基础知识,要注意结构式书写的准确性和酯化反应等有机化学方程式书写的完整性。
5. 选作题将不会超过课本内容,难度不大,但由于在试卷末尾,很多学生将没时间做完,最后统计得分将仍然不高,最好提醒中档成绩和平常答卷较慢的学生注意答题顺序,以提高分数。
三、要关注的常考点和热点
第一部分(选择题):
常考知识点:
1.阿伏加德罗常数和物质的量的单位
2.离子反应、离子共存
3.离子浓度大小比较、弱电解质、离子积常数、溶解平衡
4.电化学(新型电池、电解原理和金属腐蚀等)
5.平衡常数和图像
6.化学键、氢键
7.热化学反应方程式(含盖斯定律)和能量问题
8.氧化还原
9.STSE热点问题
10.原子结构、分子结构、周期律、周期表
11.有机(官能团及性质)、应用
12.小实验(实验安全、操作、药品保存、物质检验、控制条件的方法)
13.简单计算
要突破的是:
1.速率平衡图象
2.新型电池
3.离子浓度比较
4.盖斯定律
5.社会热点问题
第二部分(非选择题):
实验题:
某些无机气体的制备(包括选择仪器或者绘制仪器)
探究性实验
定性实验和定量实验的结合(比如中和滴定、氧化还原滴定、百分含量测定等,关注近年上海题)
某些课本实验的适当延伸
制备某种无机盐
无机题:
关注次典型的主族元素(如Li、Si、Al、As、Sn、Pb等),继续关注第四、五周期的过渡元素(如Zn、Cd、Fe、Cu等),预测主要与新课标与化工生产相联系命题的可能性较大。
图像类
周期表类
有机题:
其中一题比较简单,注重简单方程式书写、官能团性质、反应类型和有机材料的应用。
四、提供参考的相关试题:
1、定量实验、作图
【题目】为测定碳酸钙样品(含杂质二氧化硅)的纯度,某兴趣小组的同学设计了如下几个实验方案:
方案Ⅰ:①称取碳酸钙样品m g ②用c1 mol·L—1盐酸V1mL(过量)溶解样品 ③取溶解后的溶液体积的十分之一,用c2 mol·L—1NaOH溶液滴定,恰好用去V2mL
方案Ⅱ:①称取碳酸钙样品m g ②高温煅烧直至质量不再改变,冷却后称量,剩余固体质量为m1 g
方案Ⅲ:①称取碳酸钙样品m g ②加入c1 mol·L—1盐酸V1mL(过量)溶解样品 ③过滤并取出滤液 ④在滤液中加入过量c3mol·L—1Na2CO3溶液V3mL ⑤将步骤④中的沉淀滤出、洗涤、干燥、称重为m2 g。
根据以上实验方案,回答下列问题:
(1)方案I中碳酸钙纯度计算公式为 。
(2)方案Ⅱ中高温锻烧样品应在 (填写仪器名称)中进行;为保证实验的准确性,整个实验过程中至少要称量 次。
(3)方案Ⅲ中不需要的数据是 (填选填编号)。
A.c3、V3 B.c1、V1 C.m2 D.m
(4)方案Ⅲ中为减少实验误差,必要的操作是 (填选项编号)。
A.精确测定Na2CO3溶液中体积为V3mL
B.精确配制Na2CO3溶液浓度为c3mol·L—1
C.将步骤③所得沉淀洗涤,洗液并入④中
(5)方案IV:称取碳酸钙样品m g,按下图装置进行实验,根据实验原理,在图中方框内补充必要的仪器,并注明所用试剂名称。
【答案】(1)(2分,其它合理答案同样给分)
(2)坩埚 四(各1分) (3)AB(2分)(4)C(2分)
(5)(共2分,仪器1分,药品1分)
2、表格类计算
【题目】下表是铬酸(H2CrO4)溶液中离子的组成与pH的关系,请回答后面的问题:
pH c(CrO42-) c(HCrO4-) c(Cr2O72-) c(H2CrO4)
4 0.0003 0.104 0.448 0
5 0.0033 0.103 0.447 0
6 0.0319 0.0999 0.437 0
7 0.2745 0.086 0.3195 0
8 0.902 0.0282 0.0347 0
9 0.996 0.0031 0.0004 0
(1)写出铬酸电离反应方程式
。
(2)若要得到CrO42-应控制的条件是 。
(3)电离出CrO42-电离平衡常数为K2,电离出Cr2O72-电离平衡常数为K3,则K2 K3(填>、=、<)
(4)铬酸的物质的量浓度为 。(精确到2位小数点)
【答案】(1)H2CrO4=H++HCrO4- HCrO4- H++CrO42-
2HCrO4- H2O+Cr2O72-(3分) (2)pH>9(2分)(3)<(2分)(4)1.00mol/L(2分)
3、物质制备和探究实验
【题目】用粗锌(含少量Fe等杂质)与稀硫酸反应制氢气,其废液中含有大量的硫酸锌。同学们用制氢气的废液来制取皓矾(ZnSO4·7H2O),并探究其性质。
(l)制备皓矾 实验流程如下图所示:
氢氧化物 Fe(OH)3 Fe(OH)2 Zn(OH)2
开始沉淀pH 2.7 7.6 5.7
完全沉淀pH 3.7 9.6 8.0
已知:氢氧化物沉淀的pH范围见右表。
请回答下列问题:
① 加入的试剂a,供选择使用的有:氨水、NaClO溶液、20%的H2O2、浓硫酸、浓硝酸等,应选用 ,其理由是 。
② 加入的试剂b,供选择使用的有: Zn粉、ZnO、Zn(OH)2、ZnCO3、ZnSO4等,应选用 ,其理由是
。
③从晶体l→晶体2,该过程的名称是 。
④在得到皓矾时,向晶体中加入少量酒精洗涤而不用水的原因是
。
(2)探究皓矾的性质
温度(℃) 60 240 930 1000
残留固体质量(g) 19.7 16.1 8.1 8.1
⑤称取28.7g ZnSO4·7H2O研细后置于坩埚中小心加热,其固体质量与温度的对应数据见右表。则1000℃时皓矾的化学反应方程式为 。
⑥取少量ZnSO4·7H2O配成溶液向其中逐滴加入NaOH溶液,发现先产生白色沉淀后又逐渐溶解;若改用氨水得到相同的现象。查资料知,氢氧化锌与氢氧化铝均有两性,且锌离子可与NaOH溶液反应得到ZnO22-,锌离子可与氨水形成络合离子[Zn(NH3)4]2+。则Zn (OH)2沉淀中加入NaOH溶液和加氨水均得到无色溶液的离子反应方程式分别为 、
。
【答案】(1)(10分)
①(2分)20%的H2O2(1分) 将废液中的Fe2+氧化为Fe3+,同时避免引入新的杂质(1分)
②(3分)ZnO [或Zn(OH)2或ZnCO3](1分) 调节溶液的pH至3.7~5.7(1分),使Fe3+全部转化为Fe(OH)3沉淀,同时避免Zn2+损失和引入其它杂质(1分)[若只答调节pH不给分]
③(1分)重结晶 ④(2分)为了冲洗掉晶体表面的杂质离子(1分),同时防止晶体溶解影响产率(1分)
(2)(6分)⑤(2分)ZnSO4·7H2O====== ZnO+SO3↑+7H2O↑
⑥ (4分)Zn (OH)2+2OH-=ZnO22- +2H2O Zn (OH)2+4NH3·H2O= [Zn(NH3)4]2++2H2O+2OH-
4、工业综合题、盖斯定律、溶度积
【题目】水煤气 (主要成分:CO、H2 ) 是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得。己知:
C (s) + H2O(g) CO (g) +H2 (g);△H =+131.3kJ mol-1
C (s) + O2(g)=CO (g);△H = -110.5kJ·mo1-1
CO(g) + O2(g) =CO2 (g);△H =-283.0 kJ·mo1-1
H2 (g) + O2 (g) =H2O (g);△H = -241.8kJ·mo1-1
H2 (g) + O2 (g) =H2O (l);△H = -285.8kJ·mo1-1
(1) 将2.4 g 炭转化为水煤气,再完全燃烧,整个过程的△H = kJ·mo1-1。
⑵ 最近有科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使之变为可再生燃料甲醇。“绿色自由”构想技术流程如下:
①分解池中反应的化学方程式为 。
②在合成塔中,若有4.4kg CO2与足量H2恰好完全反应,可放出4947kJ的热量,试写出合成塔中发生反应的热化学方程式 。
⑶ 小亮同学拟用沉淀法测定空气中CO2的体积分数,他查得CaCO3、BaCO3的溶度积(Ksp)分别为4.96×10-9、2.58×10-9。
小亮应该选用的试剂是 ,实验时测定的数据除空气的体积外,还需要测定 。
【答案】(10分)(1) —78.7 ⑵①2KHCO3K2CO3+CO2↑+H2O
②CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.47kJ/mol
⑶Ba(OH)2(或NaOH溶液和BaCl2溶液) 实验时的温度、压强,沉淀的质量
(每空2分,共10分)
5、图像分析题
【题目】污水处理分析时,常用双硫腙(H2Dz,二元弱酸)把金属离子络合成电中性的物质,再用CCl4萃取络合物,把金属离子从水溶液中完全分离出来。如用双硫腙(H2Dz)~CCl4分离污水中的Cu2+时,先发生络合反应:Cu2++2 H2DzCu(HDz)2+2H+,再加入CCl4,Cu(HDz)2就很容易被萃取到CCl4中。
(1)写出双硫腙和Fe3+络合的离子方程式 。萃取过程中要控制适宜的酸度。如果溶液的pH过大,其后果是 。
下图是用双硫腙(H2Dz)~CCl4络合萃取某些金属离子的酸度曲线。它反映了萃取某些金属离子时适宜的pH范围。E%表示某种金属离子以络合物形式被萃取分离的百分率。
某工业废水中含有Hg2+、Bi3+、Zn2+,用双硫腙(H2Dz)~CCl4络合萃取法处理废水。
请根据上图回答问题:
(2)欲完全将废水中的Hg2+分离出来,须控制溶液pH=
(3)当调节pH=2时,铋(Bi)的存在形式有: ,其物质的量之比为
______ 。
(4)萃取到CCl4中的Zn(HDz)2分液后,加入足量的NaOH溶液,充分振荡后,锌又转到水溶液中。写出反应的离子方程式 。
【答案】(1)Fe3++3H2DzFe(HDz)3+3H+ (2分) 。Fe3+ 会形成Fe(OH)3 沉淀 (2分)
(2)1 (1分)
(3)Bi3+ Bi(HDz)3 (2分) ; 3:2 (1分)
(4)Zn(HDz)2 + 6OH- = Zn(OH)4- + 2Dz2- + 2H2O (2分)
6、作图题、平衡
【题目】373K时,某1L密闭容器中发生如下可逆反应:A(g)2B(g)。其中物质B的物质的量变化如图所示。试填空:
⑴ 已知373K时60s达到平衡,则前60s内A的平均反应速率为 。
⑵ 若373K时B的平衡浓度为是A的3倍,473K时(其他条件不变),B的平衡浓度为A的2倍,请在上图中画出473K时A的物质的量随时间的变化曲线。
⑶ 若反应在373K进行,在1L密闭容器中加入1mol B、0.2molHe,达到平衡时B的转化率应 。
A.等于60% B.等于40% C.小于40% D.介于40%~60%之间
⑷ 已知曲线上任意两点之间连线的斜率表示该时段内B的平均反应速率(例如直线EF的斜率表示20s~60s内B的平均反应速率),试猜想曲线上任意一点的切线斜率的意义 。
答案:⑴ 0.005mol·L-1·s-1
⑵ 曲线注意2点:A的起始及平衡时的物质的量;达到平衡所需时间应小于60s:
⑶ B
⑷ 某一时刻的反应速率(或即时速率、瞬时速率)(每空2分)
7、选做题
【题目】对羟基苯甲醛是一种合成医药、香料、液晶材料的重要中间体,以对甲基苯酚
为主要原料 合成对羟基苯甲醛 的工艺流程如图所示。
(已知对羟基苯甲醛的熔点≥115.5℃,在水中的溶解度为1.38g)
⑴ 写出反应Ⅱ化学方程式_________________________________________________ ,
在生产中不直接用氧气氧化对甲基苯酚的原因是___________________________ 。
⑵ 写出对羟基苯甲醛在一定条件下与足量氢气反应的化学方程式__________________。
⑶ 用核磁共振氢谱对产品进行纯度分析,发现核磁共振氢谱上有四个吸收峰,由此可判断产品______ _(填纯净或混有杂质)
⑷ 对羟基苯甲醛有多种同分异构体,其中苯环上只有一个侧链的同分异构体的结构简式为_____________________________________________ _。
⑸在工艺流程中“操作Ⅰ”的方法是____________ ,“操作Ⅱ”的方法是____________
“真空干燥”的主要目的是_______________________ _。
【答案】(1)(2分)防止酚羟基氧化(1分)
(2)(2分)
(3)纯净物(2分)
(4)(1分)(1分)
(5)蒸馏(1分)、过滤(1分)防止对羟基苯甲醛的氧化、有利水蒸气的除去(1分,答出一点即可)。
1000℃
甲醇
高温水蒸气
N2、O2
H2
溶液
空气
盛有饱和K2CO3
溶液的吸收池
分解池
合成塔
(2×105Pa、300℃、
铬锌触媒)
t(s)
n(mol)
0
60
0.5
0.4
0.3
0.2
0.1
0.6
20
40
0.8
F
E
时间(s)
物质的量(mol)
0
60
0.5
0.4
0.3
0.2
0.1
0.6
20
40
0.8
F
E
PAGE
7
同课章节目录
