第一章 物质结构 元素周期律 第一节 元素周期表
文档属性
| 名称 | 第一章 物质结构 元素周期律 第一节 元素周期表 |

|
|
| 格式 | rar | ||
| 文件大小 | 621.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2008-05-26 00:00:00 | ||
图片预览




文档简介
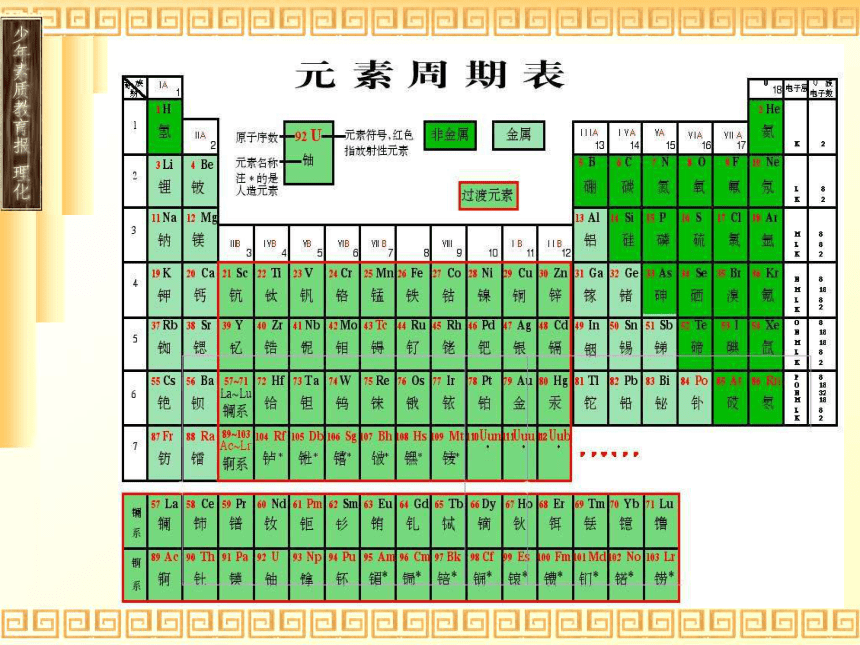
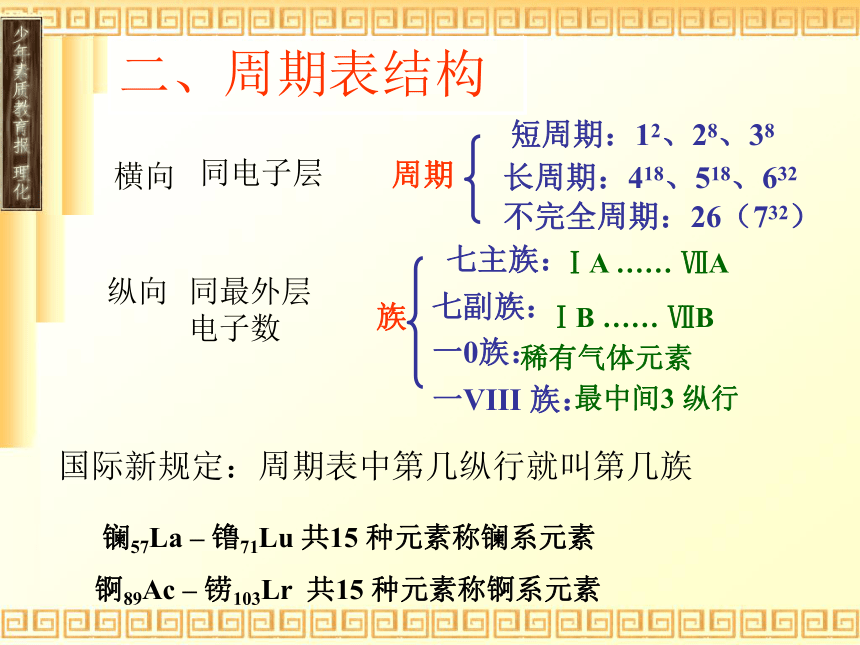
课件13张PPT。第一章 物质结构 元素周期律第一节 元素周期表批改随着原子序数的递增,原子半径有什么变化?答 原子半径由大逐渐变小 由此可得:氢原子的半径最大,112号元素的原子半径最小吗,结论显然是错误的。错在没有“电子层数相同”这个前提和“稀有气体元素原子除外”这个特例。答:随着原子序数的递增,原子半径出现由大逐渐变小的周期性变化(稀有气体例外)。元素周期表一、编排原则:⑴ 按原子序数的递增顺序从左到右排列⑵ 将电子层数相同的元素排列成一个横行⑶ 最外层电子数相同的元素必位于一纵行。二、周期表结构横向纵向同电子层同最外层电子数周期短周期:12、28、38长周期:418、518、632不完全周期:26(732)七主族:七副族:ⅠA …… ⅦA 一VIII 族:稀有气体元素一0族:ⅠB …… ⅦB 最中间3 纵行 族国际新规定:周期表中第几纵行就叫第几族镧57La – 镥71Lu 共15 种元素称镧系元素锕89Ac – 铹103Lr 共15 种元素称锕系元素解释氦元素原子最外层有两个电子,为什么不把它排在ⅡA族?IA族就是碱金属元素吗?氦元素虽然结构与ⅡA相似,但K层填充两个电子已达饱和,性质与ⅡA族的元素完全不同,与0族元素相似。不对,它包括氢元素和碱金属。说明:氢元素也可放在卤素中,与卤素得到1e即达稳定结构相似,但氢更多地体现失1e的性质,与碱金属相似,故放在ⅠA三、元素性质递变规律
同周期(左→右)项 目核电荷数同主族(上→下)电子层数原子半径化 合 价 相 同 逐渐减小 最高正价:+1 →+7 逐渐增大 负化合价:- 4 → -1 增 大 逐渐增大 逐渐增大 最高正价=族序数 负化合价= -(8-族序数)小结七A七B一O一Ⅷ,罗马序
三短三长一不完全,阿拉伯
元素名称是形声字,单质态
元素符号为拉丁文,大小写
前三周期必须牢记,常考查
稀有气体常做参照,定位置练习 推算原子序数为6,13,34,81的元素在周期表中的位置。 第6号元素: 6 -10=-4 第二周期第ⅣA 族。 第13号元素: 13-10=3 第三周期第ⅢA 族。 第34号元素: 34 -36 =-2 第四周期第ⅥA 族。 第81号元素: 81 -86 =-5 第六周期第Ⅲ A 族。练习2 A、B、C是周期表中相邻的三种元素,其中A、B是相邻同周期元素,B、C是同主族元素。此三种元素原子最外层电子数之和为17,质子数之和为31,则A、B、C分别为什么元素? 三种元素原子最外层电子平均数为 17÷3 = 5.7≈6 三种元素位于第ⅤA、ⅥA族。 三种元素质子数之和为31,平均质子数约为10,应为二个2周期元素和一个3周期元素可得:A是氮元素 B是氧元素 C是硫元素5 + 2×6 = 17返回周期返回族再见
同周期(左→右)项 目核电荷数同主族(上→下)电子层数原子半径化 合 价 相 同 逐渐减小 最高正价:+1 →+7 逐渐增大 负化合价:- 4 → -1 增 大 逐渐增大 逐渐增大 最高正价=族序数 负化合价= -(8-族序数)小结七A七B一O一Ⅷ,罗马序
三短三长一不完全,阿拉伯
元素名称是形声字,单质态
元素符号为拉丁文,大小写
前三周期必须牢记,常考查
稀有气体常做参照,定位置练习 推算原子序数为6,13,34,81的元素在周期表中的位置。 第6号元素: 6 -10=-4 第二周期第ⅣA 族。 第13号元素: 13-10=3 第三周期第ⅢA 族。 第34号元素: 34 -36 =-2 第四周期第ⅥA 族。 第81号元素: 81 -86 =-5 第六周期第Ⅲ A 族。练习2 A、B、C是周期表中相邻的三种元素,其中A、B是相邻同周期元素,B、C是同主族元素。此三种元素原子最外层电子数之和为17,质子数之和为31,则A、B、C分别为什么元素? 三种元素原子最外层电子平均数为 17÷3 = 5.7≈6 三种元素位于第ⅤA、ⅥA族。 三种元素质子数之和为31,平均质子数约为10,应为二个2周期元素和一个3周期元素可得:A是氮元素 B是氧元素 C是硫元素5 + 2×6 = 17返回周期返回族再见
