新课标人教版》必修2》第二章 化学反应与能量》第二节 化学能与电能(广东省广州市东山区)
文档属性
| 名称 | 新课标人教版》必修2》第二章 化学反应与能量》第二节 化学能与电能(广东省广州市东山区) |  | |
| 格式 | rar | ||
| 文件大小 | 4.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2008-05-29 09:18:00 | ||
图片预览









文档简介
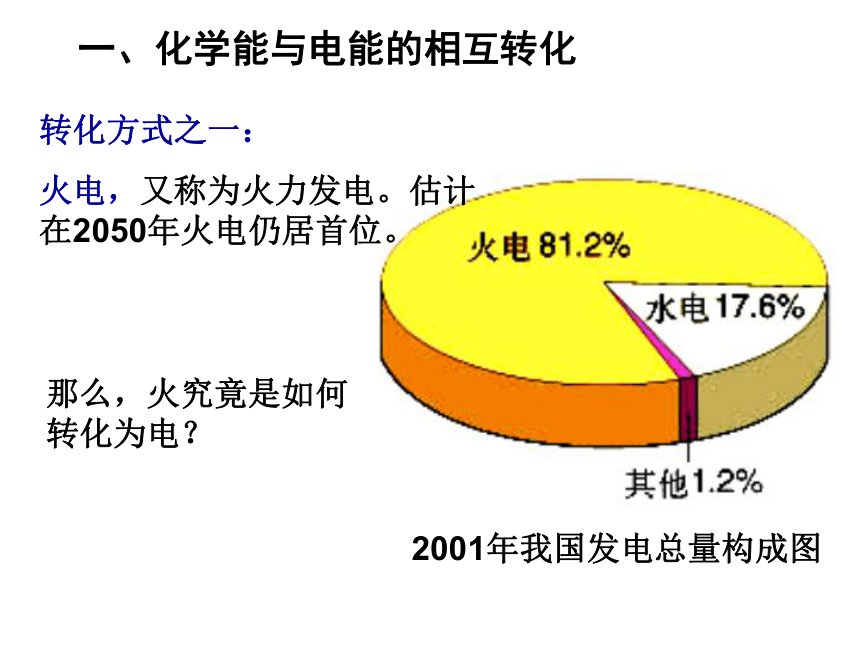
课件30张PPT。化学能与电能 电能是现代社会中应用最广泛、使用最方便、污染最小的一种二次能源,又称为电力。 直接从自然界取得的能源称为一次能源,如流水、风力;一次能源经过加工转换得到的能源称为二次能源如电能、氢能。一、化学能与电能的相互转化2001年我国发电总量构成图那么,火究竟是如何转化为电?转化方式之一:
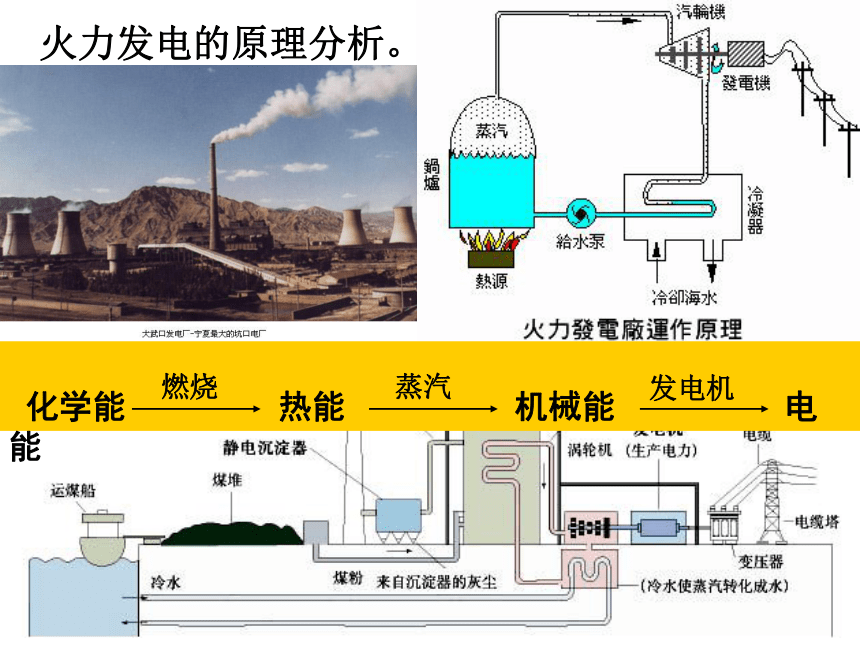
火电,又称为火力发电。估计在2050年火电仍居首位。火力发电的原理分析。火力发电的利弊比较,想想你能说多少?燃料燃烧转化为电能后,社会中应用最广泛、使用最方便。利弊效率较低、烟气污染、粉尘污染 、资源消耗;火力发电污染严重,电力工业已经成为我国最大的污染排放产业之一 火力电站的黑烟思考2:假设你是电力工程师,面对这些利与弊,你会如何应对呢?a、改进火力发电
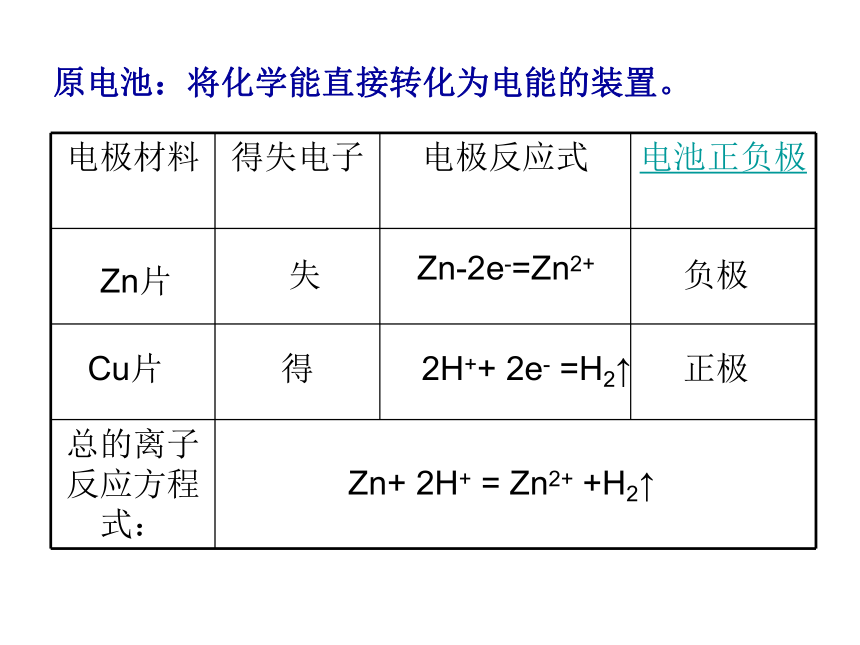
例如将化学能直接转化为电能,可以吗?b、研究新的发电方式转化方式之二:原电池我们一起来想——什么是原电池?锌粒表面有大量气泡生成Zn+H2SO4=ZnSO4+H2?? ↑没接触时锌粒表面有大量气泡,铜片表面无气泡;铜与锌接触时,铜表面有大量气泡,锌表面无气泡(锌不纯时会有少量气泡)??铜表面有大量气泡,锌表面无气泡(锌不纯时会有少量气泡)铜表面有大量气泡,锌表面无气泡(锌不纯时会有少量气泡) ,电流计偏转;反接电流计,指针偏向另一边。??原电池:将化学能直接转化为电能的装置。Zn片
Cu片失得Zn-2e-=Zn2+2H++ 2e- =H2↑负极正极Zn+ 2H+ = Zn2+ +H2↑怎样判断电池正负极?练习:1、把铁、铜用导线连接放入稀硫酸溶液中
2、把锌、石墨用导线连接放入稀硫酸溶液中 电流是从正极流向负极的,与电子的流向是相反的。从实验知道电子从锌片流向铜片,所以电流应该是从铜片流向锌片的,因此可知原电池两极的判断方法:活泼金属→发生氧化反应→向外线路提供电子→原电池的负极;不活泼金属(或可导电非金属如石墨)→发生还原反应→接受外线路提供的电子→原电池的正极。练习:判断电池正负极,并写出电极反应式。
1、将铜、锌用导线连接放入硫酸铜溶液中flash
2、将铝、铁用导线连接一同放入稀硫酸溶液中
3、将铜、石墨用导线连接一同放入硝酸银溶液中
小测:1 判断电池正负极,并写出电极反应式。
将铝、铁用导线连接一同放入硝酸银溶液中
2 请利用氧化还原应:2Al+6HCl==2AlCl3+3H2
设计一个原电池,并在图中分别标出电子和电流流向,写出电极反应式.原电池的构成条件是什么?② 有两种活动性不同的金属(或可导电非金属单质、金属氧化物)作电极。③ 电极材料均插入电解质溶液中。④ 两极相连形成闭合电路。原电池化学反应本质: 较活泼的金属发生氧化反应,电子从较活泼的金属(负极)通过外电路流向较不活泼的金属(正极) ①可以自发地发生氧化还原反应(内部条件)形成原电池后,化学反应的速率会大大加快。例如铜锌原电池中锌片的溶解速度加快了,生成氢气的速度也快了。利用原电池,可以判断金属活泼性。负极材料比正极材料活泼。电池本质:氧化还原反应1 把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,放出氢气的速度( );如是加入几滴氯化铝溶液,放出氢气的速度( )
2 有ABCDE五种金属.将A和B用导线连接起来,浸入稀硫酸中,B表面冒出气泡.将B和E分别投入等浓度的盐酸中,B表面冒出气泡,E没有;将A浸入D的盐溶液中,无明显的变化;将E浸入C的盐溶液中,有金属C析出.判断他们的金属活动性由强到弱的顺序是:原电池原理的应用:(1)实验室准备较快地制取氢气(用锌粒),可采用的方法是:
(2)思考:轮船是用钢板做的,在海水中很容易受到腐蚀,所以,生产轮船的产家在轮船底部装一块锌块来保护轮船,为什么?实践活动
自制电池——水果电池。如下图:二、发展中的化学电源社会应用:将原电池转化成技术产品──化学电源。 1、干电池: 常见的干电池是锌锰电池,也是最早使用的化学电池。A、构造如右图 :B、工作原理:C、使用注意事项:??
D、干电池的正负极:1.干电池
锌锰电池:使用最早的化学电池,属于一次性电池.
负极: ( 锌 ) Zn - 2e- = Zn2+
正极:(石墨) 2NH4++ 2e- = 2NH3 + H2
总反应式: Zn + 2NH4+ = Zn2+ + 2NH3 +H2
广泛用于卡式录音机、闪光灯、电动玩具、
袖珍电视机等。延长干电池使用寿命的五种方法
1.干电池应随买随用,不应过多地买电池存放,如需自己长期存放,应把电池分别用塑料袋包好,放在干燥通风、温度较低的地方,并防止受潮和阳光照射; 2.干电池不要长时间连续使用,而应间歇使用;新旧电池不能搭配使用,搭配使用会使不少电能消耗在旧电池里,非但不省电,反而费电; 3.把快要用完的干电池,拿到火炉上烘烤半小时,等冷凉后再用,这种方法可连续使用两次; 4.池底部或顶部的碳棒旁边钻两个洞,洞口直径约为5毫米,洞深约等于电池长度的十分之七、八,在洞内放入几粒尿素化肥,再灌入浓盐水,过5分钟后,再灌一次,使电池吸足,然后,用棉花堵塞洞口,用蜡密封,电池就会光明如新; 5.电的干电池在阳光下晒几天,晒干后,用学生电源恒流部分对干电池充电,充电电流为0.4安培,充电时间大约12小时,这种方法可使干电流复新几次。 2、充电电池:A、铅蓄电池
正负极:其结构以及工作原理:有所特殊,正极也参与反应:负极:Pb+ SO42- - 2e- = PbSO4正极:PbO2+4H++SO42-+2e-=PbSO4+2H2O
总反应式:B、各种新型的便携式充电电池:3、燃料电池:燃料电池的正负极反应式:总反应式:2H2 +O2===2H2O
(先判断正负极,不是负极材料和电解质溶液反应)
正极反应式:O2+2H2O+4e-=4OH-
负极反应式:2H2+4OH- -4e-=4H2O
火电,又称为火力发电。估计在2050年火电仍居首位。火力发电的原理分析。火力发电的利弊比较,想想你能说多少?燃料燃烧转化为电能后,社会中应用最广泛、使用最方便。利弊效率较低、烟气污染、粉尘污染 、资源消耗;火力发电污染严重,电力工业已经成为我国最大的污染排放产业之一 火力电站的黑烟思考2:假设你是电力工程师,面对这些利与弊,你会如何应对呢?a、改进火力发电
例如将化学能直接转化为电能,可以吗?b、研究新的发电方式转化方式之二:原电池我们一起来想——什么是原电池?锌粒表面有大量气泡生成Zn+H2SO4=ZnSO4+H2?? ↑没接触时锌粒表面有大量气泡,铜片表面无气泡;铜与锌接触时,铜表面有大量气泡,锌表面无气泡(锌不纯时会有少量气泡)??铜表面有大量气泡,锌表面无气泡(锌不纯时会有少量气泡)铜表面有大量气泡,锌表面无气泡(锌不纯时会有少量气泡) ,电流计偏转;反接电流计,指针偏向另一边。??原电池:将化学能直接转化为电能的装置。Zn片
Cu片失得Zn-2e-=Zn2+2H++ 2e- =H2↑负极正极Zn+ 2H+ = Zn2+ +H2↑怎样判断电池正负极?练习:1、把铁、铜用导线连接放入稀硫酸溶液中
2、把锌、石墨用导线连接放入稀硫酸溶液中 电流是从正极流向负极的,与电子的流向是相反的。从实验知道电子从锌片流向铜片,所以电流应该是从铜片流向锌片的,因此可知原电池两极的判断方法:活泼金属→发生氧化反应→向外线路提供电子→原电池的负极;不活泼金属(或可导电非金属如石墨)→发生还原反应→接受外线路提供的电子→原电池的正极。练习:判断电池正负极,并写出电极反应式。
1、将铜、锌用导线连接放入硫酸铜溶液中flash
2、将铝、铁用导线连接一同放入稀硫酸溶液中
3、将铜、石墨用导线连接一同放入硝酸银溶液中
小测:1 判断电池正负极,并写出电极反应式。
将铝、铁用导线连接一同放入硝酸银溶液中
2 请利用氧化还原应:2Al+6HCl==2AlCl3+3H2
设计一个原电池,并在图中分别标出电子和电流流向,写出电极反应式.原电池的构成条件是什么?② 有两种活动性不同的金属(或可导电非金属单质、金属氧化物)作电极。③ 电极材料均插入电解质溶液中。④ 两极相连形成闭合电路。原电池化学反应本质: 较活泼的金属发生氧化反应,电子从较活泼的金属(负极)通过外电路流向较不活泼的金属(正极) ①可以自发地发生氧化还原反应(内部条件)形成原电池后,化学反应的速率会大大加快。例如铜锌原电池中锌片的溶解速度加快了,生成氢气的速度也快了。利用原电池,可以判断金属活泼性。负极材料比正极材料活泼。电池本质:氧化还原反应1 把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,放出氢气的速度( );如是加入几滴氯化铝溶液,放出氢气的速度( )
2 有ABCDE五种金属.将A和B用导线连接起来,浸入稀硫酸中,B表面冒出气泡.将B和E分别投入等浓度的盐酸中,B表面冒出气泡,E没有;将A浸入D的盐溶液中,无明显的变化;将E浸入C的盐溶液中,有金属C析出.判断他们的金属活动性由强到弱的顺序是:原电池原理的应用:(1)实验室准备较快地制取氢气(用锌粒),可采用的方法是:
(2)思考:轮船是用钢板做的,在海水中很容易受到腐蚀,所以,生产轮船的产家在轮船底部装一块锌块来保护轮船,为什么?实践活动
自制电池——水果电池。如下图:二、发展中的化学电源社会应用:将原电池转化成技术产品──化学电源。 1、干电池: 常见的干电池是锌锰电池,也是最早使用的化学电池。A、构造如右图 :B、工作原理:C、使用注意事项:??
D、干电池的正负极:1.干电池
锌锰电池:使用最早的化学电池,属于一次性电池.
负极: ( 锌 ) Zn - 2e- = Zn2+
正极:(石墨) 2NH4++ 2e- = 2NH3 + H2
总反应式: Zn + 2NH4+ = Zn2+ + 2NH3 +H2
广泛用于卡式录音机、闪光灯、电动玩具、
袖珍电视机等。延长干电池使用寿命的五种方法
1.干电池应随买随用,不应过多地买电池存放,如需自己长期存放,应把电池分别用塑料袋包好,放在干燥通风、温度较低的地方,并防止受潮和阳光照射; 2.干电池不要长时间连续使用,而应间歇使用;新旧电池不能搭配使用,搭配使用会使不少电能消耗在旧电池里,非但不省电,反而费电; 3.把快要用完的干电池,拿到火炉上烘烤半小时,等冷凉后再用,这种方法可连续使用两次; 4.池底部或顶部的碳棒旁边钻两个洞,洞口直径约为5毫米,洞深约等于电池长度的十分之七、八,在洞内放入几粒尿素化肥,再灌入浓盐水,过5分钟后,再灌一次,使电池吸足,然后,用棉花堵塞洞口,用蜡密封,电池就会光明如新; 5.电的干电池在阳光下晒几天,晒干后,用学生电源恒流部分对干电池充电,充电电流为0.4安培,充电时间大约12小时,这种方法可使干电流复新几次。 2、充电电池:A、铅蓄电池
正负极:其结构以及工作原理:有所特殊,正极也参与反应:负极:Pb+ SO42- - 2e- = PbSO4正极:PbO2+4H++SO42-+2e-=PbSO4+2H2O
总反应式:B、各种新型的便携式充电电池:3、燃料电池:燃料电池的正负极反应式:总反应式:2H2 +O2===2H2O
(先判断正负极,不是负极材料和电解质溶液反应)
正极反应式:O2+2H2O+4e-=4OH-
负极反应式:2H2+4OH- -4e-=4H2O
