海口市灵山中学高二第一学期期末化学试题(理科-化学反应原理)
文档属性
| 名称 | 海口市灵山中学高二第一学期期末化学试题(理科-化学反应原理) |  | |
| 格式 | zip | ||
| 文件大小 | 103.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2008-06-06 07:59:00 | ||
图片预览



文档简介
命题人:吴坤贤
海口市灵山中学高二第一学期期末化学试题(理科)
(时间90分钟,满分100分)
可能用到的原子量:H 1 O 16 Ca 40 Fe 56 Cu 64
第 Ⅰ 卷 (选择题,共46分)
一、选择题(本题包括23小题,每小题2分,共46分,每小题只有一个选项符合题意)
1、关于吸热反应的说法,正确的是
A、凡需加热的反应一定是吸热反应 B、只有分解反应才是吸热反应
C、使用催化剂的反应是吸热反应 D、酸碱中和反应的逆反应是吸热反应
2、已知:101kPa时的辛烷的燃烧热为5518kJ·mol-1,强酸与强碱在稀溶液中发生反应时的中和热为57.3kJ·mol-1,则下列热化学方程式书写正确的是( )
①C8H18(l)+O2(g) 8CO2(g)+9H2O(l);△H=+5518kJ·mol-1
②C8H18(l)+O2(g) 8CO2(g)+9H2O(l);△H=-5518kJ·mol-1
③H++OH- H2O;△H=-57.3kJ·mol-1
④NaOH(aq)+H2SO4(aq) Na2SO4(aq)+H2O(l);△H=+57.3kJ·mol-1
A.①③ B.②③ C.②④ D.只有②
3、可以充分说明反应P(g)+Q(g) R(g)+S(g)在恒温下已达到平衡的是( )
A.反应容器内的压强不随时间改变
B.反应容器内P、Q、R、S四者共存
C.P的生成速率和S的生成速率相等
D.反应容器内的气体总物质的量不随时间变化
4、下列事实中不能用平衡移动原理解释是( )
A.密闭、低温是存放氨水的必要条件
B.实验室常用排饱和食盐水法收集氯气
C.硝酸工业生产中,使用过量空气以提高NH3利用率
D.合成氨反应采用较高温度和使用催化剂以提高氨气的产量
5.对于反应A2+3B2=2C来说,以下化学反应速率的表示中,反应速率最快的是
A. v(B2)=0.8 mol/ (L·s) B. v(A2)=0.4 mol/ (L·s)
C. v(C)=0.6 mol/ (L·s) D. v(B2)=4.2 mol/ (L·s)
6、下列说法正确的是:( )
A.凡是放热反应都是自发的。 B.铁在潮湿空气中生锈是自发过程
C.自发反应都是熵增大的反应。 D.电解池的反应是属于自发反应
7.有关AgCl沉淀的溶解平衡,说法正确的是 ( )
A.AgCl沉淀生成和沉淀溶解不断进行,但速率相等
B.AgCl难溶于水,溶液中没有Ag+和Cl-
C.升高温度,AgCl沉淀的溶解度减小
D.向AgCl沉淀中加入NaCl固体,AgCl沉淀的溶解度不变
8、下列事实可证明氨水是弱碱的是 ( )
A.氨水能跟氯化亚铁溶液反应生成氢氧化亚铁
B.铵盐受热易分解
C.0.1mol/L氨水可以使酚酞试液变红
D.0.1mol/L氯化铵溶液的pH约为5
9、相同条件下,等体积、等pH的醋酸溶液和盐酸分别加水稀释后,溶液的pH仍相同,则所得溶液的体积 ( )
A.仍相同 B.醋酸大 C.盐酸大 D.无法判断
10、下列说法正确的是 ( )
A.水解反应是吸热反应
B.升高温度可以抑制盐类的水解
C.正盐水溶液pH均为7
D.硫酸钠水溶液pH小于7
11、向5mL氯化钠溶液里滴入一滴AgNO3溶液,出现白色沉淀,继续加入一滴KI溶液,沉淀变成黄色,再加入一滴硫化钠溶液沉淀又变成黑色,根据上述变化过程,分析此三种沉淀物的溶解度关系为
A.AgCl=AgI=Ag2S B.AgCl<AgI<Ag2S
C.AgCl>AgI>Ag2S D.因发生特殊反应,无法判断
12、一定能在下列溶液中大量共存的离子组是
A.含有大量Al3+的溶液:Na+、NH4+、SO42-、Cl-
B.c(H+)=1×10-13mol·L-1的溶液:Na+、Ca2+、SO42-、CO32-
C.含有大量Fe3+的溶液:Na+、Mg2+、NO3-、SCN-
D.含有大量NO3-的溶液:H+、Fe2+、SO42-、Cl-
13、下列各式中,属于正确的电离方程式的是( )
A.HCO3- + H2O H2CO3 + OH- B.HCO3- +OH- ==== H2O + CO32-
C.NH3 + H+ === NH4+ D.NH3·H2O NH4+ + OH-
14、根据下列事实:①X+Y2+=X2++Y;②Z+H2O(冷)=Z(OH)2+H2↑;③Z2+氧化性比X2+弱;④由Y、W电极组成的电池,电极反应为W2++2e-=W、Y-2e-=Y2+,可知X、Y、Z、W的还原性由强到弱的顺序为 ( )
A. X > Z > Y > W B. Z > W > X > Y
C. Z > Y > X > W D. Z > X > Y > W
15.下列叙述正确的是 ( )
A.0.1mol·L-1氨水中,c(OH-)=c(NH4+)
B.常温下,10 mL 0.02mol·L-1HCl溶液与10 mL 0.02mol·L-1Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH = 2
C.在0.1mol·L-1CH3COONa溶液中,c(OH-)=c(CH3COOH)+c(H+)
D.0.1mol·L-1某二元弱酸强碱盐NaHA溶液中:
c(Na+)=2c(A2-)+c(HA-)+c(H2A)
16、废电池的污染引起人们的广泛重视,废电池中对环境形成污染的主要物质是
A.锌 B.汞 C.石墨 D.二氧化锰
17、.化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是
A.电解饱和食盐水时,阳极的电极反应式为:2Cl- -2e-= Cl2 ↑
B.氢氧燃料电池的负极反应式:O2 + 2H2O + 4e- == 4OH-
C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu -2e- == Cu2+
D.钢铁发生电化学腐蚀的正极反应式:Fe-2e- == Fe2+
18、关于原电池和电解池的叙述正确的是 ( )
A.原电池失去电子的电极称为阴极
B.电解池的阳极、原电池的负极都发生氧化反应
C.原电池的两极,一定要由活动性不同的两种金属组成
D.电解时电解池的阳极一定是阴离子放电
19、我国第五套人民币中的一元硬币材料为钢芯镀镍,依据你所掌握的电镀原理,你认为硬币制作时,钢芯应该做 ( )
A.正极 B.负极 C.阳极 D.阴极
20、某可充电的锂离子电池以LiMn2O4为正极,嵌入锂的碳材料为负极,含Li+导电固体为电解质。放电时的电池反应为:Li+LiMn2O4==Li2Mn2O4。下列说法正确的是
A.放电时,LiMn2O4发生还原反应
B.放电时,正极反应为:Li++LiMn2O4+e-==Li2Mn2O4
C.充电时,LiMn2O4发生氧化反应
D.充电时,阳极反应为:Li++e-==Li
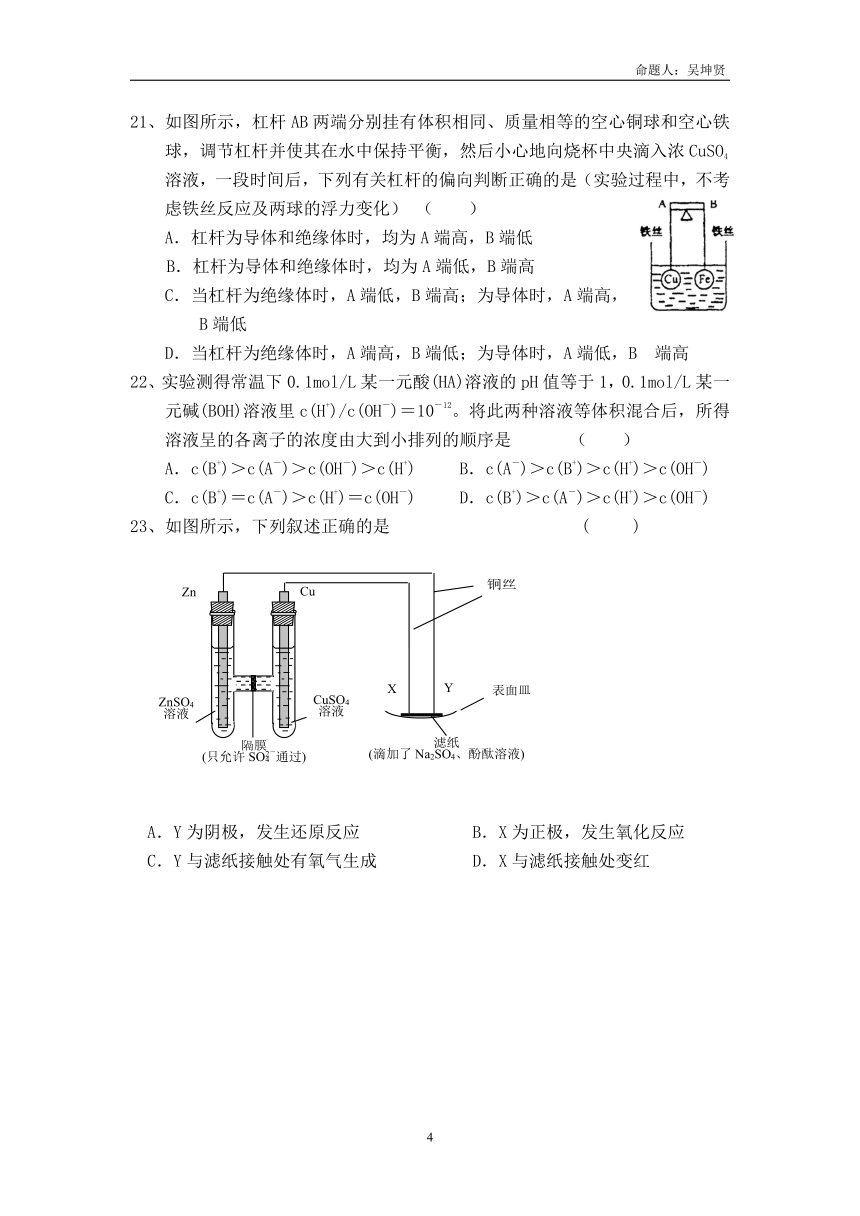
21、如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化) ( )
A.杠杆为导体和绝缘体时,均为A端高,B端低
B.杠杆为导体和绝缘体时,均为A端低,B端高
C.当杠杆为绝缘体时,A端低,B端高;为导体时,A端高,
B端低
D.当杠杆为绝缘体时,A端高,B端低;为导体时,A端低,B 端高
22、实验测得常温下0.1mol/L某一元酸(HA)溶液的pH值等于1,0.1mol/L某一元碱(BOH)溶液里c(H+)/c(OH-)=10-12。将此两种溶液等体积混合后,所得溶液呈的各离子的浓度由大到小排列的顺序是 ( )
A.c(B+)>c(A-)>c(OH-)>c(H+) B.c(A-)>c(B+)>c(H+)>c(OH-)
C.c(B+)=c(A-)>c(H+)=c(OH-) D.c(B+)>c(A-)>c(H+)>c(OH-)
23、如图所示,下列叙述正确的是 ( )
A.Y为阴极,发生还原反应 B.X为正极,发生氧化反应
C.Y与滤纸接触处有氧气生成 D.X与滤纸接触处变红
海口市灵山中学高二第一学期期末化学试题(理科)
答案卷(理科)
(时间90分钟,满分100分)
可能用到的原子量:H 1 O 16 Ca 40 Fe 56 Cu 64
班级: 姓名: 座号: 总分:
第Ⅰ卷 (选择题,共46分)
题号 1 2 3 4 5 6 7 8 9 10 11 12
答案
题号 13 14 15 16 17 18 19 20 21 22 23 24
答案
第Ⅱ卷 (非选择题,共54分)
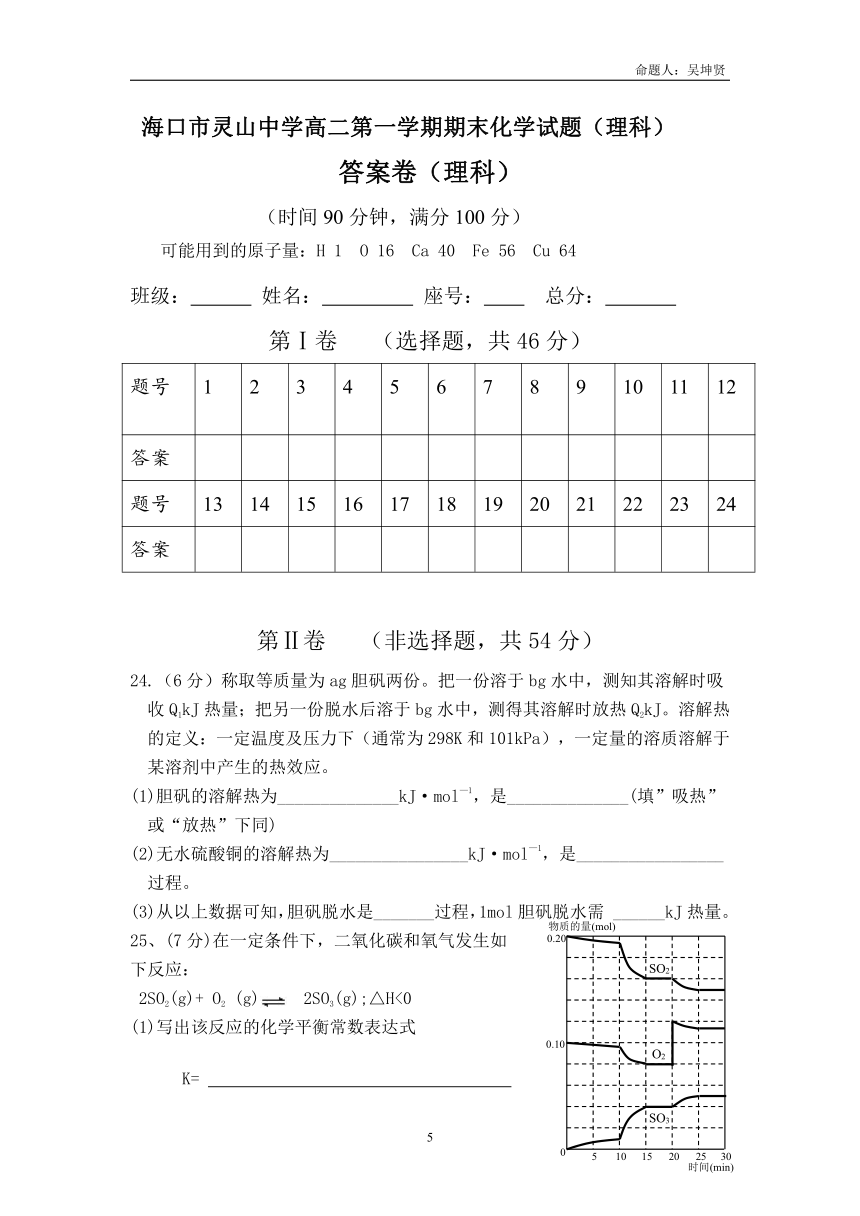
24.(6分)称取等质量为ag胆矾两份。把一份溶于bg水中,测知其溶解时吸收Q1kJ热量;把另一份脱水后溶于bg水中,测得其溶解时放热Q2kJ。溶解热的定义:一定温度及压力下(通常为298K和101kPa),一定量的溶质溶解于某溶剂中产生的热效应。
(1)胆矾的溶解热为______________kJ·mol—1,是______________(填”吸热”或“放热”下同)
(2)无水硫酸铜的溶解热为________________kJ·mol—1,是_________________过程。
(3)从以上数据可知,胆矾脱水是_______过程,1mol胆矾脱水需 ______kJ热量。
25、(7分)在一定条件下,二氧化碳和氧气发生如
下反应:
2SO2(g)+ O2 (g) 2SO3(g);△H<0
(1)写出该反应的化学平衡常数表达式
K=
(2)降低温度,该反应K值 ,二氧化硫转
化率 ,化学反应速 。(以上均填增大、减小或不变)
(3)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间是 。
(4)据图判断,反应进行至20min时,曲线发生变化的原因是
(用文字表达)。10min到
15min的曲线变化的原因可能是 (填写编号)。
a.加了催化剂 b.缩小容器体积
c.降低温度 d.增加SO3的物质的量
26、(4分)金属的电化学腐蚀分为 和 。钢铁发生吸氧腐蚀时,正极发生 反应,负极发生的电极反应式为 。
27(9分)某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定测定其浓度。
(1)滴定
①用 式滴定管盛装c1 mol/L盐酸标准液。右图表示某次滴定时50 mL滴定管中滴定前后液面的位置。请将用去的标准盐酸的体积填入③表空格中,此时滴定管中液体的体积 mL。
②下表是4种常见指示剂的变色范围:
指示剂 石蕊 甲基橙 酚酞
变色范围(pH) 5.0—8.0 3.1—4.4 8.2—10.0
该实验应选用 作指示剂;
③有关数据记录如下:
滴定序号 待测液体积(mL) 所消耗盐酸标准液的体积(mL)
滴定前 滴定后 消耗的体积
1 V 0.50 25.80 25.30
2 V
3 V 6.00 31.35 25.35
(2)根据1、3所给数据,写出计算烧碱样品的物质的量浓度的表达式(不必化简)
C2 = 。
(3)对下列几种假定情况进行讨论:(填“无影响”、“偏高”、“偏低”)
a.若滴定前用蒸馏水冲洗锥形瓶,则会使测定结果 ;
b.读数时,若滴定前仰视,滴定后俯视,则会使测定结果 ;
28、(7分)依据氧化还原反应:2Ag+(aq)+Cu(s) = Cu2+(aq)+2Ag(s)设计的原电池如图所示。
请回答下列问题:
(1)电极X的材料是________;电解质溶液Y是___________;
(2)银电极为电池的________极,发生的电极反应为 ;
X电极上发生的电极反应为____________________________;
(3)外电路中的电子是从____ ___ 电极流向 ____ ____电极。
29.(10分)下图表示一个电解池,装有电解质溶液a;X、Y是两块电极板,通
过导线与直流电源相连。请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则:
①Y电极上的电极反应式是 ;
②在X电极附近观察到的现象是
。
(2)若X、Y都是惰性电极,a是浓度均为2mol/L的AgNO3与Cu(NO3)2的混合溶液1L,电解一段时间后,X电极上有3.2g铜析出,写出电解过程中有关反应的离子方程式
此时直流电源已输出 mol的电子。
(3)如果要用电解的方法精炼粗铜(含有Fe、Zn、Pt、C等杂质),电解质溶液a选用CuSO4溶液,则:
①X电极材料是 ,X电极反应式
②精炼完成后,硫酸铜溶液的浓度 (填“变大”、“变小”或“不变”)。
(4)铅蓄电池反应的化学方程式是:Pb+PbO2+2H2SO4 2PbSO4+2H2O。若以铅蓄电池为电源,用惰性电极电解CuSO4溶液,在电解过程中生成11.2LO2(标准状况),则铅蓄电池中消耗的硫酸的物质的量为 。
30.(11分)
(1)、现有NH4Cl和NH3·H2O组成的混合溶液,若其pH=7,则该溶液中
C(NH4+)__ _C(Cl-);若pH>7,则该溶液中C(NH4+)______C(Cl-)。
(填“>”或“<”或“=”).
(2)碱地(含较多NaCl、Na2CO3)不利于作物生长。产生碱性的原因是(用离子方程式表示) ;施加少量石膏(CaSO4·2H2O)可降低盐碱地的碱性,试解释其原因_________________________ ___________
(3)在蒸发皿中加热蒸干并灼烧(低于400℃)下列物质的溶液,可以得到该物质固体的是_____________________(填序号)
① FeCl3 、 ② NaHCO3 、③ MgSO4
④ KMnO4 、 ⑤ Na2CO3 、⑥ NH4Cl
(4)配制氯化铁溶液常出现浑浊现象,其原因是(用离子方程式表示)
。
(5)25℃时,pH=12.0的KOH溶液中,由水电离出的C (OH-)=_________mol/L;
pH=12.0的KCN溶液中,由水电离出来的C(OH-)=________mol/L。
高二第一学期期末化学试题答案卷(理科)
第Ⅰ卷 (选择题,共46分)
题号 1 2 3 4 5 6 7 8 9 10 11 12
答案 D D C D D B A D B A C A
题号 13 14 15 16 17 18 19 20 21 22 23
答案 D D C A A B D B D C A
第Ⅱ卷 (非选择题,共54分)
24.(1) -250Q1/akj/mol 吸热
(2) -250Q2/akj/mol 放热
(3) 吸热 250(Q1+Q2)/a
25.(1)、K=C2(SO3)/[C2(SO2)·C(O2)]
(2)、增大 增大 减少
(3)、15min
(4) 、增大O2的浓度 b
26.析氢腐蚀 吸氧腐蚀 还原反应 Fe-2e-=Fe2+
27. (1)①酸 大于25.10
0.30 24.90 24.60
②甲基橙、酚酞
(2)
(3)无影响 偏低
28. (1)铜(或Cu);AgNO3溶液。
(2)正, Ag++e- = Ag; Cu-2e- = Cu (3)负(Cu);正(Ag)
29.(1)①2C1――2e- =C12↑(1分)②溶液变红色,产生无色气泡
电解
(2)4Ag+ + 2H2O ====== 4Ag + O2 +4H+
电解
2Cu2+ + 2H2O ====== 2Cu +O2↑+4H+ 2.1
(3)①铜(或纯铜) Cu2++2e-=Cu ②变小 (4)2mol
30.
(1)= >
(2)CO32-+H2O HCO3- +OH- 因石膏中的Ca2+与CO32-结合生成CaCO3沉淀,c(CO32-)减小,故碱性减弱。
(3)③⑤
(4)Fe3++3H2O Fe(OH)3+3H+
(5)1.0×10-12 1.0×10-2(每空2分)
ZnSO4
溶液
隔膜
(只允许SO42 -通过)
CuSO4
溶液
滤纸
(滴加了Na2SO4、酚酞溶液)
表面皿
Y
Zn
Cu
铜丝
X
物质的量(mol)
时间(min)
0
0.10
0.20
5
105
15
20
25
30
SO2
O2
SO3
盐桥
X
Y
A
CuSO4溶液
电流计
Ag
放电
充电
PAGE
1
海口市灵山中学高二第一学期期末化学试题(理科)
(时间90分钟,满分100分)
可能用到的原子量:H 1 O 16 Ca 40 Fe 56 Cu 64
第 Ⅰ 卷 (选择题,共46分)
一、选择题(本题包括23小题,每小题2分,共46分,每小题只有一个选项符合题意)
1、关于吸热反应的说法,正确的是
A、凡需加热的反应一定是吸热反应 B、只有分解反应才是吸热反应
C、使用催化剂的反应是吸热反应 D、酸碱中和反应的逆反应是吸热反应
2、已知:101kPa时的辛烷的燃烧热为5518kJ·mol-1,强酸与强碱在稀溶液中发生反应时的中和热为57.3kJ·mol-1,则下列热化学方程式书写正确的是( )
①C8H18(l)+O2(g) 8CO2(g)+9H2O(l);△H=+5518kJ·mol-1
②C8H18(l)+O2(g) 8CO2(g)+9H2O(l);△H=-5518kJ·mol-1
③H++OH- H2O;△H=-57.3kJ·mol-1
④NaOH(aq)+H2SO4(aq) Na2SO4(aq)+H2O(l);△H=+57.3kJ·mol-1
A.①③ B.②③ C.②④ D.只有②
3、可以充分说明反应P(g)+Q(g) R(g)+S(g)在恒温下已达到平衡的是( )
A.反应容器内的压强不随时间改变
B.反应容器内P、Q、R、S四者共存
C.P的生成速率和S的生成速率相等
D.反应容器内的气体总物质的量不随时间变化
4、下列事实中不能用平衡移动原理解释是( )
A.密闭、低温是存放氨水的必要条件
B.实验室常用排饱和食盐水法收集氯气
C.硝酸工业生产中,使用过量空气以提高NH3利用率
D.合成氨反应采用较高温度和使用催化剂以提高氨气的产量
5.对于反应A2+3B2=2C来说,以下化学反应速率的表示中,反应速率最快的是
A. v(B2)=0.8 mol/ (L·s) B. v(A2)=0.4 mol/ (L·s)
C. v(C)=0.6 mol/ (L·s) D. v(B2)=4.2 mol/ (L·s)
6、下列说法正确的是:( )
A.凡是放热反应都是自发的。 B.铁在潮湿空气中生锈是自发过程
C.自发反应都是熵增大的反应。 D.电解池的反应是属于自发反应
7.有关AgCl沉淀的溶解平衡,说法正确的是 ( )
A.AgCl沉淀生成和沉淀溶解不断进行,但速率相等
B.AgCl难溶于水,溶液中没有Ag+和Cl-
C.升高温度,AgCl沉淀的溶解度减小
D.向AgCl沉淀中加入NaCl固体,AgCl沉淀的溶解度不变
8、下列事实可证明氨水是弱碱的是 ( )
A.氨水能跟氯化亚铁溶液反应生成氢氧化亚铁
B.铵盐受热易分解
C.0.1mol/L氨水可以使酚酞试液变红
D.0.1mol/L氯化铵溶液的pH约为5
9、相同条件下,等体积、等pH的醋酸溶液和盐酸分别加水稀释后,溶液的pH仍相同,则所得溶液的体积 ( )
A.仍相同 B.醋酸大 C.盐酸大 D.无法判断
10、下列说法正确的是 ( )
A.水解反应是吸热反应
B.升高温度可以抑制盐类的水解
C.正盐水溶液pH均为7
D.硫酸钠水溶液pH小于7
11、向5mL氯化钠溶液里滴入一滴AgNO3溶液,出现白色沉淀,继续加入一滴KI溶液,沉淀变成黄色,再加入一滴硫化钠溶液沉淀又变成黑色,根据上述变化过程,分析此三种沉淀物的溶解度关系为
A.AgCl=AgI=Ag2S B.AgCl<AgI<Ag2S
C.AgCl>AgI>Ag2S D.因发生特殊反应,无法判断
12、一定能在下列溶液中大量共存的离子组是
A.含有大量Al3+的溶液:Na+、NH4+、SO42-、Cl-
B.c(H+)=1×10-13mol·L-1的溶液:Na+、Ca2+、SO42-、CO32-
C.含有大量Fe3+的溶液:Na+、Mg2+、NO3-、SCN-
D.含有大量NO3-的溶液:H+、Fe2+、SO42-、Cl-
13、下列各式中,属于正确的电离方程式的是( )
A.HCO3- + H2O H2CO3 + OH- B.HCO3- +OH- ==== H2O + CO32-
C.NH3 + H+ === NH4+ D.NH3·H2O NH4+ + OH-
14、根据下列事实:①X+Y2+=X2++Y;②Z+H2O(冷)=Z(OH)2+H2↑;③Z2+氧化性比X2+弱;④由Y、W电极组成的电池,电极反应为W2++2e-=W、Y-2e-=Y2+,可知X、Y、Z、W的还原性由强到弱的顺序为 ( )
A. X > Z > Y > W B. Z > W > X > Y
C. Z > Y > X > W D. Z > X > Y > W
15.下列叙述正确的是 ( )
A.0.1mol·L-1氨水中,c(OH-)=c(NH4+)
B.常温下,10 mL 0.02mol·L-1HCl溶液与10 mL 0.02mol·L-1Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH = 2
C.在0.1mol·L-1CH3COONa溶液中,c(OH-)=c(CH3COOH)+c(H+)
D.0.1mol·L-1某二元弱酸强碱盐NaHA溶液中:
c(Na+)=2c(A2-)+c(HA-)+c(H2A)
16、废电池的污染引起人们的广泛重视,废电池中对环境形成污染的主要物质是
A.锌 B.汞 C.石墨 D.二氧化锰
17、.化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是
A.电解饱和食盐水时,阳极的电极反应式为:2Cl- -2e-= Cl2 ↑
B.氢氧燃料电池的负极反应式:O2 + 2H2O + 4e- == 4OH-
C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu -2e- == Cu2+
D.钢铁发生电化学腐蚀的正极反应式:Fe-2e- == Fe2+
18、关于原电池和电解池的叙述正确的是 ( )
A.原电池失去电子的电极称为阴极
B.电解池的阳极、原电池的负极都发生氧化反应
C.原电池的两极,一定要由活动性不同的两种金属组成
D.电解时电解池的阳极一定是阴离子放电
19、我国第五套人民币中的一元硬币材料为钢芯镀镍,依据你所掌握的电镀原理,你认为硬币制作时,钢芯应该做 ( )
A.正极 B.负极 C.阳极 D.阴极
20、某可充电的锂离子电池以LiMn2O4为正极,嵌入锂的碳材料为负极,含Li+导电固体为电解质。放电时的电池反应为:Li+LiMn2O4==Li2Mn2O4。下列说法正确的是
A.放电时,LiMn2O4发生还原反应
B.放电时,正极反应为:Li++LiMn2O4+e-==Li2Mn2O4
C.充电时,LiMn2O4发生氧化反应
D.充电时,阳极反应为:Li++e-==Li
21、如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化) ( )
A.杠杆为导体和绝缘体时,均为A端高,B端低
B.杠杆为导体和绝缘体时,均为A端低,B端高
C.当杠杆为绝缘体时,A端低,B端高;为导体时,A端高,
B端低
D.当杠杆为绝缘体时,A端高,B端低;为导体时,A端低,B 端高
22、实验测得常温下0.1mol/L某一元酸(HA)溶液的pH值等于1,0.1mol/L某一元碱(BOH)溶液里c(H+)/c(OH-)=10-12。将此两种溶液等体积混合后,所得溶液呈的各离子的浓度由大到小排列的顺序是 ( )
A.c(B+)>c(A-)>c(OH-)>c(H+) B.c(A-)>c(B+)>c(H+)>c(OH-)
C.c(B+)=c(A-)>c(H+)=c(OH-) D.c(B+)>c(A-)>c(H+)>c(OH-)
23、如图所示,下列叙述正确的是 ( )
A.Y为阴极,发生还原反应 B.X为正极,发生氧化反应
C.Y与滤纸接触处有氧气生成 D.X与滤纸接触处变红
海口市灵山中学高二第一学期期末化学试题(理科)
答案卷(理科)
(时间90分钟,满分100分)
可能用到的原子量:H 1 O 16 Ca 40 Fe 56 Cu 64
班级: 姓名: 座号: 总分:
第Ⅰ卷 (选择题,共46分)
题号 1 2 3 4 5 6 7 8 9 10 11 12
答案
题号 13 14 15 16 17 18 19 20 21 22 23 24
答案
第Ⅱ卷 (非选择题,共54分)
24.(6分)称取等质量为ag胆矾两份。把一份溶于bg水中,测知其溶解时吸收Q1kJ热量;把另一份脱水后溶于bg水中,测得其溶解时放热Q2kJ。溶解热的定义:一定温度及压力下(通常为298K和101kPa),一定量的溶质溶解于某溶剂中产生的热效应。
(1)胆矾的溶解热为______________kJ·mol—1,是______________(填”吸热”或“放热”下同)
(2)无水硫酸铜的溶解热为________________kJ·mol—1,是_________________过程。
(3)从以上数据可知,胆矾脱水是_______过程,1mol胆矾脱水需 ______kJ热量。
25、(7分)在一定条件下,二氧化碳和氧气发生如
下反应:
2SO2(g)+ O2 (g) 2SO3(g);△H<0
(1)写出该反应的化学平衡常数表达式
K=
(2)降低温度,该反应K值 ,二氧化硫转
化率 ,化学反应速 。(以上均填增大、减小或不变)
(3)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间是 。
(4)据图判断,反应进行至20min时,曲线发生变化的原因是
(用文字表达)。10min到
15min的曲线变化的原因可能是 (填写编号)。
a.加了催化剂 b.缩小容器体积
c.降低温度 d.增加SO3的物质的量
26、(4分)金属的电化学腐蚀分为 和 。钢铁发生吸氧腐蚀时,正极发生 反应,负极发生的电极反应式为 。
27(9分)某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定测定其浓度。
(1)滴定
①用 式滴定管盛装c1 mol/L盐酸标准液。右图表示某次滴定时50 mL滴定管中滴定前后液面的位置。请将用去的标准盐酸的体积填入③表空格中,此时滴定管中液体的体积 mL。
②下表是4种常见指示剂的变色范围:
指示剂 石蕊 甲基橙 酚酞
变色范围(pH) 5.0—8.0 3.1—4.4 8.2—10.0
该实验应选用 作指示剂;
③有关数据记录如下:
滴定序号 待测液体积(mL) 所消耗盐酸标准液的体积(mL)
滴定前 滴定后 消耗的体积
1 V 0.50 25.80 25.30
2 V
3 V 6.00 31.35 25.35
(2)根据1、3所给数据,写出计算烧碱样品的物质的量浓度的表达式(不必化简)
C2 = 。
(3)对下列几种假定情况进行讨论:(填“无影响”、“偏高”、“偏低”)
a.若滴定前用蒸馏水冲洗锥形瓶,则会使测定结果 ;
b.读数时,若滴定前仰视,滴定后俯视,则会使测定结果 ;
28、(7分)依据氧化还原反应:2Ag+(aq)+Cu(s) = Cu2+(aq)+2Ag(s)设计的原电池如图所示。
请回答下列问题:
(1)电极X的材料是________;电解质溶液Y是___________;
(2)银电极为电池的________极,发生的电极反应为 ;
X电极上发生的电极反应为____________________________;
(3)外电路中的电子是从____ ___ 电极流向 ____ ____电极。
29.(10分)下图表示一个电解池,装有电解质溶液a;X、Y是两块电极板,通
过导线与直流电源相连。请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则:
①Y电极上的电极反应式是 ;
②在X电极附近观察到的现象是
。
(2)若X、Y都是惰性电极,a是浓度均为2mol/L的AgNO3与Cu(NO3)2的混合溶液1L,电解一段时间后,X电极上有3.2g铜析出,写出电解过程中有关反应的离子方程式
此时直流电源已输出 mol的电子。
(3)如果要用电解的方法精炼粗铜(含有Fe、Zn、Pt、C等杂质),电解质溶液a选用CuSO4溶液,则:
①X电极材料是 ,X电极反应式
②精炼完成后,硫酸铜溶液的浓度 (填“变大”、“变小”或“不变”)。
(4)铅蓄电池反应的化学方程式是:Pb+PbO2+2H2SO4 2PbSO4+2H2O。若以铅蓄电池为电源,用惰性电极电解CuSO4溶液,在电解过程中生成11.2LO2(标准状况),则铅蓄电池中消耗的硫酸的物质的量为 。
30.(11分)
(1)、现有NH4Cl和NH3·H2O组成的混合溶液,若其pH=7,则该溶液中
C(NH4+)__ _C(Cl-);若pH>7,则该溶液中C(NH4+)______C(Cl-)。
(填“>”或“<”或“=”).
(2)碱地(含较多NaCl、Na2CO3)不利于作物生长。产生碱性的原因是(用离子方程式表示) ;施加少量石膏(CaSO4·2H2O)可降低盐碱地的碱性,试解释其原因_________________________ ___________
(3)在蒸发皿中加热蒸干并灼烧(低于400℃)下列物质的溶液,可以得到该物质固体的是_____________________(填序号)
① FeCl3 、 ② NaHCO3 、③ MgSO4
④ KMnO4 、 ⑤ Na2CO3 、⑥ NH4Cl
(4)配制氯化铁溶液常出现浑浊现象,其原因是(用离子方程式表示)
。
(5)25℃时,pH=12.0的KOH溶液中,由水电离出的C (OH-)=_________mol/L;
pH=12.0的KCN溶液中,由水电离出来的C(OH-)=________mol/L。
高二第一学期期末化学试题答案卷(理科)
第Ⅰ卷 (选择题,共46分)
题号 1 2 3 4 5 6 7 8 9 10 11 12
答案 D D C D D B A D B A C A
题号 13 14 15 16 17 18 19 20 21 22 23
答案 D D C A A B D B D C A
第Ⅱ卷 (非选择题,共54分)
24.(1) -250Q1/akj/mol 吸热
(2) -250Q2/akj/mol 放热
(3) 吸热 250(Q1+Q2)/a
25.(1)、K=C2(SO3)/[C2(SO2)·C(O2)]
(2)、增大 增大 减少
(3)、15min
(4) 、增大O2的浓度 b
26.析氢腐蚀 吸氧腐蚀 还原反应 Fe-2e-=Fe2+
27. (1)①酸 大于25.10
0.30 24.90 24.60
②甲基橙、酚酞
(2)
(3)无影响 偏低
28. (1)铜(或Cu);AgNO3溶液。
(2)正, Ag++e- = Ag; Cu-2e- = Cu (3)负(Cu);正(Ag)
29.(1)①2C1――2e- =C12↑(1分)②溶液变红色,产生无色气泡
电解
(2)4Ag+ + 2H2O ====== 4Ag + O2 +4H+
电解
2Cu2+ + 2H2O ====== 2Cu +O2↑+4H+ 2.1
(3)①铜(或纯铜) Cu2++2e-=Cu ②变小 (4)2mol
30.
(1)= >
(2)CO32-+H2O HCO3- +OH- 因石膏中的Ca2+与CO32-结合生成CaCO3沉淀,c(CO32-)减小,故碱性减弱。
(3)③⑤
(4)Fe3++3H2O Fe(OH)3+3H+
(5)1.0×10-12 1.0×10-2(每空2分)
ZnSO4
溶液
隔膜
(只允许SO42 -通过)
CuSO4
溶液
滤纸
(滴加了Na2SO4、酚酞溶液)
表面皿
Y
Zn
Cu
铜丝
X
物质的量(mol)
时间(min)
0
0.10
0.20
5
105
15
20
25
30
SO2
O2
SO3
盐桥
X
Y
A
CuSO4溶液
电流计
Ag
放电
充电
PAGE
1
同课章节目录
