第一电离能的周期性变化
图片预览







文档简介
课件20张PPT。第一电离能的周期性变化请同学们回忆一下:我们学过的元素主要性质有哪些?他们各有怎样的递变规律?1.金属性
2.非金属性
3.元素的主要化合价
4.原子半径
同一周期从左到右逐渐减弱
同一主族从上到下逐渐增强知识复习 同一周期从左到右逐渐增强
同一主族从上到下逐渐减弱同周期最高正价从+1价到+7 价 负价从-4到价同一周期从左到右逐渐减小
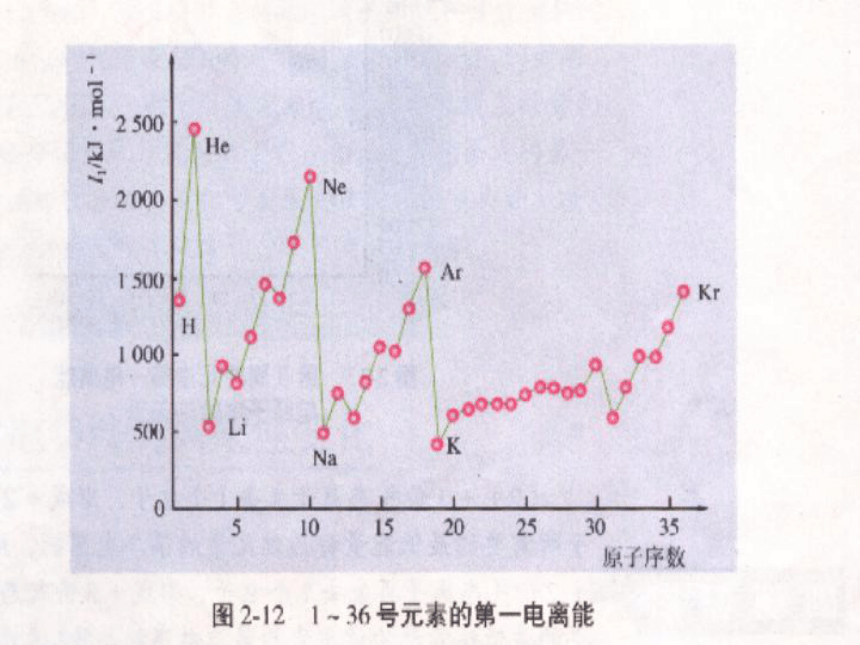
同一主族从上到下逐渐增大元素第一电离能 原子失去一个电子形成+1价 阳离子所需 能量。符号 单位 气态气态最低I1KJ·mol-1 概念应用1、已知M(g)-e- →M +(g)时所需最低能量为502KJ,则M元素的I1= . 2、已知Na元素的I1=496 KJ·mol-1,则Na (g) -e- →Na +(g) 时所需最低能量为 . 502 KJ·mol-1 496 KJ 问题探究一元素的第一电离能大小与原子失去电子能力有何关系?第一电离能越小,越易失去电子,金属性越强
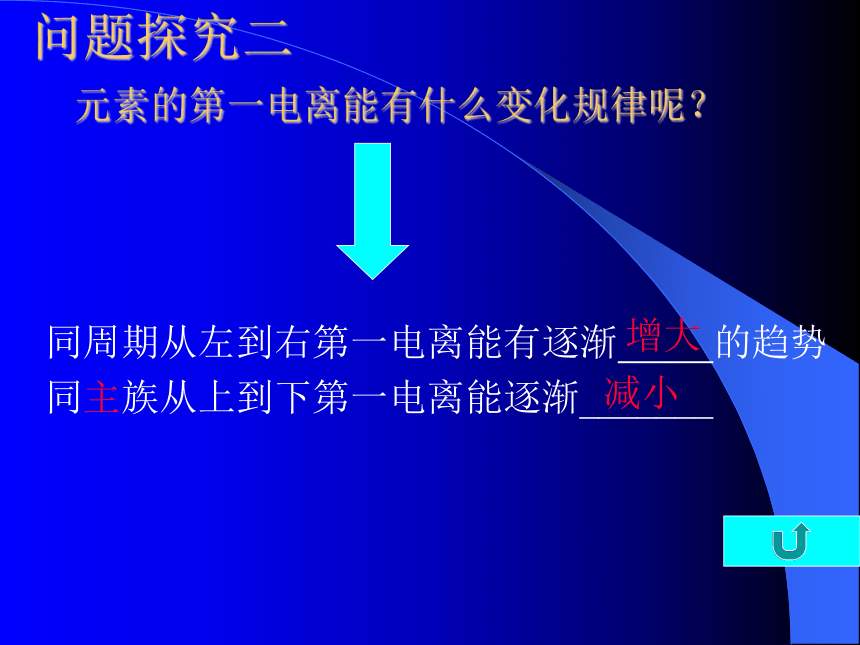
第一电离能越大,越难失去电子,金属性越弱问题探究二 元素的第一电离能有什么变化规律呢?同周期从左到右第一电离能有逐渐 的趋势
同主族从上到下第一电离能逐渐_______增大减小1.总体上金属元素第一电离能较小 非金属元素第一电离能较大。友情提示:比较金属元素、非金属元素
及稀有气体元素最外层电子数多少入手参考答案:金属元素最外层电子数较少,原子半径较大,较易失一个电子,因此第一电离能较小。非金属元素最外层电子数较多,原子半径较小,较难失一个电子,因此第一电离能较大。
稀有气体最外层电子排布 ns2np6,达稳定结构,难失电子,第一电离能大。
为什么?2、同周期元素第一电离能从左到右有增大的趋势,为什么?提示:从原子结构的变化来解释参考答案:同周期元素从左到右,随核电荷数增大,原子半径逐渐减小,原子核对核外电子的吸引力逐渐增大,原子失电子能力逐渐减小,第一电离能有逐渐增大的趋势。3、同主族元素第一电离能从上到下逐渐减小,为什么?提示:从原子结构的变化来解释
参考答案:同主族元素从上到下,随核电荷数增大,原子半径逐渐增大,原子核对核外电子的吸引力逐渐减小,原子失电子能力逐渐增大,第一电离能逐渐减小。
4、同一周期第一电离能最小的是碱金属元素,最大的是稀有气体元素。为什么?参考答案:碱金属元素核外电子排布为 ns1,同周期中(除稀有气体外)原子半径最大,易失去一个电子,形成稳定结构,因此第一电离能在同周期中最小。稀有气体最外层电子排布为ns2np6,已达稳定结构,难以失电子,因此第一电离能在同周期中最大。
提示:从他们的原子外围电子排布式和原子结构的特点思考。课堂练习1、下列说法中正确的是 ( )
A.同周期中Ⅶ A族元素的原子半径最大
B.Ⅵ A族元素的原子,半径越大,越易得到电子
C.室温时,零族元素的单质都是气体
D.同一周期中,碱金属元素的第一电离能最大C规律与总结总体上:金属元素第一电离能都 ,非金属元素和稀有气体元素的第一电离能都 。
在同一周期中第一电离能最小的是 元素最大的是 元素
较小 碱金属 稀有气体 较大2、判断下列元素间的第一电离能的大小
Na K N P
F Ne Cl S
Mg Al O N课堂练习>>>><<3、将下列元素按第一电离能由大到小的顺序排列
①K Na Li
②B C Be N
③He Ne Ar
④ Na Al S PLi >Na> KN> C >Be> BHe >Ne > Ar
P >S >Al> Na影响第一电离能的因素1、原子核对核外电子的引力
2、原子达到稳定结构的趋势拓展视野:根据第一电离能定义,你能说出什么是第二电离能、第三电离能吗?讨论后回答。气态电中性基态原子失去一个电子形成+1价气态阳离子所需最低能量叫第一电离能,用I1 表示。依次类推可得:从+1价气态 离子中再失去一个电子,形成+2价气态 离子所需要的最低能量叫第二电离能,用I2 表示‥‥‥
同一种元素的逐级电离能大小关系:
I1…… …… …… ……… 为什么?问题探究三观察分析下表电离能数据回答:
为什么钠易失去一个电子,镁易失去两个电子?
?
?
?
?
?
?
?
?
?
?
从表中数据可知钠元素的第二电离能远大于第一电离能,因此钠容易失去第一个电子而不易失去第二个电子;即Na易形成Na +而不易形成Na 2+ 。而Mg的第一第二电离能相差不大,第三电离能远大于第二电离能,因此镁易形成+2价镁离子。概念辨析1、每一周期元素中都是以碱金属开始,以稀有气体结束。
2、f区都是副族元素,s区p区都是主族元素
3、铝的第一电离能大于K的第一电离能
4、20℃时1moLNa失去1moL电子吸收650KJ能量,则Na的第一电离能为650 KJ·moL-1 错错对错总结元素金属性 同周期左→ 右减小
同主族上→ 下增强元素第一电离能 同周期左→ 右增大趋势(两处反常)
同主族上→ 下减小原子结构 原子核吸引电子的能力
原子形成稳定结构的趋势
2.非金属性
3.元素的主要化合价
4.原子半径
同一周期从左到右逐渐减弱
同一主族从上到下逐渐增强知识复习 同一周期从左到右逐渐增强
同一主族从上到下逐渐减弱同周期最高正价从+1价到+7 价 负价从-4到价同一周期从左到右逐渐减小
同一主族从上到下逐渐增大元素第一电离能 原子失去一个电子形成+1价 阳离子所需 能量。符号 单位 气态气态最低I1KJ·mol-1 概念应用1、已知M(g)-e- →M +(g)时所需最低能量为502KJ,则M元素的I1= . 2、已知Na元素的I1=496 KJ·mol-1,则Na (g) -e- →Na +(g) 时所需最低能量为 . 502 KJ·mol-1 496 KJ 问题探究一元素的第一电离能大小与原子失去电子能力有何关系?第一电离能越小,越易失去电子,金属性越强
第一电离能越大,越难失去电子,金属性越弱问题探究二 元素的第一电离能有什么变化规律呢?同周期从左到右第一电离能有逐渐 的趋势
同主族从上到下第一电离能逐渐_______增大减小1.总体上金属元素第一电离能较小 非金属元素第一电离能较大。友情提示:比较金属元素、非金属元素
及稀有气体元素最外层电子数多少入手参考答案:金属元素最外层电子数较少,原子半径较大,较易失一个电子,因此第一电离能较小。非金属元素最外层电子数较多,原子半径较小,较难失一个电子,因此第一电离能较大。
稀有气体最外层电子排布 ns2np6,达稳定结构,难失电子,第一电离能大。
为什么?2、同周期元素第一电离能从左到右有增大的趋势,为什么?提示:从原子结构的变化来解释参考答案:同周期元素从左到右,随核电荷数增大,原子半径逐渐减小,原子核对核外电子的吸引力逐渐增大,原子失电子能力逐渐减小,第一电离能有逐渐增大的趋势。3、同主族元素第一电离能从上到下逐渐减小,为什么?提示:从原子结构的变化来解释
参考答案:同主族元素从上到下,随核电荷数增大,原子半径逐渐增大,原子核对核外电子的吸引力逐渐减小,原子失电子能力逐渐增大,第一电离能逐渐减小。
4、同一周期第一电离能最小的是碱金属元素,最大的是稀有气体元素。为什么?参考答案:碱金属元素核外电子排布为 ns1,同周期中(除稀有气体外)原子半径最大,易失去一个电子,形成稳定结构,因此第一电离能在同周期中最小。稀有气体最外层电子排布为ns2np6,已达稳定结构,难以失电子,因此第一电离能在同周期中最大。
提示:从他们的原子外围电子排布式和原子结构的特点思考。课堂练习1、下列说法中正确的是 ( )
A.同周期中Ⅶ A族元素的原子半径最大
B.Ⅵ A族元素的原子,半径越大,越易得到电子
C.室温时,零族元素的单质都是气体
D.同一周期中,碱金属元素的第一电离能最大C规律与总结总体上:金属元素第一电离能都 ,非金属元素和稀有气体元素的第一电离能都 。
在同一周期中第一电离能最小的是 元素最大的是 元素
较小 碱金属 稀有气体 较大2、判断下列元素间的第一电离能的大小
Na K N P
F Ne Cl S
Mg Al O N课堂练习>>>><<3、将下列元素按第一电离能由大到小的顺序排列
①K Na Li
②B C Be N
③He Ne Ar
④ Na Al S PLi >Na> KN> C >Be> BHe >Ne > Ar
P >S >Al> Na影响第一电离能的因素1、原子核对核外电子的引力
2、原子达到稳定结构的趋势拓展视野:根据第一电离能定义,你能说出什么是第二电离能、第三电离能吗?讨论后回答。气态电中性基态原子失去一个电子形成+1价气态阳离子所需最低能量叫第一电离能,用I1 表示。依次类推可得:从+1价气态 离子中再失去一个电子,形成+2价气态 离子所需要的最低能量叫第二电离能,用I2 表示‥‥‥
同一种元素的逐级电离能大小关系:
I1
为什么钠易失去一个电子,镁易失去两个电子?
?
?
?
?
?
?
?
?
?
?
从表中数据可知钠元素的第二电离能远大于第一电离能,因此钠容易失去第一个电子而不易失去第二个电子;即Na易形成Na +而不易形成Na 2+ 。而Mg的第一第二电离能相差不大,第三电离能远大于第二电离能,因此镁易形成+2价镁离子。概念辨析1、每一周期元素中都是以碱金属开始,以稀有气体结束。
2、f区都是副族元素,s区p区都是主族元素
3、铝的第一电离能大于K的第一电离能
4、20℃时1moLNa失去1moL电子吸收650KJ能量,则Na的第一电离能为650 KJ·moL-1 错错对错总结元素金属性 同周期左→ 右减小
同主族上→ 下增强元素第一电离能 同周期左→ 右增大趋势(两处反常)
同主族上→ 下减小原子结构 原子核吸引电子的能力
原子形成稳定结构的趋势
