必修2第二章第一节化学能与热能(广东省深圳市)
文档属性
| 名称 | 必修2第二章第一节化学能与热能(广东省深圳市) |  | |
| 格式 | rar | ||
| 文件大小 | 2.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2008-06-22 08:36:00 | ||
图片预览


文档简介
课件27张PPT。第一节 化学能与热能 生活中哪些事实说明了在化学反应中伴随着能量的变化? 煤、石油、天然
气等可燃物质燃烧
时释放热量
烟花燃放、石灰溶于水时释放热量
石灰石分解需要
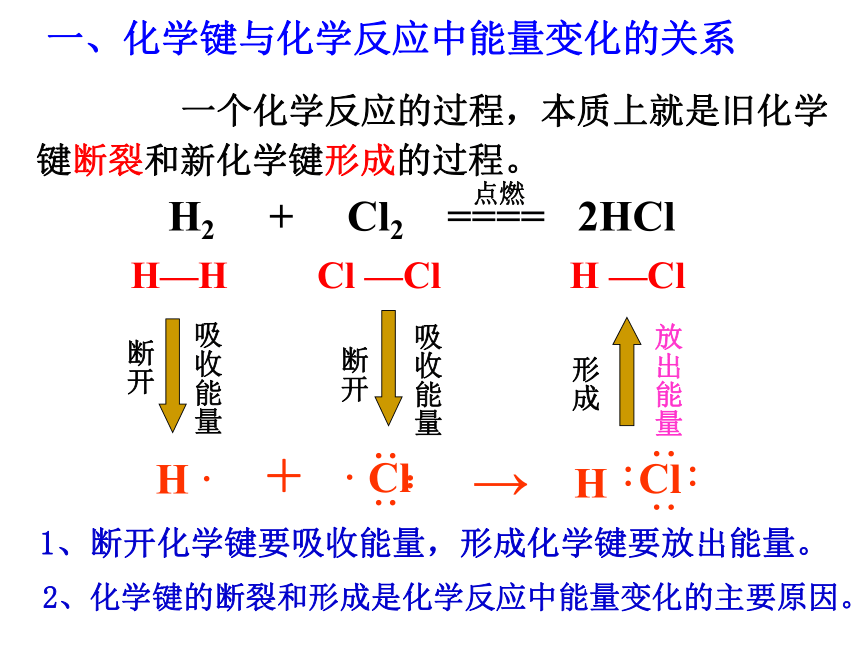
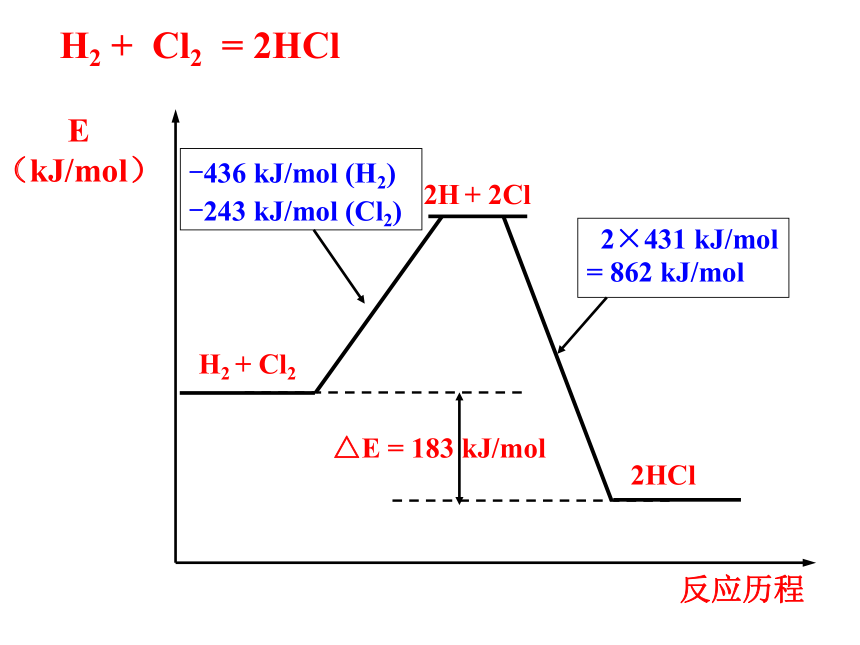
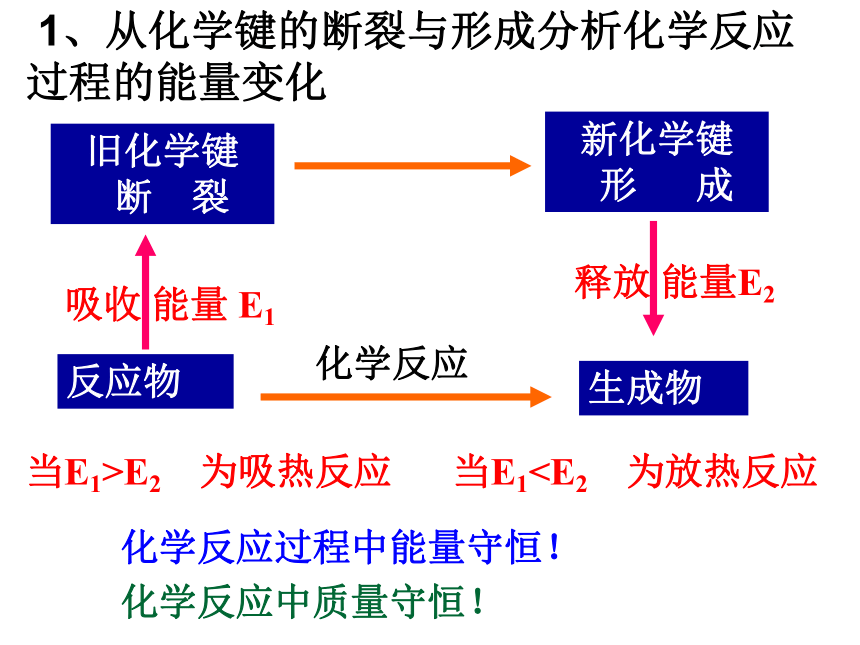
加热到高温。 从化学键的变化,如何理解化学反应中的能量变化?一、化学键与化学反应中能量变化的关系1、断开化学键要吸收能量,形成化学键要放出能量。2、化学键的断裂和形成是化学反应中能量变化的主要原因。 一个化学反应的过程,本质上就是旧化学键断裂和新化学键形成的过程。-436 kJ/mol (H2)
-243 kJ/mol (Cl2) 2×431 kJ/mol
= 862 kJ/molH2 + Cl2 = 2HCl释放能量化学能与化学反应中能量变化的关系 电能转化为机械能
再转化为势能旧化学键
断 裂新化学键
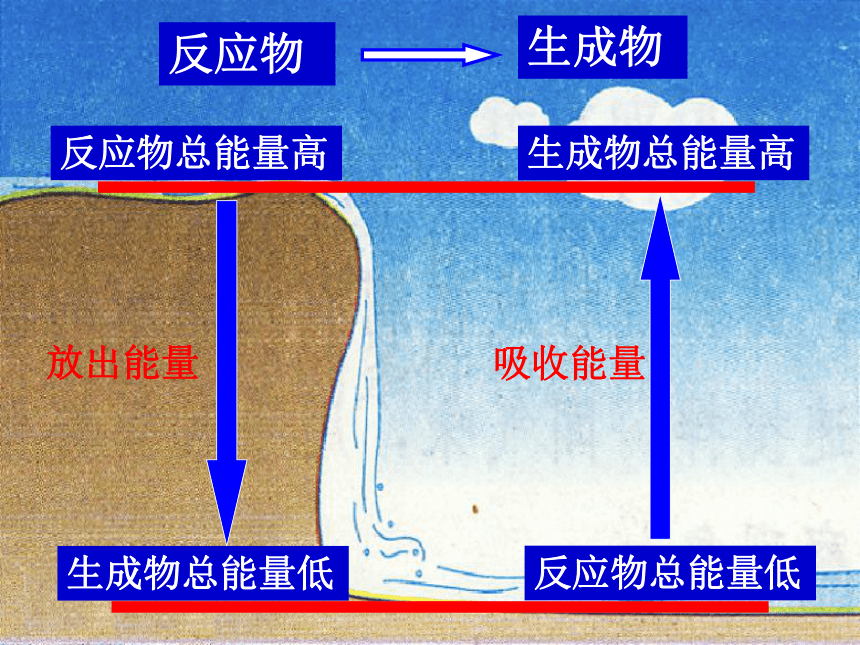
形 成吸收 能量 E1释放 能量E2当E1>E2 为吸热反应当E1中的能量变化化学变化的特征: 化学变化中除有新物质生成外,常伴随着能量的变化。利用化学反应:一 、制取新物质;
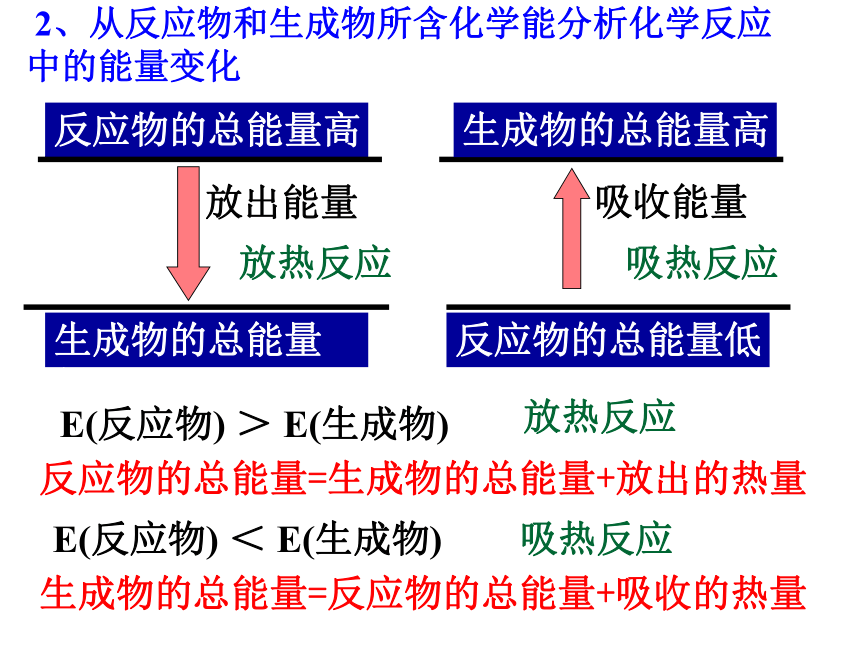
二 、利用反应中的能量. 2、若反应物的总能量>生成物的总能量,化学反应过程 能量,该反应是 反应。若反应物的总能量<生成物的总能量,化学反应过程 能量,该反应是_____反应。放出吸收 1、在化学反应中,断开反应物中的化学键要
能量;而形成生成物中的化学键要 能量。一个化学反应是释放能量还是吸收能量取决于 。吸收放出反应物总能量与生成物总能量的相对大小 练习:放热吸热 3、已知反应A+B=C+D为放热反应,对该反应的下列说法中正确的是( )
A、A的能量一定高于C
B、B的能量一定高于D
C、A和B的总能量一定高于C和D的总能量
D、该反应为放热反应,故不必加热就一定能发生 4、氢气在氧气中燃烧放热,反应中,破坏1mol H-H键消耗的能量为Q1 kJ,破坏1mol O=O键消耗的能量为Q2 kJ,形成1mol H-O键释放的能量为Q3 kJ。下列关系式中正确的是( )
A、2Q1+Q2>4Q3 B、2Q1+Q2<4Q3
C、Q1+Q2 A实验1、测量铝跟盐酸反应中的能量变化 P33
1)化学方程式:
2)现象:
3)了解反应中能量变化的方法:
4)结论:2 Al + 6 HCl = 2 AlCl3 + 3 H2↑产生无色无味气体,溶液温度升高。用手触摸试管外壁;用温度计测量铝与盐酸反应放热二、化学能与热能的转化实验2、测量Ba(OH)2·8H2O与NH4Cl反应中的能量变化有刺激性气味的气体产生有NH3生成烧杯变冷反应吸热烧杯下带有水滴的玻璃片粘到烧杯底部反应吸收热量使体系温度降低,使水结成冰混合物成糊状有水生成Ba(OH)2 ·8 H2O + 2 NH4Cl
= BaCl2+2 NH3↑+10 H2O实验3、
测量盐酸与NaOH溶液反应中的能量变化反应物用量:
反应前温度:
反应后温度:
结论:
离子方程式:HCl : 20 mL 2 mol / L
NaOH :20 mL 2 mol / LHCl : NaOH : .
. HCl与NaOH发生中和反应时放热H+ + OH- = H2O 3、中和热:酸与碱发生中和反应生成1mol
H2O时所释放的热量。思考 在设计实验装置和操作时应该注意
哪些问题?(1)用隔热装置,尽量减少热量散失;(2)酸碱的量要准确:n=C×Va、浓度要越精确越好
b、量体积的容器越精确越好,最好用移液管(3)温度计越精确越好(4)注意控制反应时间(5)多做几次,取平均值中和热的测定 装置 在大烧杯底部垫泡沫塑料
(或纸条),使放入的小烧杯
杯口与大烧杯杯口相平。然后
再在大、小烧杯之间填满碎泡
沫塑料(或纸条),大烧杯上
用泡沫塑料板(或硬纸板)作
盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过,以达到保温、隔热、减少实验过程中热量损失的目的,如上图所示。该实验也可在保温杯中进行。 总结放热反应物质与氧气的反应
燃料的燃烧
中和反应
金属与酸
活泼金属与水的反应
生石灰和水反应
大部分化合反应 吸热反应C+CO2
C+H2O
H2+CuO
Ba(OH)2·8H2O+NH4Cl
Fe+H2O(g)
大部分分解反应放热反应:有热量放出的化学反应
吸热反应:有热量吸收的化学反应 注意:有些放热反应开始时需要加热启动,但不需持续加热;而有些吸热反应可以自发进行,但大多数需持续加热。化学能与其它能量能否相互转化呢?三、生物体中的能量转化: 1、通过生物体的作用可以实现各种能量的相互转化; 2、通过生物体的作用实现的各种能量的相互转化和利用更为合理、有效;柴草时期化石能源时期多能源结构时期四、社会的发展与能源的利用:1、人对科学知识的掌握越多,对能源的利用(人均耗能)越多;2、人类利用能源的三个时期:3、能源的分类:一次能源、二次能源1、下列说法正确的是( )
A、需要加热才能发生的反应一定是吸热反应
B、加热的反应在常温下就一定能进行
C、反应是放热还是吸热是由反应物和生成
物所具有的总能量的相对大小决定的
D、吸热反应在常温下也能进行
C、D练习:2、下列说法中正确的是( )
A.物质发生化学反应都伴随着能量变化.
B.伴有能量变化的物质变化都是化学变化.
C.在一个确定的化学关系中,反应物的总能量与生成物的总能量一定不同.
D.在一个确定的化学关系中,反应物的总能量总是高于生成物的总能量.
3、下列变化中属于吸热反应的是( )
A. 液态水汽化 B.高温锻烧石灰石
C. 浓H2SO4稀释 D. KClO3分解制O2
E. 生石灰与水反应生成熟石灰
ACBD 4、在反应H2 + Cl2 = 2HCl中,已知破坏H-H需要的能量为 436kJ/mol,破坏Cl-Cl需要的能量为247kJ/mol,形成H-Cl需要的能量为431kJ/mol,判断该反应是( )
A. 吸热反应 B. 放热反应
C. 吸收179kJ热量 D.放出179kJ热量BD5、如右图所示,把试管放入盛有25℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中.试回答下列问题:
(1)实验中观察到的现象是
(2)产生上述现象的原因是
(3)写出有关反应的离子方程式
(4)由实验推知,MgCl2溶液和H2的总能量 (填“大于”、“小于”、“等于”)镁片和盐酸的总能量.
①镁片上有大量气泡产生;②镁片逐渐溶解; ③烧杯中析出晶体。 ①镁与盐酸反应产生氢气,该反应为放热反应,Ca(OH)2在水中的溶解度随温度升高而减小,故析出Ca(OH)2晶体。Mg + 2H+ = Mg2+ + H2↑ 小于 6.已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ,且氧气中1 mol O=O键完全断裂时吸收热量496 kJ,水蒸气中1 mol H—O键形成时放出热量463 kJ,则氢气中1 mol
H—H键断裂时吸收热量为 ( )
(A)920 kJ (B)557 kJ (C)436 kJ (D)188 kJ
C7.下列各组中的两个反应,前一个反应放出的热量比后一个反应放出的热量多的是(反应物参与反应的物质的量均按化学方程中的化学计量数计算) ( )
① 2H2(g)+ O2 (g) = 2H2O(g) 2H2 (g)+ O2 (g) = 2H2O(l)
② C(s)+ O2 (g) = CO2 (g) C(s)+ O2 (g) = CO(g)
A、只有① B、只有② C、①② D、①②都不符合题意B
气等可燃物质燃烧
时释放热量
烟花燃放、石灰溶于水时释放热量
石灰石分解需要
加热到高温。 从化学键的变化,如何理解化学反应中的能量变化?一、化学键与化学反应中能量变化的关系1、断开化学键要吸收能量,形成化学键要放出能量。2、化学键的断裂和形成是化学反应中能量变化的主要原因。 一个化学反应的过程,本质上就是旧化学键断裂和新化学键形成的过程。-436 kJ/mol (H2)
-243 kJ/mol (Cl2) 2×431 kJ/mol
= 862 kJ/molH2 + Cl2 = 2HCl释放能量化学能与化学反应中能量变化的关系 电能转化为机械能
再转化为势能旧化学键
断 裂新化学键
形 成吸收 能量 E1释放 能量E2当E1>E2 为吸热反应当E1
二 、利用反应中的能量. 2、若反应物的总能量>生成物的总能量,化学反应过程 能量,该反应是 反应。若反应物的总能量<生成物的总能量,化学反应过程 能量,该反应是_____反应。放出吸收 1、在化学反应中,断开反应物中的化学键要
能量;而形成生成物中的化学键要 能量。一个化学反应是释放能量还是吸收能量取决于 。吸收放出反应物总能量与生成物总能量的相对大小 练习:放热吸热 3、已知反应A+B=C+D为放热反应,对该反应的下列说法中正确的是( )
A、A的能量一定高于C
B、B的能量一定高于D
C、A和B的总能量一定高于C和D的总能量
D、该反应为放热反应,故不必加热就一定能发生 4、氢气在氧气中燃烧放热,反应中,破坏1mol H-H键消耗的能量为Q1 kJ,破坏1mol O=O键消耗的能量为Q2 kJ,形成1mol H-O键释放的能量为Q3 kJ。下列关系式中正确的是( )
A、2Q1+Q2>4Q3 B、2Q1+Q2<4Q3
C、Q1+Q2
1)化学方程式:
2)现象:
3)了解反应中能量变化的方法:
4)结论:2 Al + 6 HCl = 2 AlCl3 + 3 H2↑产生无色无味气体,溶液温度升高。用手触摸试管外壁;用温度计测量铝与盐酸反应放热二、化学能与热能的转化实验2、测量Ba(OH)2·8H2O与NH4Cl反应中的能量变化有刺激性气味的气体产生有NH3生成烧杯变冷反应吸热烧杯下带有水滴的玻璃片粘到烧杯底部反应吸收热量使体系温度降低,使水结成冰混合物成糊状有水生成Ba(OH)2 ·8 H2O + 2 NH4Cl
= BaCl2+2 NH3↑+10 H2O实验3、
测量盐酸与NaOH溶液反应中的能量变化反应物用量:
反应前温度:
反应后温度:
结论:
离子方程式:HCl : 20 mL 2 mol / L
NaOH :20 mL 2 mol / LHCl : NaOH : .
. HCl与NaOH发生中和反应时放热H+ + OH- = H2O 3、中和热:酸与碱发生中和反应生成1mol
H2O时所释放的热量。思考 在设计实验装置和操作时应该注意
哪些问题?(1)用隔热装置,尽量减少热量散失;(2)酸碱的量要准确:n=C×Va、浓度要越精确越好
b、量体积的容器越精确越好,最好用移液管(3)温度计越精确越好(4)注意控制反应时间(5)多做几次,取平均值中和热的测定 装置 在大烧杯底部垫泡沫塑料
(或纸条),使放入的小烧杯
杯口与大烧杯杯口相平。然后
再在大、小烧杯之间填满碎泡
沫塑料(或纸条),大烧杯上
用泡沫塑料板(或硬纸板)作
盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过,以达到保温、隔热、减少实验过程中热量损失的目的,如上图所示。该实验也可在保温杯中进行。 总结放热反应物质与氧气的反应
燃料的燃烧
中和反应
金属与酸
活泼金属与水的反应
生石灰和水反应
大部分化合反应 吸热反应C+CO2
C+H2O
H2+CuO
Ba(OH)2·8H2O+NH4Cl
Fe+H2O(g)
大部分分解反应放热反应:有热量放出的化学反应
吸热反应:有热量吸收的化学反应 注意:有些放热反应开始时需要加热启动,但不需持续加热;而有些吸热反应可以自发进行,但大多数需持续加热。化学能与其它能量能否相互转化呢?三、生物体中的能量转化: 1、通过生物体的作用可以实现各种能量的相互转化; 2、通过生物体的作用实现的各种能量的相互转化和利用更为合理、有效;柴草时期化石能源时期多能源结构时期四、社会的发展与能源的利用:1、人对科学知识的掌握越多,对能源的利用(人均耗能)越多;2、人类利用能源的三个时期:3、能源的分类:一次能源、二次能源1、下列说法正确的是( )
A、需要加热才能发生的反应一定是吸热反应
B、加热的反应在常温下就一定能进行
C、反应是放热还是吸热是由反应物和生成
物所具有的总能量的相对大小决定的
D、吸热反应在常温下也能进行
C、D练习:2、下列说法中正确的是( )
A.物质发生化学反应都伴随着能量变化.
B.伴有能量变化的物质变化都是化学变化.
C.在一个确定的化学关系中,反应物的总能量与生成物的总能量一定不同.
D.在一个确定的化学关系中,反应物的总能量总是高于生成物的总能量.
3、下列变化中属于吸热反应的是( )
A. 液态水汽化 B.高温锻烧石灰石
C. 浓H2SO4稀释 D. KClO3分解制O2
E. 生石灰与水反应生成熟石灰
ACBD 4、在反应H2 + Cl2 = 2HCl中,已知破坏H-H需要的能量为 436kJ/mol,破坏Cl-Cl需要的能量为247kJ/mol,形成H-Cl需要的能量为431kJ/mol,判断该反应是( )
A. 吸热反应 B. 放热反应
C. 吸收179kJ热量 D.放出179kJ热量BD5、如右图所示,把试管放入盛有25℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中.试回答下列问题:
(1)实验中观察到的现象是
(2)产生上述现象的原因是
(3)写出有关反应的离子方程式
(4)由实验推知,MgCl2溶液和H2的总能量 (填“大于”、“小于”、“等于”)镁片和盐酸的总能量.
①镁片上有大量气泡产生;②镁片逐渐溶解; ③烧杯中析出晶体。 ①镁与盐酸反应产生氢气,该反应为放热反应,Ca(OH)2在水中的溶解度随温度升高而减小,故析出Ca(OH)2晶体。Mg + 2H+ = Mg2+ + H2↑ 小于 6.已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ,且氧气中1 mol O=O键完全断裂时吸收热量496 kJ,水蒸气中1 mol H—O键形成时放出热量463 kJ,则氢气中1 mol
H—H键断裂时吸收热量为 ( )
(A)920 kJ (B)557 kJ (C)436 kJ (D)188 kJ
C7.下列各组中的两个反应,前一个反应放出的热量比后一个反应放出的热量多的是(反应物参与反应的物质的量均按化学方程中的化学计量数计算) ( )
① 2H2(g)+ O2 (g) = 2H2O(g) 2H2 (g)+ O2 (g) = 2H2O(l)
② C(s)+ O2 (g) = CO2 (g) C(s)+ O2 (g) = CO(g)
A、只有① B、只有② C、①② D、①②都不符合题意B
