2008届初中毕业班中考化学考前辅导
图片预览



文档简介
2008届初中毕业班中考化学考前辅导
1.化学研究的对象:物质的组成与结构、物质的性质与变化、物质的用途与制法。
物理变化与化学变化的区别:看是否有新物质生成。
物理性质与化学性质的区别:
例:下列生活中常见的现象,属于于化学变化的是:( A )
A.鞭炮齐鸣 B.冰雪消融 C. 水滴石穿 D.花香四溢
物理性质:颜色、气味、状态、密度、溶解性、硬度、导电性、导热性、延展性等;
化学性质:可燃性、氧化性、还原性、稳定性、酸性、碱性等。
例:下列生活中的一些作法,主要利用化学性质的是 ( C )
A.不锈钢制炊具 B.活性炭除去冰箱中的异味 C.米酿成醋 D.榨取果汁
2.物质的用途:(知道常见物质的用途;探究食品中的填充气)氧气:供给呼吸,支持燃烧;
一氧化碳:冶炼金属,做燃料;二氧化碳:用于灭火,提供植物光合作用的原料,干冰用于人工降雨,舞台烟雾;石灰石:用作建筑材料; 氢氧化钠:制造肥和造纸,中和石油产品中的硫酸; 氮气和稀有气体:用作保护气; 碳酸钠:做洗涤剂,发酵面粉; 氢氧化钙:做石灰桨,中和酸性土壤,配制农药波尔多液; 食盐:作调味剂、腌制蔬菜,配制生理盐水;盐酸:金属除锈;
例:写出下列有关物质的化学式
(1)抢救病人时用呼吸机输入的气体单质是 O2
(2)天安门前的华表的主要成分是 CaCO3
(3)海水中含量最多的一种氧化物是 H2O
(4)常用来除去金属表面的锈的是 HCl
(5)人体的胃液中含有的一种有助于消化的酸是 HCl
(6)生理盐水中的溶质是 NaCl (7)最简单的有机物是 CH4
例:物质的有关用途:①作调味剂 ②制造肥和造纸 ③作电极 ④改良酸性土壤 ⑤除去面团发酵时生成的酸 ⑥填充气球 ⑦配制农药“波尔多液” ⑧复合肥料
请将上述用途的序号填入下列相应物质后面的横线上:
(1)石墨 ③ (2)硫酸铜 ⑦ (3)氯化钠 ① (4)烧碱 ②
(5)氢气 ⑥ (6)纯碱 ⑤ (7)消石灰 ④ 、 ⑦ (8)硝酸钾 ⑧
例:现有:a.盐酸 b.浓硫酸 c.熟石灰 d.纯碱 e.氮气 f.甲烷 等六种物质,请用编号回答下列问题: ①有时家庭做馒头会用到的物质是 d 。 ②能用来做某些气体的干燥剂是 b 。③天然气的主要成分 f 、造成矿井瓦斯爆炸的是 f 。④能用于改良酸性土壤的是 c 。能用作食品保护气的是 e 。
⑥能用于金属除锈的是 a 。
3.化学与环境污染:水污染、空气污染、固体废弃物污染。(污染的原因、污染物、危害,防护措施)
①空气:了解空气污染的原因(SO2、NOx、CO、可吸入颗粒物);知道如何防止空气的污染;知道如何防止酸雨的形成;知道如何防止温室效应的产生;掌握用红磷测定空气中氧气体积分数的实验(包括:方程式、现象、原理、实验目的及吸入水的体积小于五分之一的原因)。
②水:水的净化过程(了解明矾、活性炭、液氯的作用);了解乳化的原理(由不稳定的乳浊液变成均匀、稳定的乳浊液);了解水污染 途径及防治方法;能对节约用水提一些合理化的建议。
③知道白色污染的原因及防治;垃圾分类:可回收垃圾、不可回收垃圾、有害垃圾。
例:保护环境,防止空气和水体的污染是每个公民应尽的职责,下列做法中,有利于环境保护的是( D )
①控制工业生产中废气和废水的直接排放;②增大绿地面积;③开发生产无汞电池;④分类回收垃圾⑤生活污水处理后排放;⑥禁止含磷洗涤剂的使用;⑦合理使用农药和化肥;⑧在水库周边兴建造纸厂
A.全部 B.②④⑥⑧ C.①②③④⑦⑧ D.①②③④⑤⑥⑦
4.化学实验基本操作(画图或文字叙述)及实验安全事故的处理:
例:下列各图是初中化学常见的几个实验操作,其中错误的是
5.安全问题、逃生:食品安全、可燃性物质不能与氧气和明火同时接触,会发生爆炸;火灾的逃生方法。
6.化学与能源的利用与开发及燃料的选择:(包括:氢能、化学反应能量的转化、能源与环境的关系) 三大矿石燃料:煤、石油、天然气
(1)了解能源的分类及种类,知道最理想的能源是氢能源;知道节能的方法;充分燃烧的条件及优点。
(2)绿色能源:无污染的能源。
能量转化的形式:太阳能 光能或电能或化学能,
化学能 光能或电能或热能 电能 化学能
例:化学能转化为电能的例子:干电池放电 化学能转化为热能的例子:燃料燃烧
7.物质的变化、组成、分类
(1)化学变化的依据、特征
(2)物质的组成:元素组成 例如:水是由氢、氧两种元素组成的。
(3)简单分类:混合物、纯净物、单质、化合物、有机物(含碳的化合物,除:CO、CO2、H2CO3、CaCO3等外)、无机物、氧化物、酸、碱、盐
8.燃烧的条件和灭火的原理:
知道燃烧的三个条件(①物质具有可燃性;②可燃物要与氧气接触;③可燃物的温度达到着火点以上)及灭火的方法和原理,火灾现场要学会自救,在易燃易爆场所要严禁烟火,禁止穿化纤衣服,穿带铁钉的鞋子。
9.构成物质的三种粒子:(分子、原子、离子)
微粒的特征:微粒很小、微粒总是不断运动、微粒之间有空隙、同种微粒的性质相同。
(1)分子的特征 (2)构成原子的粒子(质子、中子、电子)
(3)掌握常见离子的书写:(K+ Na+ H+ CO32— SO42— Cl— NO3— OH—)
(4)有关物质构成的说法:如:氯化钠是由钠离子和氯离子构成的。
例:秋冬干燥易给人带来不适,医生建议在室内放盆热水可以增加空气的湿度。这种方法说明( D )A.分子很小 B.分子之间有间隔 C.分子是可分的 D.分子在不断运动
10.化学与生活、材料:(蒸馏水与矿泉水的区别方法[蒸发后是否有固体物质剩余];硬水与软水的鉴别方法 [加肥皂水并搅拌] ; 知道硬水软化的方法;粗盐的提纯[步骤:溶解、过滤、蒸发结晶];材料的分类及会判断材料所属的类别;记住塑料、橡胶、纤维都是有机高分子材料;会鉴别聚乙烯塑料和聚氯乙烯塑料[课本P238:灼烧后闻气味];会鉴别天然纤维(羊毛、棉)和化纤类(尼龙、涤纶等[课本P237:灼烧后闻气味] ;了解化学与生活的关系的例子:如:食醋除水垢、洗洁精去油污、净水可加明矾等。)
例:下列广告用语从化学角度看,没有科学性错误的是( D )
A.“霸王”牌厕所清洁剂,能清除所有污秽 B.“雪山牌”矿泉水,真正的纯水
C.“大自然”牌茶叶,真正的“绿色”饮品,天然种植,不含任何元素 D.吸烟有害健康
例:下列生活中的常见材料,属于有机合成高分子材料的是( C )
A.钢筋混凝土 B.陶瓷 C.塑料 D.钢铁
例:农村有句谚语“雷雨发庄稼”,这是由于在放电的条件下,空气中的氧气和氮气化合生成了氮的氧化物,氮的氧化物再经过各种复杂的化学变化,最后生成了易被农作物吸收的硝酸盐。可以说,雷雨给庄稼施加了( C ) A.钾肥 B.磷肥 C.氮肥 D.复合肥
例:学习和生活中常存在许多认识上的误区,学好化学可以帮助人们辨认清楚,如干冰不是冰,是二氧化碳;白金不是金,是金属铂。请问类似的化学知识你还知道哪些?试举出二例: 水银不是银,是金属汞 、 纯碱(碳酸钠)不是碱,是盐 。
11.有关化学式的说法判断:
例:毒品严重危害人类社会。冰毒的化学式为C10H15N,有关冰毒的叙述正确的是(A)
A.不完全燃烧时会生成CO B.完全燃烧时的生成物只有两种
C.C、H、N三种元素中质量分数最高的是H元素 D.C、H、N元素的质量比为10:15:1
12.化合价的计算、化学式是否正确的判断:
★会判断元素的化合价,会写化学式
名称 正确 错误 名称 正确 错误
碳酸钠 Na2CO3 NaCO3 氯化钙 CaCl2 CaCl
氢氧化钠 NaOH Na(OH) 硫酸 H2SO4 SO4
氯气 Cl2 Cl 氧化铝 Al2O3 AlO
氨气 NH3 NH4 铵根离子 NH4+ NH3
注意区别:高锰酸钾 KMnO4 锰酸钾K2MnO4
硫酸亚铁 FeSO4 硫酸铁Fe2(SO4)3
13.化学反应的基本类型(化合反应、分解反应、复分解反应、置换反应)及金属活动性顺序表的应用(能利用金属与酸或与可溶性盐反应的条件来探究金属的活动性顺序)
(1)置换反应:金属+酸
金属活动性顺序表的应用
金属+盐溶液
K Ca Na Mg Al | Zn Fe Sn Pb (H) | Cu Hg Ag Pt Au
金属活动性由强到弱
①金属(H前) + 酸(HCl或H2SO4)→ 盐 + 氢气
②金属(活动性靠前)+ 盐(可溶于水)→ 新盐 + 新金属(活动性靠后)
(2)复分解反应的条件:生成物中有沉淀、气体或水生成
例:现有a、b、c三种金属,将a、b分别放入稀硫酸、c的硝酸盐溶液中,现象如下表所示:
a b
在稀硫酸中 无反应 溶解并放出气体
在c的硝酸盐溶液中 无反应 无反应
则这三种金属的活动性由强到弱的顺序为 ( B )
A. a、b、c B. c、b、a C. b、a、c D. a、c、b
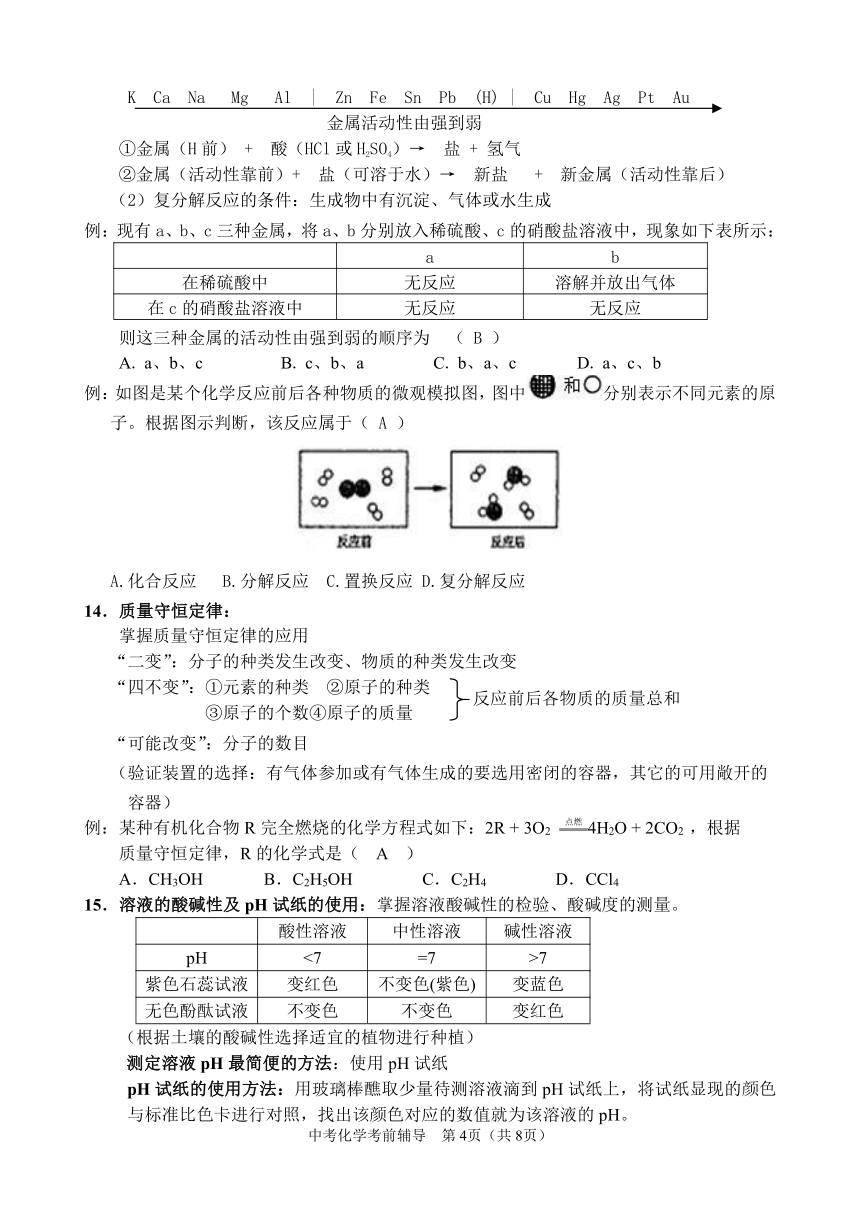
例:如图是某个化学反应前后各种物质的微观模拟图,图中分别表示不同元素的原子。根据图示判断,该反应属于( A )
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
14.质量守恒定律:
掌握质量守恒定律的应用
“二变”:分子的种类发生改变、物质的种类发生改变
“四不变”:①元素的种类 ②原子的种类
③原子的个数④原子的质量
“可能改变”:分子的数目
(验证装置的选择:有气体参加或有气体生成的要选用密闭的容器,其它的可用敞开的容器)
例:某种有机化合物R完全燃烧的化学方程式如下:2R + 3O2 点燃 4H2O + 2CO2 ,根据
质量守恒定律,R的化学式是( A )
A.CH3OH B.C2H5OH C.C2H4 D.CCl4
15.溶液的酸碱性及pH试纸的使用:掌握溶液酸碱性的检验、酸碱度的测量。
酸性溶液 中性溶液 碱性溶液
pH <7 =7 >7
紫色石蕊试液 变红色 不变色(紫色) 变蓝色
无色酚酞试液 不变色 不变色 变红色
(根据土壤的酸碱性选择适宜的植物进行种植)
测定溶液pH最简便的方法:使用pH试纸
pH试纸的使用方法:用玻璃棒醮取少量待测溶液滴到pH试纸上,将试纸显现的颜色与标准比色卡进行对照,找出该颜色对应的数值就为该溶液的pH。
例:常见食物pH的近似值范围如下:
常见食物 橘子汁 泡菜 酸牛奶 鸡蛋清
pH(近似值) 3.0~4.0 3.2~3.6 6.3~6.6 7.6~8.0
下列说法中,不正确的是( B )
A.鸡蛋清显碱性 B.胃酸过多的人应少吃泡菜
C.橘子汁能使石蕊溶液变红 D.酸牛奶比橘子汁的酸性强
16.溶液的判断和溶液的性质:如:泥土与水能否形成溶液?
溶液的性质:(1)少量固体物质溶于水,使稀溶液的凝固点降低、沸点升高;
(2)酸碱盐的水溶液具有导电性;
(3)物质溶于水时常有能量变化:使水温升高的物质有:氢氧化钠、浓硫酸、氧化钙;使水温降低的物质:硝酸铵等;变化不明显的有:氯化钠、蔗糖等。
17.实验图像(溶解度曲线及其应用、pH曲线)
例:右图为A、B、C三种物质的溶解度曲线。
(1)0℃时,A的溶解度是 20 g。
(2)在 t2 ℃时, A、B两物质的溶解度相等。
(3)把A、B、C的饱和溶液从t2℃降至t1℃时,没有晶
体析出的是 C 。
例:向盛有10mL氢氧化钠溶液的烧杯中逐滴滴加稀盐酸,下列图像能体现溶液的pH变化情况的是
pH pH pH pH
7 7 7 7
稀盐酸的体积 稀盐酸的体积 稀盐酸的体积 稀盐酸的体积
A B C D
18.溶解、过滤、蒸发的操作及所需的仪器:
所需的仪器:溶解:烧杯、玻璃棒;
过滤:烧杯、玻璃棒、漏斗、铁架台;
蒸发:玻璃棒、蒸发皿、铁架台、酒精灯;
加速物质溶解的措施:搅拌、加热、把固体研成粉末。
例:从某些盐湖中捞出的氯化钠晶体中含有碳酸钠,为除去碳酸钠得到纯净的氯化钠晶体可采用的方法是( C )
A.溶解、过滤、蒸发 B.溶解后加入适量的硫酸溶液、蒸发
C.溶解后加入适量的稀盐酸,蒸发 D.加入适量的石灰水,蒸发
19.化学物质与人体健康:
(1)了解钙、铁、锌、碘等元素,维生素对人体健康的重要作用
(2)六大营养素:糖类、油脂、蛋白质、维生素、矿物质、水(了解它们对人体的作用)
(3)有毒物质:CO、工业盐(亚硝酸钠NaNO2)、工业酒精中的杂质甲醇、甲醛、重金属盐、黄曲霉毒素
(4)能举出富含糖类、蛋白质、油脂、维生素的食品;掌握淀粉[加碘水或碘酒,显蓝色,则含有淀粉]、葡萄糖的检验;知道蛋白质的变性([课本P221-P222]浓硝酸、重金属盐、甲醛溶液、加热);知道重金属盐、甲醛溶液对人体有毒及重金属盐中毒的解毒方法。
例:某校食堂中餐食谱如下:
主食:大米饭
配菜:红烧排骨 煎鸡蛋 炸鸡腿 豆腐汤 炒猪肝
主食和配菜中主要含维生素、 、 、 、无机盐和水等营养素,考虑到各种营养成分的均衡搭配,应该增加的配菜是_____________。
答案:糖类;蛋白质;油脂;蔬菜
20.化学方程式的书写:
★中考常考化学方程式★
化合反应:4P + 5O2 点燃 2P2O5 用于“空气中氧气体积含量的测定”实验
2H2 + O2 点燃 2H2O 燃烧产物是水,无污染,“绿色能源”
分解反应:2KMnO4 K2MnO4 + MnO2 + O2↑
2H2O2 2H2O + O2↑ 实验室中制取氧气的反应
2H2O 2H2↑+ O2↑
置换反应:Zn + H2SO4 == ZnSO4 + H2↑
Fe + H2SO4 == FeSO4 + H2↑ 实验室中制取氢气的反应
Fe + CuSO4 == FeSO4 + Cu
复分解反应:CaCO3 + 2HCl == CaCl2 + H2O + CO2↑ 实验室中制取二氧化碳的反应
HCl + NaOH == NaCl + H2O
Na2CO3 + Ca(OH)2 == CaCO3↓+ 2NaOH 工业上制备NaOH的反应
Fe2O3 + 6HCl == 2FeCl3 + 3H2O 工业上除锈
其它反应:CO2 + Ca(OH)2 == CaCO3↓+ H2O(用于检验CO2气体)
CO2 +2NaOH == Na2CO3 + H2O(用于吸收CO2气体)
CH4 + 2O2点燃CO2 + 2H2O
例:已知置换反应:A + B → C + D,
(1)若D为氢气,B为稀硫酸,写出一个化学方程式Zn + H2SO4 == ZnSO4 + H2↑;
(2)若D为铜,化合物B的类别为 单质(Fe) 或 氧化物(CO) 。
21.三种气体的实验室制法(包括药品、制取、收集装置的选择、仪器名称、化学方程式、气体的检验、验满方法、步骤、注意事项)
(1)O2:加热高锰酸钾制氧气:2KMnO4 K2MnO4 + MnO2 + O2↑
二氧化锰催化双氧水制氧气:2H2O2 2H2O + O2↑
(2)CO2:大理石与稀盐酸反应制取CO2 :CaCO3 + 2HCl == CaCl2 + H2O + CO2↑
(3)锌粒与稀盐酸反应制取氢气:Zn + 2HCl ==ZnCl2 + H2↑
锌粒与稀硫酸反应制取氢气:Zn + H2SO4 == ZnSO4 + H2↑
O2:(排水法、向上排空气法) CO2:(只能用向上排空气法)
H2:(排水法、向下排空气法)
检验方法:O2:将带火星的木条伸入集气瓶中,若木条复燃,证明是氧气。
CO2:将该气体通入澄清石灰水中,澄清石灰水中变浑浊,证明是二氧化碳。
推广:制取H2S、CH4、NH3这三种气体的发生装置、收集装置。
例:已知甲烷是一种无色、无味、比空气轻的气体,极难溶于水。实验室用加热无水醋酸钠
和固体碱石灰的混合物来制取甲烷。请根据下列装置图回答问题(所用装置图用序号填空)
A B C D E
(1)写出编号仪器的名称:① 试管 ② 酒精灯 ③ 锥形瓶
④ 长颈漏斗 ⑤ 集气瓶
(2)请你用上面的装置设计一个制取和收集甲烷的装置:发生装置选 A 收集装置选D或E
(3)请你设计一个实验来检验该装置的气密性:将导管放入水槽,用手握住试管,看是否有气泡冒出。
22.物质的化学性质:O2、CO2(CO2的检验)、H2O、金属的性质(如:铁[包括铁的冶炼、铁的锈蚀条件及防护、合金]、铝、铜)、碳酸钙、氧化钙、氢氧化钙、盐酸、硫酸、氢氧化钠。
铁生锈及防锈的考点:知道铁生锈的条件及防锈的方法;了解铁的冶炼(原理、还原剂、实验操作、尾气的处理);掌握食品中的干燥剂(生石灰、铁粉)。
物质的俗名:
CaCO3 CaO Ca(OH)2 NaOH Na2CO3 NaCl
(大理石 (生石灰) (熟石灰 (苛性钠 (纯碱) (食盐)
石灰石) 消石灰) 火碱、烧碱)
23.元素周期表:知道元素周期表的使用方法,如查元素符号、元素名称、相对原子质量、
元素分类。
24.几种离子的鉴别:
三大离子(H+、OH-、CO32-)的检验方法:
(1)酸性溶液(H+):(1)紫色石蕊试液 (2)pH试纸
(3)活泼金属Mg、Al、Zn、Fe等 (4)Na2CO3等碳酸盐
(2)碱性溶液(OH-):(1)无色酚酞/紫色石蕊试液 (2)pH试纸 (3)CuSO4等。
(3)CO32-离子(或碳酸盐):稀盐酸、澄清石灰水
(4)掌握碳酸盐的检验;知道铵盐的检验及铵态氮肥不能和碱性物质(熟石灰、草木灰)混合施用;掌握NaOH与CO2反应的探究(使瓶子变形、瓶内气球胀大等,知道用稀盐酸检验反应产物从而证明发生了这一反应);掌握中和反应(操作、指示剂的选择、pH的变化等);了解SO42-、Cl-离子的检验。
检验:能证明NaOH变质、能证明氧化钙、氢氧化钙在空气中的变质。证明CaO中含有CaCO3。
除杂:会除去NaOH中的Na2CO3,会除去NaCl中Na2CO3。
物理性质:了解浓硫酸的腐蚀性(倒在皮肤上的处理方式)、吸水性(作干燥剂)、脱水性;掌握浓硫酸的稀释;了解浓盐酸的挥发性。
25.三种常见的计算(化学式、化学方程式、有关溶液的计算)
(1)化学式:①相对分子质量②元素的质量比③元素质量分数④元素的质量
(2)化学方程式(规范解题、方法、步骤、掌握原理)
例:10g NaOH固体可配制10%NaOH溶液 g,用此溶液可吸收多少克废气SO2?
(有关反应的化学方程式:SO2 +2NaOH == Na2SO3 + H2O)
(3)有关溶液计算(掌握溶质质量分数的计算、溶液稀释的计算、掌握溶液的配制(步骤、仪器))
溶质的质量分数=(溶质质量/溶液质量)х100%
例:配制500gNaCl质量分数为20%的食盐溶液,需要用到的溶剂:B
A.400g,用托盘天平称量 B.400g,用500m L量筒量取
C.100g,用量筒量取 D.400g,用100m L量筒量取
溶液的稀释:浓溶液的质量×浓溶液中溶质质量分数=稀溶液的质量×稀溶液中溶质质量分数
例:现有一瓶500g溶质质量分数为50%的过氧乙酸溶液,要将它稀释为溶质质量分数为5%的过氧乙酸消毒液,最多可得到该溶液多少克?
③
②
⑤
①
④
===
MnO2
反应前后各物质的质量总和
===
通电
===
MnO2
===
△
高温
+H2O
+CO2
+CaCl2
+ Na2CO3
===
△
转化
转化
转化
0
0
0
0
中考化学考前辅导 第8页(共8页)
1.化学研究的对象:物质的组成与结构、物质的性质与变化、物质的用途与制法。
物理变化与化学变化的区别:看是否有新物质生成。
物理性质与化学性质的区别:
例:下列生活中常见的现象,属于于化学变化的是:( A )
A.鞭炮齐鸣 B.冰雪消融 C. 水滴石穿 D.花香四溢
物理性质:颜色、气味、状态、密度、溶解性、硬度、导电性、导热性、延展性等;
化学性质:可燃性、氧化性、还原性、稳定性、酸性、碱性等。
例:下列生活中的一些作法,主要利用化学性质的是 ( C )
A.不锈钢制炊具 B.活性炭除去冰箱中的异味 C.米酿成醋 D.榨取果汁
2.物质的用途:(知道常见物质的用途;探究食品中的填充气)氧气:供给呼吸,支持燃烧;
一氧化碳:冶炼金属,做燃料;二氧化碳:用于灭火,提供植物光合作用的原料,干冰用于人工降雨,舞台烟雾;石灰石:用作建筑材料; 氢氧化钠:制造肥和造纸,中和石油产品中的硫酸; 氮气和稀有气体:用作保护气; 碳酸钠:做洗涤剂,发酵面粉; 氢氧化钙:做石灰桨,中和酸性土壤,配制农药波尔多液; 食盐:作调味剂、腌制蔬菜,配制生理盐水;盐酸:金属除锈;
例:写出下列有关物质的化学式
(1)抢救病人时用呼吸机输入的气体单质是 O2
(2)天安门前的华表的主要成分是 CaCO3
(3)海水中含量最多的一种氧化物是 H2O
(4)常用来除去金属表面的锈的是 HCl
(5)人体的胃液中含有的一种有助于消化的酸是 HCl
(6)生理盐水中的溶质是 NaCl (7)最简单的有机物是 CH4
例:物质的有关用途:①作调味剂 ②制造肥和造纸 ③作电极 ④改良酸性土壤 ⑤除去面团发酵时生成的酸 ⑥填充气球 ⑦配制农药“波尔多液” ⑧复合肥料
请将上述用途的序号填入下列相应物质后面的横线上:
(1)石墨 ③ (2)硫酸铜 ⑦ (3)氯化钠 ① (4)烧碱 ②
(5)氢气 ⑥ (6)纯碱 ⑤ (7)消石灰 ④ 、 ⑦ (8)硝酸钾 ⑧
例:现有:a.盐酸 b.浓硫酸 c.熟石灰 d.纯碱 e.氮气 f.甲烷 等六种物质,请用编号回答下列问题: ①有时家庭做馒头会用到的物质是 d 。 ②能用来做某些气体的干燥剂是 b 。③天然气的主要成分 f 、造成矿井瓦斯爆炸的是 f 。④能用于改良酸性土壤的是 c 。能用作食品保护气的是 e 。
⑥能用于金属除锈的是 a 。
3.化学与环境污染:水污染、空气污染、固体废弃物污染。(污染的原因、污染物、危害,防护措施)
①空气:了解空气污染的原因(SO2、NOx、CO、可吸入颗粒物);知道如何防止空气的污染;知道如何防止酸雨的形成;知道如何防止温室效应的产生;掌握用红磷测定空气中氧气体积分数的实验(包括:方程式、现象、原理、实验目的及吸入水的体积小于五分之一的原因)。
②水:水的净化过程(了解明矾、活性炭、液氯的作用);了解乳化的原理(由不稳定的乳浊液变成均匀、稳定的乳浊液);了解水污染 途径及防治方法;能对节约用水提一些合理化的建议。
③知道白色污染的原因及防治;垃圾分类:可回收垃圾、不可回收垃圾、有害垃圾。
例:保护环境,防止空气和水体的污染是每个公民应尽的职责,下列做法中,有利于环境保护的是( D )
①控制工业生产中废气和废水的直接排放;②增大绿地面积;③开发生产无汞电池;④分类回收垃圾⑤生活污水处理后排放;⑥禁止含磷洗涤剂的使用;⑦合理使用农药和化肥;⑧在水库周边兴建造纸厂
A.全部 B.②④⑥⑧ C.①②③④⑦⑧ D.①②③④⑤⑥⑦
4.化学实验基本操作(画图或文字叙述)及实验安全事故的处理:
例:下列各图是初中化学常见的几个实验操作,其中错误的是
5.安全问题、逃生:食品安全、可燃性物质不能与氧气和明火同时接触,会发生爆炸;火灾的逃生方法。
6.化学与能源的利用与开发及燃料的选择:(包括:氢能、化学反应能量的转化、能源与环境的关系) 三大矿石燃料:煤、石油、天然气
(1)了解能源的分类及种类,知道最理想的能源是氢能源;知道节能的方法;充分燃烧的条件及优点。
(2)绿色能源:无污染的能源。
能量转化的形式:太阳能 光能或电能或化学能,
化学能 光能或电能或热能 电能 化学能
例:化学能转化为电能的例子:干电池放电 化学能转化为热能的例子:燃料燃烧
7.物质的变化、组成、分类
(1)化学变化的依据、特征
(2)物质的组成:元素组成 例如:水是由氢、氧两种元素组成的。
(3)简单分类:混合物、纯净物、单质、化合物、有机物(含碳的化合物,除:CO、CO2、H2CO3、CaCO3等外)、无机物、氧化物、酸、碱、盐
8.燃烧的条件和灭火的原理:
知道燃烧的三个条件(①物质具有可燃性;②可燃物要与氧气接触;③可燃物的温度达到着火点以上)及灭火的方法和原理,火灾现场要学会自救,在易燃易爆场所要严禁烟火,禁止穿化纤衣服,穿带铁钉的鞋子。
9.构成物质的三种粒子:(分子、原子、离子)
微粒的特征:微粒很小、微粒总是不断运动、微粒之间有空隙、同种微粒的性质相同。
(1)分子的特征 (2)构成原子的粒子(质子、中子、电子)
(3)掌握常见离子的书写:(K+ Na+ H+ CO32— SO42— Cl— NO3— OH—)
(4)有关物质构成的说法:如:氯化钠是由钠离子和氯离子构成的。
例:秋冬干燥易给人带来不适,医生建议在室内放盆热水可以增加空气的湿度。这种方法说明( D )A.分子很小 B.分子之间有间隔 C.分子是可分的 D.分子在不断运动
10.化学与生活、材料:(蒸馏水与矿泉水的区别方法[蒸发后是否有固体物质剩余];硬水与软水的鉴别方法 [加肥皂水并搅拌] ; 知道硬水软化的方法;粗盐的提纯[步骤:溶解、过滤、蒸发结晶];材料的分类及会判断材料所属的类别;记住塑料、橡胶、纤维都是有机高分子材料;会鉴别聚乙烯塑料和聚氯乙烯塑料[课本P238:灼烧后闻气味];会鉴别天然纤维(羊毛、棉)和化纤类(尼龙、涤纶等[课本P237:灼烧后闻气味] ;了解化学与生活的关系的例子:如:食醋除水垢、洗洁精去油污、净水可加明矾等。)
例:下列广告用语从化学角度看,没有科学性错误的是( D )
A.“霸王”牌厕所清洁剂,能清除所有污秽 B.“雪山牌”矿泉水,真正的纯水
C.“大自然”牌茶叶,真正的“绿色”饮品,天然种植,不含任何元素 D.吸烟有害健康
例:下列生活中的常见材料,属于有机合成高分子材料的是( C )
A.钢筋混凝土 B.陶瓷 C.塑料 D.钢铁
例:农村有句谚语“雷雨发庄稼”,这是由于在放电的条件下,空气中的氧气和氮气化合生成了氮的氧化物,氮的氧化物再经过各种复杂的化学变化,最后生成了易被农作物吸收的硝酸盐。可以说,雷雨给庄稼施加了( C ) A.钾肥 B.磷肥 C.氮肥 D.复合肥
例:学习和生活中常存在许多认识上的误区,学好化学可以帮助人们辨认清楚,如干冰不是冰,是二氧化碳;白金不是金,是金属铂。请问类似的化学知识你还知道哪些?试举出二例: 水银不是银,是金属汞 、 纯碱(碳酸钠)不是碱,是盐 。
11.有关化学式的说法判断:
例:毒品严重危害人类社会。冰毒的化学式为C10H15N,有关冰毒的叙述正确的是(A)
A.不完全燃烧时会生成CO B.完全燃烧时的生成物只有两种
C.C、H、N三种元素中质量分数最高的是H元素 D.C、H、N元素的质量比为10:15:1
12.化合价的计算、化学式是否正确的判断:
★会判断元素的化合价,会写化学式
名称 正确 错误 名称 正确 错误
碳酸钠 Na2CO3 NaCO3 氯化钙 CaCl2 CaCl
氢氧化钠 NaOH Na(OH) 硫酸 H2SO4 SO4
氯气 Cl2 Cl 氧化铝 Al2O3 AlO
氨气 NH3 NH4 铵根离子 NH4+ NH3
注意区别:高锰酸钾 KMnO4 锰酸钾K2MnO4
硫酸亚铁 FeSO4 硫酸铁Fe2(SO4)3
13.化学反应的基本类型(化合反应、分解反应、复分解反应、置换反应)及金属活动性顺序表的应用(能利用金属与酸或与可溶性盐反应的条件来探究金属的活动性顺序)
(1)置换反应:金属+酸
金属活动性顺序表的应用
金属+盐溶液
K Ca Na Mg Al | Zn Fe Sn Pb (H) | Cu Hg Ag Pt Au
金属活动性由强到弱
①金属(H前) + 酸(HCl或H2SO4)→ 盐 + 氢气
②金属(活动性靠前)+ 盐(可溶于水)→ 新盐 + 新金属(活动性靠后)
(2)复分解反应的条件:生成物中有沉淀、气体或水生成
例:现有a、b、c三种金属,将a、b分别放入稀硫酸、c的硝酸盐溶液中,现象如下表所示:
a b
在稀硫酸中 无反应 溶解并放出气体
在c的硝酸盐溶液中 无反应 无反应
则这三种金属的活动性由强到弱的顺序为 ( B )
A. a、b、c B. c、b、a C. b、a、c D. a、c、b
例:如图是某个化学反应前后各种物质的微观模拟图,图中分别表示不同元素的原子。根据图示判断,该反应属于( A )
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
14.质量守恒定律:
掌握质量守恒定律的应用
“二变”:分子的种类发生改变、物质的种类发生改变
“四不变”:①元素的种类 ②原子的种类
③原子的个数④原子的质量
“可能改变”:分子的数目
(验证装置的选择:有气体参加或有气体生成的要选用密闭的容器,其它的可用敞开的容器)
例:某种有机化合物R完全燃烧的化学方程式如下:2R + 3O2 点燃 4H2O + 2CO2 ,根据
质量守恒定律,R的化学式是( A )
A.CH3OH B.C2H5OH C.C2H4 D.CCl4
15.溶液的酸碱性及pH试纸的使用:掌握溶液酸碱性的检验、酸碱度的测量。
酸性溶液 中性溶液 碱性溶液
pH <7 =7 >7
紫色石蕊试液 变红色 不变色(紫色) 变蓝色
无色酚酞试液 不变色 不变色 变红色
(根据土壤的酸碱性选择适宜的植物进行种植)
测定溶液pH最简便的方法:使用pH试纸
pH试纸的使用方法:用玻璃棒醮取少量待测溶液滴到pH试纸上,将试纸显现的颜色与标准比色卡进行对照,找出该颜色对应的数值就为该溶液的pH。
例:常见食物pH的近似值范围如下:
常见食物 橘子汁 泡菜 酸牛奶 鸡蛋清
pH(近似值) 3.0~4.0 3.2~3.6 6.3~6.6 7.6~8.0
下列说法中,不正确的是( B )
A.鸡蛋清显碱性 B.胃酸过多的人应少吃泡菜
C.橘子汁能使石蕊溶液变红 D.酸牛奶比橘子汁的酸性强
16.溶液的判断和溶液的性质:如:泥土与水能否形成溶液?
溶液的性质:(1)少量固体物质溶于水,使稀溶液的凝固点降低、沸点升高;
(2)酸碱盐的水溶液具有导电性;
(3)物质溶于水时常有能量变化:使水温升高的物质有:氢氧化钠、浓硫酸、氧化钙;使水温降低的物质:硝酸铵等;变化不明显的有:氯化钠、蔗糖等。
17.实验图像(溶解度曲线及其应用、pH曲线)
例:右图为A、B、C三种物质的溶解度曲线。
(1)0℃时,A的溶解度是 20 g。
(2)在 t2 ℃时, A、B两物质的溶解度相等。
(3)把A、B、C的饱和溶液从t2℃降至t1℃时,没有晶
体析出的是 C 。
例:向盛有10mL氢氧化钠溶液的烧杯中逐滴滴加稀盐酸,下列图像能体现溶液的pH变化情况的是
pH pH pH pH
7 7 7 7
稀盐酸的体积 稀盐酸的体积 稀盐酸的体积 稀盐酸的体积
A B C D
18.溶解、过滤、蒸发的操作及所需的仪器:
所需的仪器:溶解:烧杯、玻璃棒;
过滤:烧杯、玻璃棒、漏斗、铁架台;
蒸发:玻璃棒、蒸发皿、铁架台、酒精灯;
加速物质溶解的措施:搅拌、加热、把固体研成粉末。
例:从某些盐湖中捞出的氯化钠晶体中含有碳酸钠,为除去碳酸钠得到纯净的氯化钠晶体可采用的方法是( C )
A.溶解、过滤、蒸发 B.溶解后加入适量的硫酸溶液、蒸发
C.溶解后加入适量的稀盐酸,蒸发 D.加入适量的石灰水,蒸发
19.化学物质与人体健康:
(1)了解钙、铁、锌、碘等元素,维生素对人体健康的重要作用
(2)六大营养素:糖类、油脂、蛋白质、维生素、矿物质、水(了解它们对人体的作用)
(3)有毒物质:CO、工业盐(亚硝酸钠NaNO2)、工业酒精中的杂质甲醇、甲醛、重金属盐、黄曲霉毒素
(4)能举出富含糖类、蛋白质、油脂、维生素的食品;掌握淀粉[加碘水或碘酒,显蓝色,则含有淀粉]、葡萄糖的检验;知道蛋白质的变性([课本P221-P222]浓硝酸、重金属盐、甲醛溶液、加热);知道重金属盐、甲醛溶液对人体有毒及重金属盐中毒的解毒方法。
例:某校食堂中餐食谱如下:
主食:大米饭
配菜:红烧排骨 煎鸡蛋 炸鸡腿 豆腐汤 炒猪肝
主食和配菜中主要含维生素、 、 、 、无机盐和水等营养素,考虑到各种营养成分的均衡搭配,应该增加的配菜是_____________。
答案:糖类;蛋白质;油脂;蔬菜
20.化学方程式的书写:
★中考常考化学方程式★
化合反应:4P + 5O2 点燃 2P2O5 用于“空气中氧气体积含量的测定”实验
2H2 + O2 点燃 2H2O 燃烧产物是水,无污染,“绿色能源”
分解反应:2KMnO4 K2MnO4 + MnO2 + O2↑
2H2O2 2H2O + O2↑ 实验室中制取氧气的反应
2H2O 2H2↑+ O2↑
置换反应:Zn + H2SO4 == ZnSO4 + H2↑
Fe + H2SO4 == FeSO4 + H2↑ 实验室中制取氢气的反应
Fe + CuSO4 == FeSO4 + Cu
复分解反应:CaCO3 + 2HCl == CaCl2 + H2O + CO2↑ 实验室中制取二氧化碳的反应
HCl + NaOH == NaCl + H2O
Na2CO3 + Ca(OH)2 == CaCO3↓+ 2NaOH 工业上制备NaOH的反应
Fe2O3 + 6HCl == 2FeCl3 + 3H2O 工业上除锈
其它反应:CO2 + Ca(OH)2 == CaCO3↓+ H2O(用于检验CO2气体)
CO2 +2NaOH == Na2CO3 + H2O(用于吸收CO2气体)
CH4 + 2O2点燃CO2 + 2H2O
例:已知置换反应:A + B → C + D,
(1)若D为氢气,B为稀硫酸,写出一个化学方程式Zn + H2SO4 == ZnSO4 + H2↑;
(2)若D为铜,化合物B的类别为 单质(Fe) 或 氧化物(CO) 。
21.三种气体的实验室制法(包括药品、制取、收集装置的选择、仪器名称、化学方程式、气体的检验、验满方法、步骤、注意事项)
(1)O2:加热高锰酸钾制氧气:2KMnO4 K2MnO4 + MnO2 + O2↑
二氧化锰催化双氧水制氧气:2H2O2 2H2O + O2↑
(2)CO2:大理石与稀盐酸反应制取CO2 :CaCO3 + 2HCl == CaCl2 + H2O + CO2↑
(3)锌粒与稀盐酸反应制取氢气:Zn + 2HCl ==ZnCl2 + H2↑
锌粒与稀硫酸反应制取氢气:Zn + H2SO4 == ZnSO4 + H2↑
O2:(排水法、向上排空气法) CO2:(只能用向上排空气法)
H2:(排水法、向下排空气法)
检验方法:O2:将带火星的木条伸入集气瓶中,若木条复燃,证明是氧气。
CO2:将该气体通入澄清石灰水中,澄清石灰水中变浑浊,证明是二氧化碳。
推广:制取H2S、CH4、NH3这三种气体的发生装置、收集装置。
例:已知甲烷是一种无色、无味、比空气轻的气体,极难溶于水。实验室用加热无水醋酸钠
和固体碱石灰的混合物来制取甲烷。请根据下列装置图回答问题(所用装置图用序号填空)
A B C D E
(1)写出编号仪器的名称:① 试管 ② 酒精灯 ③ 锥形瓶
④ 长颈漏斗 ⑤ 集气瓶
(2)请你用上面的装置设计一个制取和收集甲烷的装置:发生装置选 A 收集装置选D或E
(3)请你设计一个实验来检验该装置的气密性:将导管放入水槽,用手握住试管,看是否有气泡冒出。
22.物质的化学性质:O2、CO2(CO2的检验)、H2O、金属的性质(如:铁[包括铁的冶炼、铁的锈蚀条件及防护、合金]、铝、铜)、碳酸钙、氧化钙、氢氧化钙、盐酸、硫酸、氢氧化钠。
铁生锈及防锈的考点:知道铁生锈的条件及防锈的方法;了解铁的冶炼(原理、还原剂、实验操作、尾气的处理);掌握食品中的干燥剂(生石灰、铁粉)。
物质的俗名:
CaCO3 CaO Ca(OH)2 NaOH Na2CO3 NaCl
(大理石 (生石灰) (熟石灰 (苛性钠 (纯碱) (食盐)
石灰石) 消石灰) 火碱、烧碱)
23.元素周期表:知道元素周期表的使用方法,如查元素符号、元素名称、相对原子质量、
元素分类。
24.几种离子的鉴别:
三大离子(H+、OH-、CO32-)的检验方法:
(1)酸性溶液(H+):(1)紫色石蕊试液 (2)pH试纸
(3)活泼金属Mg、Al、Zn、Fe等 (4)Na2CO3等碳酸盐
(2)碱性溶液(OH-):(1)无色酚酞/紫色石蕊试液 (2)pH试纸 (3)CuSO4等。
(3)CO32-离子(或碳酸盐):稀盐酸、澄清石灰水
(4)掌握碳酸盐的检验;知道铵盐的检验及铵态氮肥不能和碱性物质(熟石灰、草木灰)混合施用;掌握NaOH与CO2反应的探究(使瓶子变形、瓶内气球胀大等,知道用稀盐酸检验反应产物从而证明发生了这一反应);掌握中和反应(操作、指示剂的选择、pH的变化等);了解SO42-、Cl-离子的检验。
检验:能证明NaOH变质、能证明氧化钙、氢氧化钙在空气中的变质。证明CaO中含有CaCO3。
除杂:会除去NaOH中的Na2CO3,会除去NaCl中Na2CO3。
物理性质:了解浓硫酸的腐蚀性(倒在皮肤上的处理方式)、吸水性(作干燥剂)、脱水性;掌握浓硫酸的稀释;了解浓盐酸的挥发性。
25.三种常见的计算(化学式、化学方程式、有关溶液的计算)
(1)化学式:①相对分子质量②元素的质量比③元素质量分数④元素的质量
(2)化学方程式(规范解题、方法、步骤、掌握原理)
例:10g NaOH固体可配制10%NaOH溶液 g,用此溶液可吸收多少克废气SO2?
(有关反应的化学方程式:SO2 +2NaOH == Na2SO3 + H2O)
(3)有关溶液计算(掌握溶质质量分数的计算、溶液稀释的计算、掌握溶液的配制(步骤、仪器))
溶质的质量分数=(溶质质量/溶液质量)х100%
例:配制500gNaCl质量分数为20%的食盐溶液,需要用到的溶剂:B
A.400g,用托盘天平称量 B.400g,用500m L量筒量取
C.100g,用量筒量取 D.400g,用100m L量筒量取
溶液的稀释:浓溶液的质量×浓溶液中溶质质量分数=稀溶液的质量×稀溶液中溶质质量分数
例:现有一瓶500g溶质质量分数为50%的过氧乙酸溶液,要将它稀释为溶质质量分数为5%的过氧乙酸消毒液,最多可得到该溶液多少克?
③
②
⑤
①
④
===
MnO2
反应前后各物质的质量总和
===
通电
===
MnO2
===
△
高温
+H2O
+CO2
+CaCl2
+ Na2CO3
===
△
转化
转化
转化
0
0
0
0
中考化学考前辅导 第8页(共8页)
同课章节目录
