第三节 氧化剂和还原剂(山东省枣庄市滕州市)
文档属性
| 名称 | 第三节 氧化剂和还原剂(山东省枣庄市滕州市) |

|
|
| 格式 | rar | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2008-07-02 00:00:00 | ||
图片预览





文档简介
课件15张PPT。山东省滕州市第一中学 李有恒第三节 氧化剂和还原剂
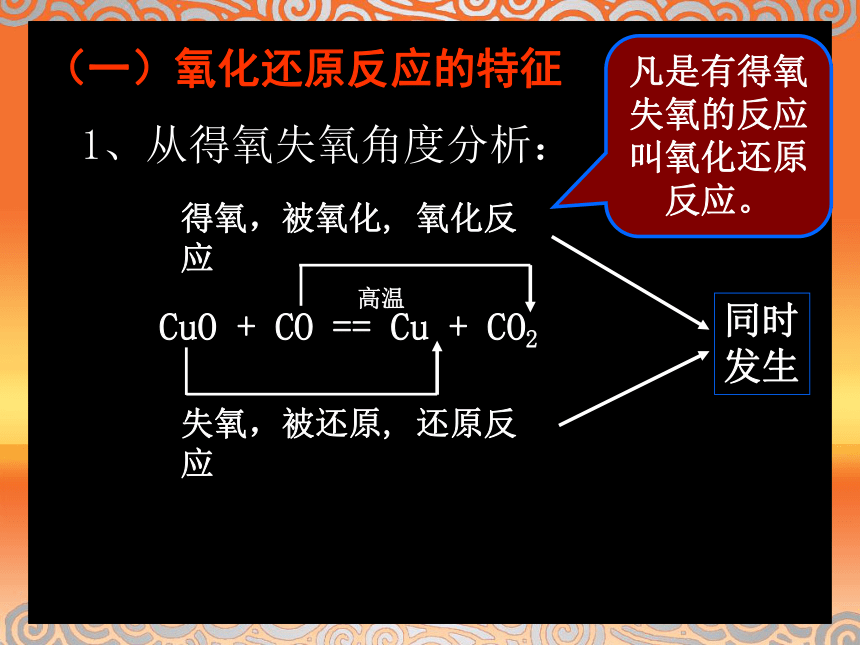
一、氧化还原反应(一)氧化还原反应的特征CuO + CO == Cu + CO2 1、从得氧失氧角度分析:得氧,被氧化, 氧化反应失氧,被还原, 还原反应凡是有得氧失氧的反应叫氧化还原反应。同时发生高温1.是不是所有的化学反应都有氧参加?有氧参加的反应一定是氧化还原反应,而没有氧参加的反应一定不是氧化还原反应吗?思考与交流:2.请分析下列3个氧化还原反应中各种元素的化合价在反应前后有无变化,讨论氧化还原与元素化合价的升降有什么关系。
2CuO + C == 2Cu + CO2
H2O + C == H2 + CO
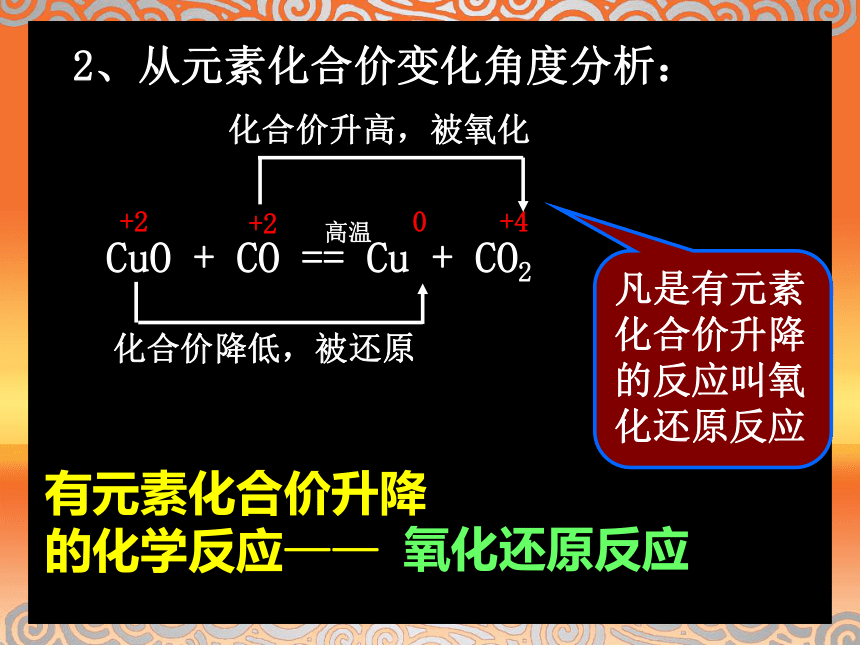
CuO + H2 == Cu +H2O高温高温CuO + CO == Cu + CO2 2、从元素化合价变化角度分析:化合价降低,被还原+20+4高温化合价升高,被氧化+2有元素化合价升降的化学反应——氧化还原反应凡是有元素化合价升降的反应叫氧化还原反应练习:分析下列反应中各元素化合价在反应前后有无变化,如何变化。并判断是否是氧化还原反应。Fe + CuSO4 = FeSO4 + CuZn + 2HCl = ZnCl2 + H2NaOH + HCl = NaCl + H2O是是不是怎样表示??化合价降低,被还原化合价升高,被氧化用于表示反应中元素化合价变化情况的双箭头——双线桥书写步骤:1.标出变化了的元素化合价;2.箭头总是从反应物指向生成物;4.标出化合价升、降。3.箭头指向同种元素;氧化还原反应的表示方法:【练习】下列式子中不正确的是 2Na + Cl2 == 2NaCl金属钠能和氯气反应:失去电子,化合价升高, 被氧化得到电子,化合价降低,被还原 为什么在氧化还原反应中元素的化合价会发生变化?发生了电子转移!学 与 问 有人说置换反应、有单质参加的化合反应和有单质生成的分解反应全部属于氧化还原反应。你认为这个说法正确吗?请说明你的理由。3、从电子转移情况分析(二)氧化还原反应的实质小 结氧化还原反应的特征:
反应前后,元素化合价有升、降的变化。
氧化还原反应的实质:
反应中发生了电子的得失学习目标过程与方法:在复习从得氧、失氧角度划分氧化反应 和还原反应的基础上,了解化学反应有多种不同的分类方法。
知识与技能:学会用化合价升降及电子转移的观点来理解氧化还原反应,并会利用“双线桥”分析氧化还原反应。
情感态度与价值观:在理解电子得失、氧化和还原的相互依存和相互对立的关系上,培养对立统一的辩证唯物主义思想。
学习重、难点: 用化合价升降和电子转移的观点来理解氧化还原反应。课堂练习1.下列反应一定属于氧化还原反应的是( ) A.化合反应 B.置换反应
C.分解反应 D.复分解反应同学们再见!
一、氧化还原反应(一)氧化还原反应的特征CuO + CO == Cu + CO2 1、从得氧失氧角度分析:得氧,被氧化, 氧化反应失氧,被还原, 还原反应凡是有得氧失氧的反应叫氧化还原反应。同时发生高温1.是不是所有的化学反应都有氧参加?有氧参加的反应一定是氧化还原反应,而没有氧参加的反应一定不是氧化还原反应吗?思考与交流:2.请分析下列3个氧化还原反应中各种元素的化合价在反应前后有无变化,讨论氧化还原与元素化合价的升降有什么关系。
2CuO + C == 2Cu + CO2
H2O + C == H2 + CO
CuO + H2 == Cu +H2O高温高温CuO + CO == Cu + CO2 2、从元素化合价变化角度分析:化合价降低,被还原+20+4高温化合价升高,被氧化+2有元素化合价升降的化学反应——氧化还原反应凡是有元素化合价升降的反应叫氧化还原反应练习:分析下列反应中各元素化合价在反应前后有无变化,如何变化。并判断是否是氧化还原反应。Fe + CuSO4 = FeSO4 + CuZn + 2HCl = ZnCl2 + H2NaOH + HCl = NaCl + H2O是是不是怎样表示??化合价降低,被还原化合价升高,被氧化用于表示反应中元素化合价变化情况的双箭头——双线桥书写步骤:1.标出变化了的元素化合价;2.箭头总是从反应物指向生成物;4.标出化合价升、降。3.箭头指向同种元素;氧化还原反应的表示方法:【练习】下列式子中不正确的是 2Na + Cl2 == 2NaCl金属钠能和氯气反应:失去电子,化合价升高, 被氧化得到电子,化合价降低,被还原 为什么在氧化还原反应中元素的化合价会发生变化?发生了电子转移!学 与 问 有人说置换反应、有单质参加的化合反应和有单质生成的分解反应全部属于氧化还原反应。你认为这个说法正确吗?请说明你的理由。3、从电子转移情况分析(二)氧化还原反应的实质小 结氧化还原反应的特征:
反应前后,元素化合价有升、降的变化。
氧化还原反应的实质:
反应中发生了电子的得失学习目标过程与方法:在复习从得氧、失氧角度划分氧化反应 和还原反应的基础上,了解化学反应有多种不同的分类方法。
知识与技能:学会用化合价升降及电子转移的观点来理解氧化还原反应,并会利用“双线桥”分析氧化还原反应。
情感态度与价值观:在理解电子得失、氧化和还原的相互依存和相互对立的关系上,培养对立统一的辩证唯物主义思想。
学习重、难点: 用化合价升降和电子转移的观点来理解氧化还原反应。课堂练习1.下列反应一定属于氧化还原反应的是( ) A.化合反应 B.置换反应
C.分解反应 D.复分解反应同学们再见!
