必修2期末复习(广东省深圳市)
文档属性
| 名称 | 必修2期末复习(广东省深圳市) |

|
|
| 格式 | rar | ||
| 文件大小 | 256.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2008-07-05 00:00:00 | ||
图片预览










文档简介
课件40张PPT。第一章
物质结构 元素周期律复习 (一)原子结构(四)化学键(二)元素周期表(三)元素周期律一、原子结构知识
(一)、??原子结构和构成粒子数量间的关系
1、原子( X)中,质子有 个,中子有 个,核外电子有 个。
2、相互关系
(1)??质量数=
(2)??原子中:质子数=ZA-ZZ 质子数+中子数核电荷数=核外电子数Az1、1H、2H、3H、H+、H2是( )
A.氢的5种同位素
B.5种氢元素
C.氢的5种同素异形体
D.氢元素的5种不同微粒(二)、理解同位素的概念: D质子数相同而中子数不同的同一元素的不同原子互称为同位素B3、下列各组中,属于同位素的是:( ? )
A.H2、D2、T2?? B.金刚石和足球烯C60???
C.H2O和D2O???? D.16O和18OD (三)、核外电子排布
练习1.下列叙述正确的是( )?
A.两种粒子,若核外电子排布完全相同,则其化学性质一定相同?
B.凡单原子形成的离子,一定具有稀有气体元素原子的核外电子排布?
C.两原子,若核外电子排布相同,则一定属于同种元素
D.不存在两种质子数和电子数均相同的阳离子和阴离子CD二、元素同期表
1、元素周期表一共 行, 纵列。从横的方面看,分为 个短周期, 个长周期,共为 个周期。从纵的方面看,分为 个主族, 个副族,一个 族和 族。七三七七七018四VIII 2、元素周期表与原子结构的关系
周期序数= 。
主族序数= = ______________
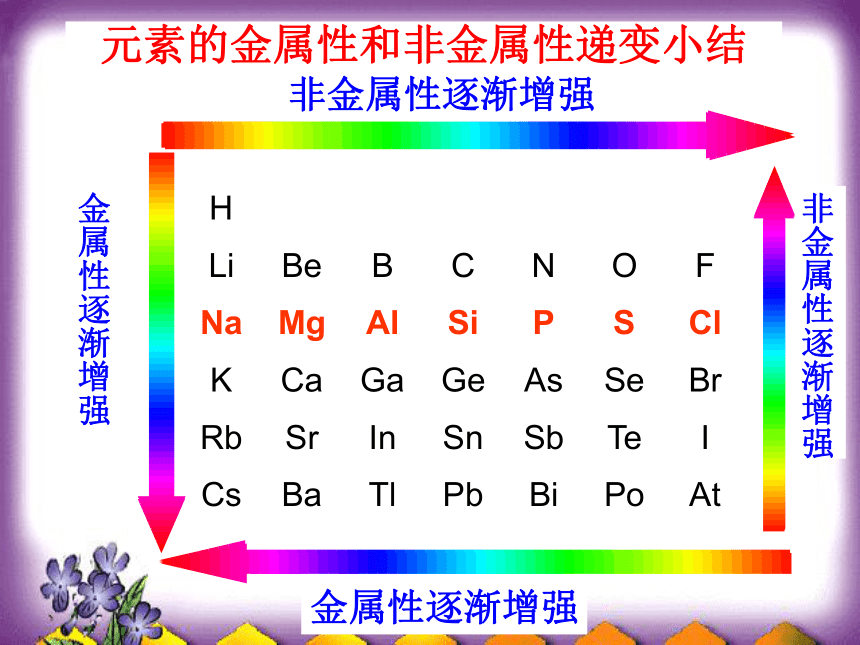
主族元素的最低负化合价=8 - 。 电子层数 最外层电子数 最高正化价 主族序数 三、元素周期律元素的性质微观性质: 原子半径、化合价、 电子得失能力宏观性质:金属性、非金属性 元素的金属性和非金属性递变小结非金属性逐渐增强金属性逐渐增强金属性逐渐增强非金属性逐渐增强大→小小→大逐渐减小
逐渐增大逐渐增大
逐渐减小金属性递减、
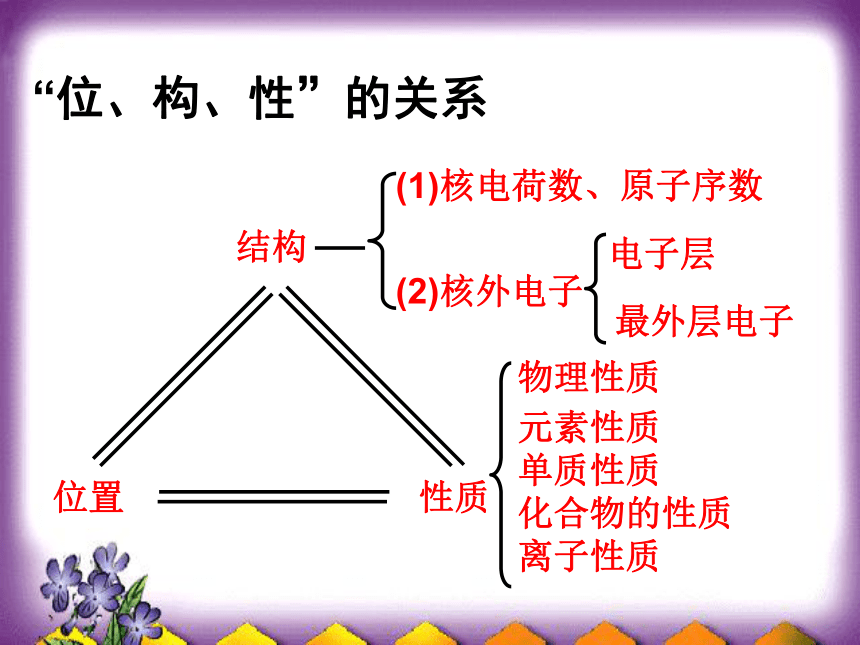
非金属性递增金属性递增、非金属性递减电子层数相同、最外层电子增多电子层增多最外层电子数相同元素周期律的内容: 元素的性质随着原子序数的递增呈周期性的变化。元素周期律的实质: 元素的性质周期性变化是元素的原子核外电子排布呈周期性变化的必然结果。“位、构、性”的关系 结构位置性质(1)核电荷数、原子序数(2)核外电子电子层最外层电子物理性质单质性质化合物的性质离子性质元素性质 1、 碱金属元素的性质1
软,亮.轻.
低(熔点).
略带
金色单质都具有强的还原性 元素的性质与原子结构7单质的熔,沸点较低,颜色较深单质具有强的氧化性2、卤素的性质 卤素的化学性质1、与氢气反应H2 + X2 = 2HX(X=F、Cl、Br、I)从氟到碘,反应从易到难,反应剧烈程度越来越弱。生成的氢化物稳定性:HF > HCl > HBr > HI2、卤素单质氧化性:F2 > Cl2 > Br2 > I2总结 通过比较碱金属单质与氧气、与水的反应,以及卤素单质与氢气的反应、卤素单质间的置换反应,得出结论: 元素的性质与________有密切的关系,主要与____________________,特别是______________有关。原子结构 原子核外电子的排布最外层电子数四、化学键化学键: 在原子结合成分子时,相邻的原子之间强烈的相互作用,叫做化学键。化学反应的过程,本质上就是旧化学键断裂和新化学键形成的过程。化学键离子键共价键非极性键极性键活泼金属与活泼非金属之间非金属元素之间阴、阳离子之间的静电作用原子间形成共用电子对有方括号、有正负号无方括号、有正负号(1).离子键和共价键(2)书写有关物质或微粒的电子式(1).1~18号元素原子的电子式
(2).Na+ NH4+ O22- Cl2、 N2、 CCl4 、NaCl、MgO、MgCl2的电子式
(3).H2S、NH4Cl、H2O2中化学键的形成过程(3)判断下列物质内的化学键,哪些是极性共价键,哪些是非极性共价键?
1.CO2
2. H2O2
3. Na2O
4.Na2O2
5.NH4Cl第二章 化学反应与能量复习1、各种物质都储存有化学能。不同的物质因组成不同、结构不同,所包含的化学能也不同。
2.化学反应中是吸收能量还是放出能量,决定于反应物的总能量与生成物的总能量的相对大小。
3.化学反应中能量变化的主要原因是:化学键的断裂和形成。断开反应物中的化学键要吸收能量,形成生成物中的化学键要放出能量。
4.化学反应中能量变化,主要表现为热量的变化,也可以转化为电能、光能、声能等。化学反应中能量变化与化学键的关系定义:化学能转化为电能的装置形成条件:⑴两极; ⑵电解质溶液; ⑶闭合判断:正负极和电子流向工作原理:(总的氧化还原反应,电极反应)应用题型分析常见、简单电池工作原理。比较金属活动性强弱。比较反应速率快慢。判断溶液pH变化。金属的腐蚀和防护。原电池(从活泼性比较、电子得失、氧化还原反应等多角度判断)设计简单电池。判断原电池正、负极的方法*由组成原电池的两极材料判断: 一般是活泼的金属为负极
活泼性较弱的金属或能导电的非金属为正极*根据电流方向或电子流动方向判断: 电流是由正极流向负极
电子流动方向是由负极流向正极*根据原电池两极发生的变化来判断: 失电子的反应→氧化反应→负极
得电子的反应→还原反应→正极1.化学反应速率是衡量化学反应快慢的物理量。
通常用单位时间内反应物浓度的减小或生成物浓度的增加来表示。3. 单位:mol/(L·s)或mol/(L·min) 化学反应速率概念:1、内因:反应物自身因素
2、外因:
温度:温度越高,反应速率越大。
催化剂:正催化剂能显著增大反应速率。
浓度:反应物浓度越大,反应速率越大。
压强:压强越大,气体反应的速率越大。
其它:接触面积、光、超声波等。 影响化学反应速率的因素: 化学反应限度:1、化学平衡状态:
当一个可逆反应进行到正向反应速率与逆向反应速率相等时,各反应物和生成物的浓度不随时间改变,化学反应达到平衡状态,反应程度达到限度。2、化学平衡的特征:逆、等、动、定、变3、化学平衡的标志增大反应物浓度,向正反应方向移动。1、浓度:2、温度:升高温度,向吸热的反应方向移动。3、压强:增大压强,向气体体积减少的的方向移动。4、催化剂:化学平衡不移动。 影响化学平衡的因素:第三章有机化合物复习1、成键特点: 在有机物分子中碳呈四价。碳原子既可与其他原子形成共价键,碳原子之间也可相互成键;既可以形成单键,也可以形成双键或三键;碳碳之间可以形成长的碳链,也可以形成碳环。 当烃分子中的碳原子个数为n时,其中氢原子个数的最大数值为2n+2,这是氢原子个数的上限值。以烷烃分子结构和分子组成通式CnH2n+2为基础进行分析和比较:在结构中,若增加一个C=C或C=O双键,就少2个H;在结构中若出现一个C≡C就少4个H;在结构中若出现一个环状结构也少2个H;所以,烯烃和环烷烃的分子组成通式都为CnH2n;炔烃和二烯烃的分子组成通式都为CnH2n-2;苯和苯的同系物,结构中有苯环结构,苯环可以看成是具有3个C=C双键和一个环状结构,氢原子个数应在烷烃的基础上减去4×2=8个,故苯和苯的同系物的分子组成通式为:
CnH(2n+2-4×2)即CnH2n-6 (n≥6)。一、基本概念2、同系物 : 结构相似,在分子组成上相差一个或若干个CH2原子团的物质互称为同系物。如甲烷、乙烷、丙烷 ······(1)同系物必须结构相似,即组成元素相同,官能团种类、个数及连接方式相同,分子组成通式相同。
(2)同系物在组成上相差一个或若干个“CH2”,即相对分子质量相差14或14的整数倍。
(3)同系物有相似的化学性质,物理性质有一定的递变规律。3、同分异构体 : 具有同分异现象的不同化合物互称为同分异构体。 化合物具有相同的分子式,但具有不同结构式的现象称为同分异现象。 同分异构体可以属于同一类物质,也可以属于不同类物质。可以是有机物,也可以是无机物。
中学阶段涉及的同分异构体常见的有三类:
(1)碳链异构(2)位置(官能团位置)异构 (3)类别异构(又称官能团异构)1、取代反应: 有机物分子里的某些原子或原子团被其他原子或原子团所替代的反应叫取代反应。 被加成的试剂如:H2、X2(X为Cl、Br或I)、H2O、HX、HCN等能离解成一价原子或原子团的物质。通过有机物发生加成反应时反应物之间的量关系,还可定量判断该有机物分子结构中不饱和键的情况:是C=C键,还是C≡C键,或是苯环结构,以及它们的个数。2、加成反应(及加聚反应) : 有机物分子中双键或三键两端的碳原子与其它原子或原子团直接结合生成新的化合物的反应,叫做加成反应 二、基本反应类型3、酯化反应(属于取代反应) : 酸和醇作用生成酯和水的反应叫做酯化反应 。 ①酯化反应的脱水方式是: “酸脱羟基醇脱氢”(可用同位素原子示踪法证明)。 ③在酯化反应中使用饱和Na2CO3溶液的作用是中和乙酸,溶解乙醇,降低酯的溶解度,使酯浮于水面,容易分层析出,便于分离。三、重要有机物的结构、性质和用途 甲烷乙烯苯乙醇乙酸糖类油脂蛋白质甲烷分子结构特点
主要化学性质
主要用途饱和烃易取代、能分解、难氧化清洁能源、化工原料乙烯分子结构特点
主要化学性质
主要用途——不饱和烃CH2=CH2易氧化、易加成(加聚)⑴石油化学工业最重要的基础原料⑵植物生长调节剂 ——产量作为石油化工水平的标志苯分子结构特点
主要化学性质
主要用途a、平面结构;b、碳碳键是一种介于单键和双键之间的独特的键。易取代、难加成、难氧化重要化工原料分子结构特点
主要化学性质
主要用途乙醇羟基与烷烃基直接相连(1)与活泼金属反应(3)氧化反应(燃烧、氧化剂氧化、催化氧化)(2)酯化反应(取代、可逆) 重要的化工原料,可用作车用燃料,是一类新的可再生能源。(4)消去反应分子结构特点
主要化学性质
主要用途乙酸羧基与烃基直接相连①弱酸性②酯化反应制食醋,重要化工原料。
(一)、??原子结构和构成粒子数量间的关系
1、原子( X)中,质子有 个,中子有 个,核外电子有 个。
2、相互关系
(1)??质量数=
(2)??原子中:质子数=ZA-ZZ 质子数+中子数核电荷数=核外电子数Az1、1H、2H、3H、H+、H2是( )
A.氢的5种同位素
B.5种氢元素
C.氢的5种同素异形体
D.氢元素的5种不同微粒(二)、理解同位素的概念: D质子数相同而中子数不同的同一元素的不同原子互称为同位素B3、下列各组中,属于同位素的是:( ? )
A.H2、D2、T2?? B.金刚石和足球烯C60???
C.H2O和D2O???? D.16O和18OD (三)、核外电子排布
练习1.下列叙述正确的是( )?
A.两种粒子,若核外电子排布完全相同,则其化学性质一定相同?
B.凡单原子形成的离子,一定具有稀有气体元素原子的核外电子排布?
C.两原子,若核外电子排布相同,则一定属于同种元素
D.不存在两种质子数和电子数均相同的阳离子和阴离子CD二、元素同期表
1、元素周期表一共 行, 纵列。从横的方面看,分为 个短周期, 个长周期,共为 个周期。从纵的方面看,分为 个主族, 个副族,一个 族和 族。七三七七七018四VIII 2、元素周期表与原子结构的关系
周期序数= 。
主族序数= = ______________
主族元素的最低负化合价=8 - 。 电子层数 最外层电子数 最高正化价 主族序数 三、元素周期律元素的性质微观性质: 原子半径、化合价、 电子得失能力宏观性质:金属性、非金属性 元素的金属性和非金属性递变小结非金属性逐渐增强金属性逐渐增强金属性逐渐增强非金属性逐渐增强大→小小→大逐渐减小
逐渐增大逐渐增大
逐渐减小金属性递减、
非金属性递增金属性递增、非金属性递减电子层数相同、最外层电子增多电子层增多最外层电子数相同元素周期律的内容: 元素的性质随着原子序数的递增呈周期性的变化。元素周期律的实质: 元素的性质周期性变化是元素的原子核外电子排布呈周期性变化的必然结果。“位、构、性”的关系 结构位置性质(1)核电荷数、原子序数(2)核外电子电子层最外层电子物理性质单质性质化合物的性质离子性质元素性质 1、 碱金属元素的性质1
软,亮.轻.
低(熔点).
略带
金色单质都具有强的还原性 元素的性质与原子结构7单质的熔,沸点较低,颜色较深单质具有强的氧化性2、卤素的性质 卤素的化学性质1、与氢气反应H2 + X2 = 2HX(X=F、Cl、Br、I)从氟到碘,反应从易到难,反应剧烈程度越来越弱。生成的氢化物稳定性:HF > HCl > HBr > HI2、卤素单质氧化性:F2 > Cl2 > Br2 > I2总结 通过比较碱金属单质与氧气、与水的反应,以及卤素单质与氢气的反应、卤素单质间的置换反应,得出结论: 元素的性质与________有密切的关系,主要与____________________,特别是______________有关。原子结构 原子核外电子的排布最外层电子数四、化学键化学键: 在原子结合成分子时,相邻的原子之间强烈的相互作用,叫做化学键。化学反应的过程,本质上就是旧化学键断裂和新化学键形成的过程。化学键离子键共价键非极性键极性键活泼金属与活泼非金属之间非金属元素之间阴、阳离子之间的静电作用原子间形成共用电子对有方括号、有正负号无方括号、有正负号(1).离子键和共价键(2)书写有关物质或微粒的电子式(1).1~18号元素原子的电子式
(2).Na+ NH4+ O22- Cl2、 N2、 CCl4 、NaCl、MgO、MgCl2的电子式
(3).H2S、NH4Cl、H2O2中化学键的形成过程(3)判断下列物质内的化学键,哪些是极性共价键,哪些是非极性共价键?
1.CO2
2. H2O2
3. Na2O
4.Na2O2
5.NH4Cl第二章 化学反应与能量复习1、各种物质都储存有化学能。不同的物质因组成不同、结构不同,所包含的化学能也不同。
2.化学反应中是吸收能量还是放出能量,决定于反应物的总能量与生成物的总能量的相对大小。
3.化学反应中能量变化的主要原因是:化学键的断裂和形成。断开反应物中的化学键要吸收能量,形成生成物中的化学键要放出能量。
4.化学反应中能量变化,主要表现为热量的变化,也可以转化为电能、光能、声能等。化学反应中能量变化与化学键的关系定义:化学能转化为电能的装置形成条件:⑴两极; ⑵电解质溶液; ⑶闭合判断:正负极和电子流向工作原理:(总的氧化还原反应,电极反应)应用题型分析常见、简单电池工作原理。比较金属活动性强弱。比较反应速率快慢。判断溶液pH变化。金属的腐蚀和防护。原电池(从活泼性比较、电子得失、氧化还原反应等多角度判断)设计简单电池。判断原电池正、负极的方法*由组成原电池的两极材料判断: 一般是活泼的金属为负极
活泼性较弱的金属或能导电的非金属为正极*根据电流方向或电子流动方向判断: 电流是由正极流向负极
电子流动方向是由负极流向正极*根据原电池两极发生的变化来判断: 失电子的反应→氧化反应→负极
得电子的反应→还原反应→正极1.化学反应速率是衡量化学反应快慢的物理量。
通常用单位时间内反应物浓度的减小或生成物浓度的增加来表示。3. 单位:mol/(L·s)或mol/(L·min) 化学反应速率概念:1、内因:反应物自身因素
2、外因:
温度:温度越高,反应速率越大。
催化剂:正催化剂能显著增大反应速率。
浓度:反应物浓度越大,反应速率越大。
压强:压强越大,气体反应的速率越大。
其它:接触面积、光、超声波等。 影响化学反应速率的因素: 化学反应限度:1、化学平衡状态:
当一个可逆反应进行到正向反应速率与逆向反应速率相等时,各反应物和生成物的浓度不随时间改变,化学反应达到平衡状态,反应程度达到限度。2、化学平衡的特征:逆、等、动、定、变3、化学平衡的标志增大反应物浓度,向正反应方向移动。1、浓度:2、温度:升高温度,向吸热的反应方向移动。3、压强:增大压强,向气体体积减少的的方向移动。4、催化剂:化学平衡不移动。 影响化学平衡的因素:第三章有机化合物复习1、成键特点: 在有机物分子中碳呈四价。碳原子既可与其他原子形成共价键,碳原子之间也可相互成键;既可以形成单键,也可以形成双键或三键;碳碳之间可以形成长的碳链,也可以形成碳环。 当烃分子中的碳原子个数为n时,其中氢原子个数的最大数值为2n+2,这是氢原子个数的上限值。以烷烃分子结构和分子组成通式CnH2n+2为基础进行分析和比较:在结构中,若增加一个C=C或C=O双键,就少2个H;在结构中若出现一个C≡C就少4个H;在结构中若出现一个环状结构也少2个H;所以,烯烃和环烷烃的分子组成通式都为CnH2n;炔烃和二烯烃的分子组成通式都为CnH2n-2;苯和苯的同系物,结构中有苯环结构,苯环可以看成是具有3个C=C双键和一个环状结构,氢原子个数应在烷烃的基础上减去4×2=8个,故苯和苯的同系物的分子组成通式为:
CnH(2n+2-4×2)即CnH2n-6 (n≥6)。一、基本概念2、同系物 : 结构相似,在分子组成上相差一个或若干个CH2原子团的物质互称为同系物。如甲烷、乙烷、丙烷 ······(1)同系物必须结构相似,即组成元素相同,官能团种类、个数及连接方式相同,分子组成通式相同。
(2)同系物在组成上相差一个或若干个“CH2”,即相对分子质量相差14或14的整数倍。
(3)同系物有相似的化学性质,物理性质有一定的递变规律。3、同分异构体 : 具有同分异现象的不同化合物互称为同分异构体。 化合物具有相同的分子式,但具有不同结构式的现象称为同分异现象。 同分异构体可以属于同一类物质,也可以属于不同类物质。可以是有机物,也可以是无机物。
中学阶段涉及的同分异构体常见的有三类:
(1)碳链异构(2)位置(官能团位置)异构 (3)类别异构(又称官能团异构)1、取代反应: 有机物分子里的某些原子或原子团被其他原子或原子团所替代的反应叫取代反应。 被加成的试剂如:H2、X2(X为Cl、Br或I)、H2O、HX、HCN等能离解成一价原子或原子团的物质。通过有机物发生加成反应时反应物之间的量关系,还可定量判断该有机物分子结构中不饱和键的情况:是C=C键,还是C≡C键,或是苯环结构,以及它们的个数。2、加成反应(及加聚反应) : 有机物分子中双键或三键两端的碳原子与其它原子或原子团直接结合生成新的化合物的反应,叫做加成反应 二、基本反应类型3、酯化反应(属于取代反应) : 酸和醇作用生成酯和水的反应叫做酯化反应 。 ①酯化反应的脱水方式是: “酸脱羟基醇脱氢”(可用同位素原子示踪法证明)。 ③在酯化反应中使用饱和Na2CO3溶液的作用是中和乙酸,溶解乙醇,降低酯的溶解度,使酯浮于水面,容易分层析出,便于分离。三、重要有机物的结构、性质和用途 甲烷乙烯苯乙醇乙酸糖类油脂蛋白质甲烷分子结构特点
主要化学性质
主要用途饱和烃易取代、能分解、难氧化清洁能源、化工原料乙烯分子结构特点
主要化学性质
主要用途——不饱和烃CH2=CH2易氧化、易加成(加聚)⑴石油化学工业最重要的基础原料⑵植物生长调节剂 ——产量作为石油化工水平的标志苯分子结构特点
主要化学性质
主要用途a、平面结构;b、碳碳键是一种介于单键和双键之间的独特的键。易取代、难加成、难氧化重要化工原料分子结构特点
主要化学性质
主要用途乙醇羟基与烷烃基直接相连(1)与活泼金属反应(3)氧化反应(燃烧、氧化剂氧化、催化氧化)(2)酯化反应(取代、可逆) 重要的化工原料,可用作车用燃料,是一类新的可再生能源。(4)消去反应分子结构特点
主要化学性质
主要用途乙酸羧基与烃基直接相连①弱酸性②酯化反应制食醋,重要化工原料。
同课章节目录
