》高中化学》新课标人教版》选修4 化学反应原理》第三章 水溶液中的离子平衡》第四节 难溶电解的溶解平衡
文档属性
| 名称 | 》高中化学》新课标人教版》选修4 化学反应原理》第三章 水溶液中的离子平衡》第四节 难溶电解的溶解平衡 |

|
|
| 格式 | zip | ||
| 文件大小 | 126.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2008-07-19 11:31:00 | ||
图片预览






文档简介
课件22张PPT。第四节 难溶电解质的溶解平衡黄山市田家炳实验学校 程培红复习:
1.离子反应发生的条件有哪些?
2.生成弱电解质的反应能进行到底吗?举例说明。
3.生成难溶于水的沉淀的反应能进行到底吗?
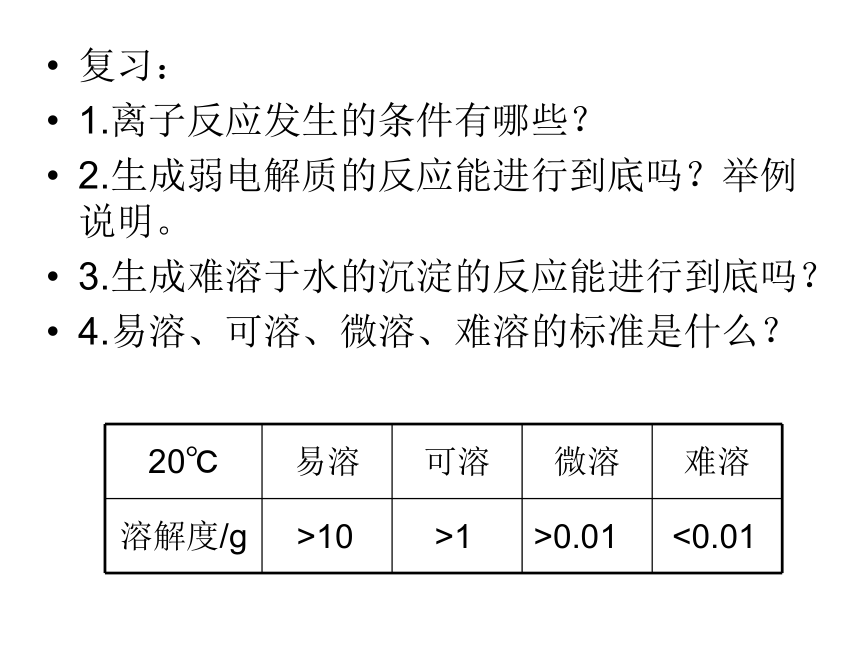
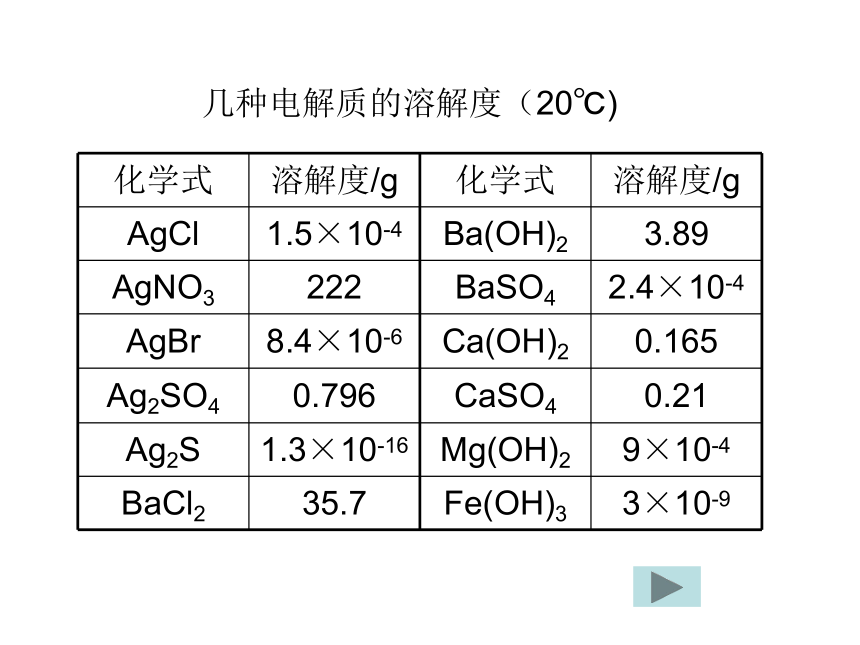
4.易溶、可溶、微溶、难溶的标准是什么?>10>1>0.01<0.01几种电解质的溶解度(20℃)一、难溶电解质的溶解平衡1.概念:
在一定条件下,当难溶电解质溶解与和生成速率相等时,得到难溶电解质的饱和溶液,即达到溶解平衡。
例:AgNO3溶液与 NaCl溶液混合时,有以下关系:
Ag+(aq) + Cl-(aq) AgCl(s)AgCl(s)Ag+(aq) +Cl-(aq)一、难溶电解质的溶解平衡2.几点说明:
溶解平衡的存在,决定了生成难溶电解质的反应不能进行到底。
习惯上将生成难溶电解质的反应,认为反应完全了,因对于常量的反应来说,0.01 g是很小的。当溶液中残留的离子浓度< 1 ×10-5 mol/L时,沉淀就达到完全。
难溶电解质的溶解度尽管很小,但不会等于0。如Ag2S的溶解度为1.3×10-16 g。
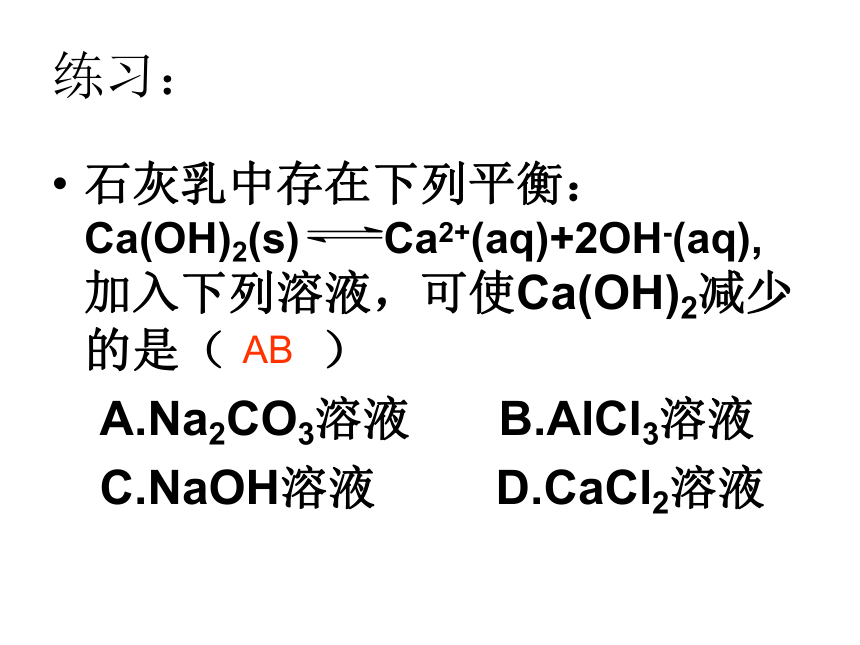
溶解平衡与化学平衡一样,受外界条件的影响而发生移动。练习:石灰乳中存在下列平衡:Ca(OH)2(s) Ca2+(aq)+2OH-(aq),加入下列溶液,可使Ca(OH)2减少的是( )
A.Na2CO3溶液 B.AlCl3溶液
C.NaOH溶液 D.CaCl2溶液AB二、沉淀反应的应用1.利用沉淀来分离或除去某些离子
例:NH4Cl中含有FeCl3,使其溶于水,再加氨水调节pH到7~8,使Fe3+生成Fe(OH)3沉淀而除去。
Fe3++3NH3·H2O = Fe(OH)3↓+3NH4+
常用沉淀剂还有Na2S、H2S等,与某些金属离子生成极难溶的硫化物沉淀。例:
Cu2++H2S = CuS↓+2H+
Hg2+ + S2- = HgS↓思考与交流1.如果要除去某溶液中的SO42-,选择加入钙盐还是钡盐?为什么?
2.如果要除去某溶液中的Mg2+,应该加入什么离子比较好?为什么?
3.以你现有的知识,你认为判断沉淀能否生成可从那些方面考虑?是否可使要除去的离子全部通过沉淀除去?如何尽可能多地除去?钡盐。硫酸钡难溶,可使硫酸根离子沉淀完全,而硫酸钙微溶,硫酸根沉淀不完全。加入OH-为好。Mg(OH)2难溶,而MgCO3微溶沉淀生成可从溶解度大小来考虑。不可能使要除去的离子全部通过沉淀除去,因存在溶解平衡。
可以加入过量的沉淀剂,以使平衡向沉淀的方向移动。二、沉淀反应的应用2. 沉淀的溶解
原理:不断移去溶解平衡体系中的相应离子,使平衡向沉淀溶解的方向移动,就达到使沉淀溶解的目的。
例:CaCO3(s) CO32-(aq) + Ca2+(aq)
HCO3-+H++H+H2CO3H2O + CO2强酸是常用的溶解难溶电解质的试剂。如可溶解难溶氢氧化物,难溶碳酸盐、某些难溶硫化物等。实验:向三支盛有少量Mg(OH)2沉淀的试管中分别加入适量的蒸馏水、盐酸和氯化铵溶液,观察并记录现象:无明显现象沉淀溶解沉淀溶解请用平衡移动原理解释加盐酸沉淀溶解的原理。盐酸中H+与氢氧化镁产生的OH-生成水,使溶解平衡向沉淀溶解的方向移动,氢氧化镁逐渐溶解。二、沉淀反应的应用2. 沉淀的溶解
某些盐因水解呈酸性,也可用来溶解某些难溶电解质。Mg(OH)2(s)Mg2+(aq) + 2OH-(aq)H2ONH4+ + H2O NH3·H2O + H+OH-+ H+因OH-浓度降低,使溶解平衡向沉淀溶解的方向移动。Mg(OH)2+2NH4Cl = MgCl2 + 2NH3↑+ 2H2O三、沉淀的转化实验3-4:NaCl和AgNO3混合生成白色沉淀向所得固液混合物中滴加KI溶液白色沉淀转变为黄色向新得固液混合物中滴加Na2S溶液黄色沉淀转变为黑色实验3-5:向MgCl2溶液中滴加NaOH溶液生成白色沉淀向有白色沉淀的溶液中滴加FeCl3溶液白色沉淀转变为红褐色静置红褐色沉淀析出,溶液变无色三、沉淀的转化思考与交流1.根据你所观察到的现象,分析所发生的反应。
2.如果将上述两个实验中的沉淀生成和转化的步骤颠倒顺序,会产生什么结果?试用平衡移动原理和两种沉淀溶解度上的差别加以解释,并找出这类反应发生的特点。溶解度溶解度小的沉淀转化为溶解度更小的沉淀。两者差别越大,转化越容易。沉淀的转化的实质就是沉淀溶解平衡的移动沉淀转化的应用举例
1.对于一些用酸或其它方法不能溶解的沉淀,可以先将其转化为另一种用酸或其它方法能溶解的沉淀。例
水垢中的CaSO4,用Na2CO3处理,使之转化为CaCO3,而后用酸除去。
CaSO4 (s) SO42- + Ca2+
+CO32-CaCO3(s)沉淀转化的应用举例
1.对于一些用酸或其它方法不能溶解的沉淀,可以先将其转化为另一种用酸或其它方法能溶解的沉淀。例
水垢中的CaSO4,用Na2CO3处理,使之转化为CaCO3,而后用酸除去。
CaSO4 (s) SO42- + Ca2+
+CO32-CaCO3(s)沉淀转化的应用举例
2. 自然界也发生着溶解度小的矿物转化为溶解度更小的矿物的现象。例
各种原生铜的硫化物经氧化、淋滤作用后可变成CuSO4溶液,并向深部渗透,遇到深层的闪锌矿(ZnS)和方铅矿(PbS),便慢慢地使之转变为铜蓝(CuS)。
科学视野—溶度积KSP对于溶解平衡:
MmNn(s) mMn+(aq) + nNm+(aq)有:
KSP=[c(Mn+)]m·[c(Nm+)]n
在一定温度下, KSP是一个常数。
溶液中有关离子浓度幂的乘积—离子积QC。溶液过饱和,有沉淀析出溶液饱和,沉淀与溶解处于平衡状态溶液未饱和,可继续溶解该难溶电解质练习:1.向0.1 mol/L AgNO3溶液的试管中滴加0.1 mol/L NaCl溶液,至不再有白色沉淀生成为止。取其中澄清溶液,逐滴加入饱和Na2S溶液,有无沉淀生成?
是否可以用Na2SO4代替Na2S?
如果先向AgNO3溶液中加Na2S溶液至沉淀完全,再向上层清液中滴加NaCl,情况又如何?试解释原因。没有沉淀生成。Ag2S饱和溶液中Ag+太少,不能生成AgCl沉淀。有黑色沉淀生成。不可以,
设c(SO42-)=0.1 mol/L,
为使而之沉淀,
c(Ag+)=(1.4×10-5/0.1)1/2
=1.18×10-2 mol/L。
而在AgCl饱和溶液中
c(Ag+)=(1.8×10-10)1/2=1.34×10-5 mol/L练习:2.在粗制CuSO4·5H2O晶体中常含有杂质Fe2+ 。在提纯时,为了除去Fe2+,常加入少量H2O2,使Fe2+氧化为Fe3+,然后再加少量碱到溶液pH=4,可以达到除去铁离子而不损失硫酸铜的目的。试解释原因。
溶解性:Fe(OH)2>Cu(OH)2>Fe(OH)3。
3.小结Ksp的大小与沉淀转化的关系。
对于同类型的难溶电解质, Ksp的大小与溶解度的大小一致, Ksp较大的沉淀可以转化为Ksp较小的沉淀。
1.离子反应发生的条件有哪些?
2.生成弱电解质的反应能进行到底吗?举例说明。
3.生成难溶于水的沉淀的反应能进行到底吗?
4.易溶、可溶、微溶、难溶的标准是什么?>10>1>0.01<0.01几种电解质的溶解度(20℃)一、难溶电解质的溶解平衡1.概念:
在一定条件下,当难溶电解质溶解与和生成速率相等时,得到难溶电解质的饱和溶液,即达到溶解平衡。
例:AgNO3溶液与 NaCl溶液混合时,有以下关系:
Ag+(aq) + Cl-(aq) AgCl(s)AgCl(s)Ag+(aq) +Cl-(aq)一、难溶电解质的溶解平衡2.几点说明:
溶解平衡的存在,决定了生成难溶电解质的反应不能进行到底。
习惯上将生成难溶电解质的反应,认为反应完全了,因对于常量的反应来说,0.01 g是很小的。当溶液中残留的离子浓度< 1 ×10-5 mol/L时,沉淀就达到完全。
难溶电解质的溶解度尽管很小,但不会等于0。如Ag2S的溶解度为1.3×10-16 g。
溶解平衡与化学平衡一样,受外界条件的影响而发生移动。练习:石灰乳中存在下列平衡:Ca(OH)2(s) Ca2+(aq)+2OH-(aq),加入下列溶液,可使Ca(OH)2减少的是( )
A.Na2CO3溶液 B.AlCl3溶液
C.NaOH溶液 D.CaCl2溶液AB二、沉淀反应的应用1.利用沉淀来分离或除去某些离子
例:NH4Cl中含有FeCl3,使其溶于水,再加氨水调节pH到7~8,使Fe3+生成Fe(OH)3沉淀而除去。
Fe3++3NH3·H2O = Fe(OH)3↓+3NH4+
常用沉淀剂还有Na2S、H2S等,与某些金属离子生成极难溶的硫化物沉淀。例:
Cu2++H2S = CuS↓+2H+
Hg2+ + S2- = HgS↓思考与交流1.如果要除去某溶液中的SO42-,选择加入钙盐还是钡盐?为什么?
2.如果要除去某溶液中的Mg2+,应该加入什么离子比较好?为什么?
3.以你现有的知识,你认为判断沉淀能否生成可从那些方面考虑?是否可使要除去的离子全部通过沉淀除去?如何尽可能多地除去?钡盐。硫酸钡难溶,可使硫酸根离子沉淀完全,而硫酸钙微溶,硫酸根沉淀不完全。加入OH-为好。Mg(OH)2难溶,而MgCO3微溶沉淀生成可从溶解度大小来考虑。不可能使要除去的离子全部通过沉淀除去,因存在溶解平衡。
可以加入过量的沉淀剂,以使平衡向沉淀的方向移动。二、沉淀反应的应用2. 沉淀的溶解
原理:不断移去溶解平衡体系中的相应离子,使平衡向沉淀溶解的方向移动,就达到使沉淀溶解的目的。
例:CaCO3(s) CO32-(aq) + Ca2+(aq)
HCO3-+H++H+H2CO3H2O + CO2强酸是常用的溶解难溶电解质的试剂。如可溶解难溶氢氧化物,难溶碳酸盐、某些难溶硫化物等。实验:向三支盛有少量Mg(OH)2沉淀的试管中分别加入适量的蒸馏水、盐酸和氯化铵溶液,观察并记录现象:无明显现象沉淀溶解沉淀溶解请用平衡移动原理解释加盐酸沉淀溶解的原理。盐酸中H+与氢氧化镁产生的OH-生成水,使溶解平衡向沉淀溶解的方向移动,氢氧化镁逐渐溶解。二、沉淀反应的应用2. 沉淀的溶解
某些盐因水解呈酸性,也可用来溶解某些难溶电解质。Mg(OH)2(s)Mg2+(aq) + 2OH-(aq)H2ONH4+ + H2O NH3·H2O + H+OH-+ H+因OH-浓度降低,使溶解平衡向沉淀溶解的方向移动。Mg(OH)2+2NH4Cl = MgCl2 + 2NH3↑+ 2H2O三、沉淀的转化实验3-4:NaCl和AgNO3混合生成白色沉淀向所得固液混合物中滴加KI溶液白色沉淀转变为黄色向新得固液混合物中滴加Na2S溶液黄色沉淀转变为黑色实验3-5:向MgCl2溶液中滴加NaOH溶液生成白色沉淀向有白色沉淀的溶液中滴加FeCl3溶液白色沉淀转变为红褐色静置红褐色沉淀析出,溶液变无色三、沉淀的转化思考与交流1.根据你所观察到的现象,分析所发生的反应。
2.如果将上述两个实验中的沉淀生成和转化的步骤颠倒顺序,会产生什么结果?试用平衡移动原理和两种沉淀溶解度上的差别加以解释,并找出这类反应发生的特点。溶解度溶解度小的沉淀转化为溶解度更小的沉淀。两者差别越大,转化越容易。沉淀的转化的实质就是沉淀溶解平衡的移动沉淀转化的应用举例
1.对于一些用酸或其它方法不能溶解的沉淀,可以先将其转化为另一种用酸或其它方法能溶解的沉淀。例
水垢中的CaSO4,用Na2CO3处理,使之转化为CaCO3,而后用酸除去。
CaSO4 (s) SO42- + Ca2+
+CO32-CaCO3(s)沉淀转化的应用举例
1.对于一些用酸或其它方法不能溶解的沉淀,可以先将其转化为另一种用酸或其它方法能溶解的沉淀。例
水垢中的CaSO4,用Na2CO3处理,使之转化为CaCO3,而后用酸除去。
CaSO4 (s) SO42- + Ca2+
+CO32-CaCO3(s)沉淀转化的应用举例
2. 自然界也发生着溶解度小的矿物转化为溶解度更小的矿物的现象。例
各种原生铜的硫化物经氧化、淋滤作用后可变成CuSO4溶液,并向深部渗透,遇到深层的闪锌矿(ZnS)和方铅矿(PbS),便慢慢地使之转变为铜蓝(CuS)。
科学视野—溶度积KSP对于溶解平衡:
MmNn(s) mMn+(aq) + nNm+(aq)有:
KSP=[c(Mn+)]m·[c(Nm+)]n
在一定温度下, KSP是一个常数。
溶液中有关离子浓度幂的乘积—离子积QC。溶液过饱和,有沉淀析出溶液饱和,沉淀与溶解处于平衡状态溶液未饱和,可继续溶解该难溶电解质练习:1.向0.1 mol/L AgNO3溶液的试管中滴加0.1 mol/L NaCl溶液,至不再有白色沉淀生成为止。取其中澄清溶液,逐滴加入饱和Na2S溶液,有无沉淀生成?
是否可以用Na2SO4代替Na2S?
如果先向AgNO3溶液中加Na2S溶液至沉淀完全,再向上层清液中滴加NaCl,情况又如何?试解释原因。没有沉淀生成。Ag2S饱和溶液中Ag+太少,不能生成AgCl沉淀。有黑色沉淀生成。不可以,
设c(SO42-)=0.1 mol/L,
为使而之沉淀,
c(Ag+)=(1.4×10-5/0.1)1/2
=1.18×10-2 mol/L。
而在AgCl饱和溶液中
c(Ag+)=(1.8×10-10)1/2=1.34×10-5 mol/L练习:2.在粗制CuSO4·5H2O晶体中常含有杂质Fe2+ 。在提纯时,为了除去Fe2+,常加入少量H2O2,使Fe2+氧化为Fe3+,然后再加少量碱到溶液pH=4,可以达到除去铁离子而不损失硫酸铜的目的。试解释原因。
溶解性:Fe(OH)2>Cu(OH)2>Fe(OH)3。
3.小结Ksp的大小与沉淀转化的关系。
对于同类型的难溶电解质, Ksp的大小与溶解度的大小一致, Ksp较大的沉淀可以转化为Ksp较小的沉淀。
