金属的化学性质(黑龙江省哈尔滨市南岗区)
文档属性
| 名称 | 金属的化学性质(黑龙江省哈尔滨市南岗区) |  | |
| 格式 | rar | ||
| 文件大小 | 160.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2008-07-29 19:35:00 | ||
图片预览








文档简介
课件52张PPT。课题2金属的化学性质
【第一课时】一、金属与氧气的反应
【自主合作】
1.你学过哪些金属与O2的能反应?
2.这些金属与氧气反应需要什么条件?能产生什么现象?
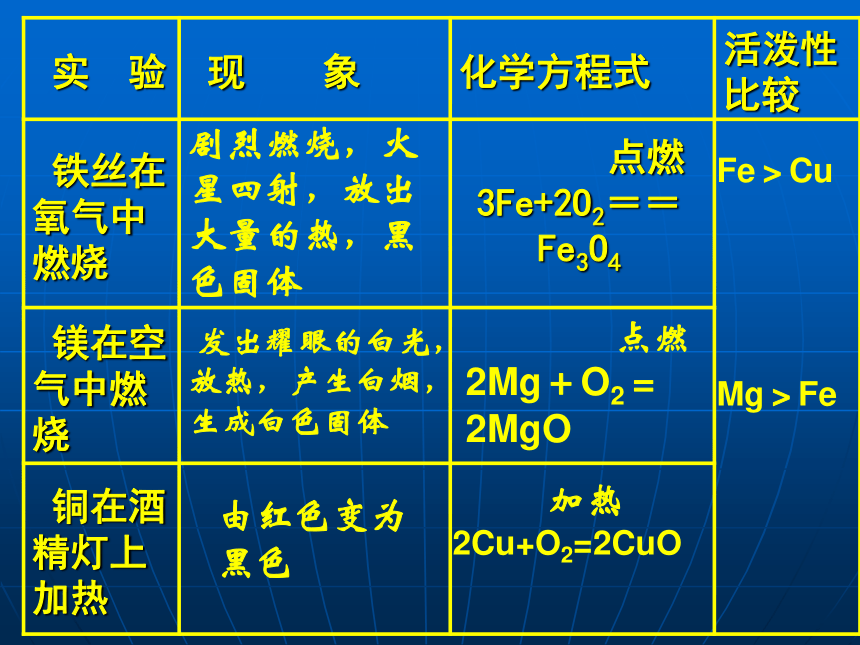
归纳:剧烈燃烧,火星四射,放出大量的热,黑色固体 点燃 3Fe+2O2==Fe3O4?发出耀眼的白光,放热,产生白烟,生成白色固体 点燃
2Mg+O2=2MgO由红色变为黑色 加热 2Cu+O2=2CuOFe>CuMg>Fe思 考:1.铝比铁活泼,为什么铝具有优良的抗腐蚀性能而铁却易生锈?2.分析“真金不怕火炼”蕴含的化学理。铝常温下就能与氧气反应生成一层致密的氧化膜,阻止进一步被氧化4Al+3O2==2Al2O3
铁在潮湿的空气里常温下就会生锈。说明金即使在高温条件下也不与氧气反应不活泼结 论:1、判断金属活动性的方法一:
根据金属与氧气反应的难易程度与反应现象的剧烈程度判断2、大多数金属都能与氧气发生反应金属与酸的反应:
【自主合作】
阅读教材 P10—11
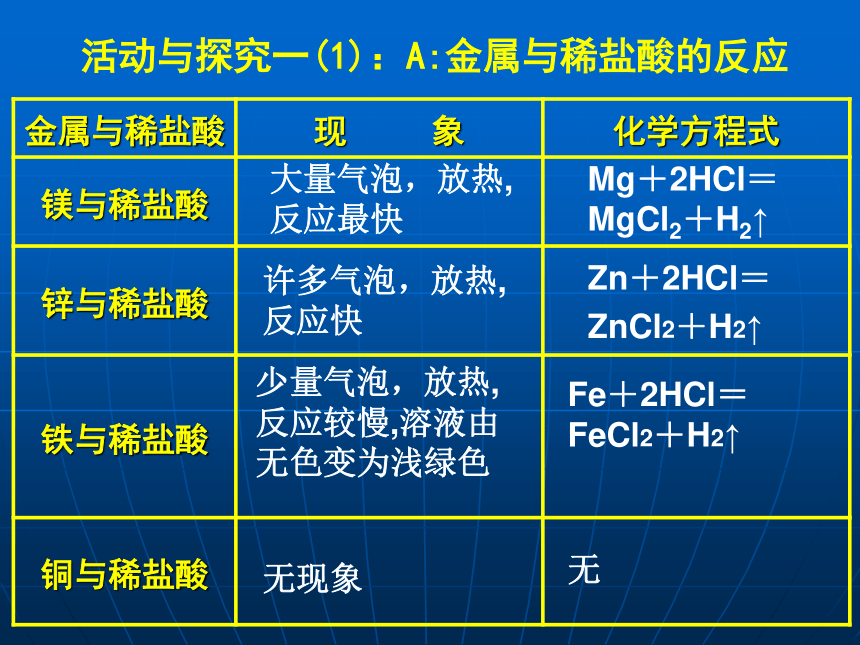
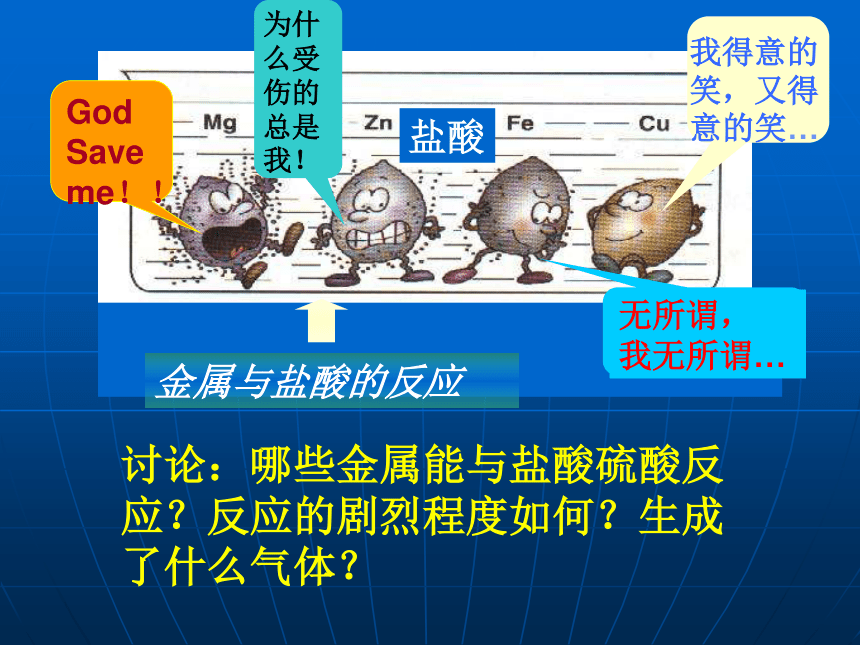
Mg、Zn、Fe、Cu四种金属与稀盐酸能否反应?有什么现象?活动与探究一(1):A:金属与稀盐酸的反应大量气泡,放热,反应最快许多气泡,放热,反应快少量气泡,放热,反应较慢,溶液由无色变为浅绿色无现象Mg+2HCl=MgCl2+H2↑无Fe+2HCl=FeCl2+H2↑Zn+2HCl=
ZnCl2+H2↑讨论:哪些金属能与盐酸硫酸反应?反应的剧烈程度如何?生成了什么气体?归纳:
1.Mg、Zn、Fe三种金属能与稀盐酸反应,Cu不能。
2.Mg与稀盐酸反应剧烈,Fe与盐酸反应最不剧烈。
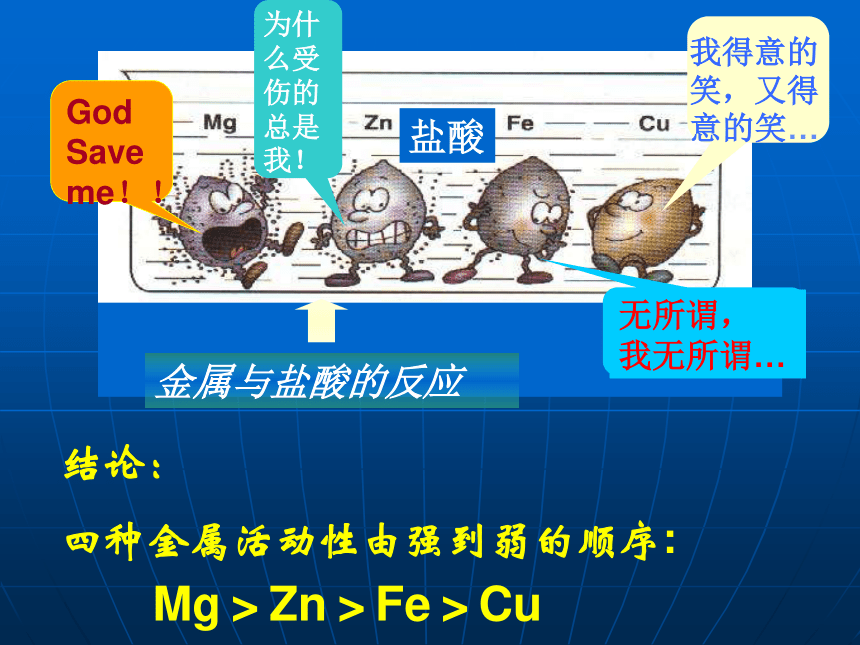
3.四种金属的活动性由强到弱顺序是:Mg>Zn>Fe>Cu作业:1. 预习金属的活动性。
2.书后P14习题1写在作业本上。
3.练习册P8—9第二课时结论:
四种金属活动性由强到弱的顺序:
Mg>Zn>Fe>Cu活动与探究一(2):B:金属与稀H2SO4的反应Mg+H2SO4=MgSO4+H2↑大量气泡,放热,反应最快少量气泡,放热,反应较慢,溶液由无色变为浅绿色Zn+H2SO4=ZnSO4+H2↑许多气泡,放热,反应快Fe+H2SO4=
FeSO4+H2↑无现象无结 论:
1、大多数金属能与稀盐酸或稀硫酸反应;
2、可根据金属是否与稀盐酸或稀硫酸反应或反应的剧烈程度判断金属的活动性强弱;讨论:金属与酸反应有什么特点?
Mg + 2HCl = MgCl2 + H2↑
Zn + 2HCl = ZnCl2 + H2↑
Fe + 2HCl = FeCl2 + H2↑
Mg +H2SO4 = MgSO4 + H2↑
Zn + H2SO4 = ZnSO4 + H2↑
Fe + H2SO4 = FeSO4 + H2↑单质单质化合物化合物上述反应的共同特征1、反应物和产物都只有两种;2、反应物是单质和化合物,产物也是单质和化合物;结论:置换反应:由一种单质与一种化合物反应,生成另一种单质与另一种化合物的反应特点:单质+化合物 → 单质+化合物练习:1.下列金属活动性最强的是( )
A.锌 B.铜 C.镁 D.铁
2.下列物之间的反应不属于置换反应的是( )
A.铁和稀硫酸反应 B.氢气和氧化铜反应 C.铁丝在氧气中燃烧 D.锌与稀盐酸反应3.下列化学方程式符合题意且正确的是( )
A.铁在氧气中燃烧:2Fe+3O2=2Fe2O3
B.镁条在空气中燃烧:Mg+O2=MgO
C.铁和稀盐酸反应:2Fe+6HCl=2FeCl3+3H2↑
D.锌与稀硫酸反应: Zn+H2SO4=ZnSO4+H2↑作业:1.预习课题2剩余部分.
2.教科书中P14的:1、8.
3.练习册中P10 —11.第三课时铁与硫酸铜溶液的反应:
Fe + CuSO4 = FeSO4 + Cu提出问题:铝、铜、银三种金属的活动性顺序的强弱如何证明?金属 金属的化合物的溶液 金属的化合物的溶液 金属 Fe > Cu活动与探究二: 金属与金属化合物溶液的反应
实验:
① 铝丝浸入CuSO4溶液中
② 铜丝浸入AgNO3溶液中
③ 铜丝浸入Al2(SO4)3溶液中
铝丝浸入硫酸铜溶液中 铜丝浸入硝酸银溶液中 “铜树实验”“银针实验”活动与探究二:金属与金属化合物溶液的反应铝丝表面有红色固体出现 溶液颜色由蓝色变为无色无无现象Cu+2 AgNO3 =
2Ag+ Cu(NO3)2? 铜表面有银白色固体出现溶液颜色变为蓝色2Al+3CuSO4 = 3Cu+Al2(SO4)3结论:铝、铜银三种金属的活动性由强到弱的顺序是:
Al>Cu>Ag归纳: 1、部分金属能与金属化合物的溶液反应;
2、可根据金属能不能把另一种金属从金属化合物的溶液中置换出来,判断金属活动性的强弱。作业:1.预习剩余部分。
2.书后P14习题2.3.4.写在作业本上。
3.练习册P12—14。复习总结:1.大多数金属在不同的条件下能和氧气反应。
2.活泼金属能和酸反应生成氢气。
3.有些金属还能与某些金属化合物的溶液(盐溶液)发生置换反应。K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au金属活动性顺序金属活动性由强逐渐减弱钾 钙 钠 镁 铝 锌 铁 锡 铅(氢)铜 汞 银 铂 金金属活动性顺序的应用:
1、在金属活动性顺序中,金属的位置越靠前,其活动性越强。
2、在金属活动性顺序中,排在氢前的金属能与酸反应置换出氢,氢后面的金属不能与酸发生置换反应。
3、在金属活动性顺序中,排在前面的金属(不含K、Ca、Na)可以将其后面的金属从其化合物的溶液里置换出来。小 结:
1、金属的化学性质:
(1)大多数金属能与O2反应
(2)大多数金属能与稀HCl或稀H2SO4反
(3)位于前面的金属能把位于后面的金属从它们的化合物的溶液里置换出来 2、判断常见金属活泼性的方法
(1)可根据金属是否与稀盐酸或稀硫酸反应或反应的剧烈程度判断金属的活动性强弱
(2)金属与能否与金属化合物的溶液反应
(3)根据金属与氧气反应的难易程度与反应现象的剧烈程度判断
一、金属的化学性质:
1、与氧气反应
(金属越活泼,反应越容易,越剧烈)
2、氢前金属+盐酸(稀硫酸)(置换反应)
(金属越活泼,反应越容易,越剧烈)
3、位于前面的金属把位于后面的金属从它的化合物的溶液中置换出来。学完本课题你应该知道二、置换反应(A+BC==B+AC)
三、金属活动顺序及其应用
(判断金属能否在溶液中发生置换反应,及反应的快慢)
作业:1.记忆金属活动性顺序,作业本上默写一遍。
2.练习册上P16—17.
3.复习课题2。第四课时
巩固练习1.判断下列物质能否发生反应?若能,
写出相关化学方程式。
(1)银与稀盐酸 (2)锌与硫酸铜溶液
(3)铜与硫酸锌溶液 (4)铝与硝酸银溶液
(5)银与氯化铜溶液 (6)镁与硫酸亚铁溶液
解答:可发生反应的:(2)(4)(6)化学方程式:(2)Zn + CuSO4 = Cu + ZnSO4(4)Al +3AgNO3 = Al(NO3)3 + 3Ag(6)Mg + FeSO4 = MgSO4 +Fe练习:课堂练习1、有X、Y、Z三种金属。X、Y、Z分别放入稀盐酸中,X溶解并放出氢气,Y、Z无变化;将Y放入Z的化合物溶液中无变化;Z放入Y的化合物溶液中有Y析出:则X、Y、Z的活动性顺序如何?2、实验室制氢气常选择锌与稀盐酸、稀硫酸反应,(1)选用的依据是什么?(2)不选铜的理由?(3)猜想:为什么也不选钾、钙、钠?3.“药金”又称为“愚人金”,实为铜、锌合金(在合金中各种金属仍然保持各自的化学性质不变)。
由于“药金”外观与黄金相似,常被不法商贩用来冒充黄金牟取暴利。
请你设计实验,证明“药金”戒指是假黄金戒指。
题型:探究实验 黄金和黄铜的颜色是相同的,都是黄色。实验室里有两小块放错位置的黄色金属,已知其中一块是黄铜,另一块是黄金。
化学活动小组将这两块黄色金属片分别试管中,再用滴管连续加入稀盐酸,过一会儿取出观察。
①他们探究的问题是 ;②观察到的现象是 ;③他们的实验中错误的操作是 ;应该 。2、X、Y、Z是三种金属,根据下列有关化学方程式可知,三种金属的活动性顺序是( )
① X+ H2SO4== XSO4+ H2 ↑
② X+ YSO4==XSO4+Y
③ Z+YSO4==ZSO4+Y
④ Z+ H2SO4不反应
A、Z>X>Y B、Z>Y>X
C、X>Y>Z D、X>Z>Y
D3、现有X、Y、Z三种金属,若将Z放入X的盐溶液中,Z表面覆盖有X,将Y和Z分别投入稀盐酸中,Y 溶解而Z不溶,则三种金属的活动顺序正确的是( )
A、Y>X>Z B、Y>Z>X
C、X>Y>Z D、X>Z>YA3、将铁片放入下列溶液中,铁片的质量会增加 的是( )
A、稀H2SO4 B、FeSO4溶液
C、CuSO4溶液 D、稀HCl
C下列物质不能由金属和酸反应直接生成的是 ( )
A ZnCl2 B CuSO4
C FeCl2 D Al2(SO4)3B4、将铁片放入下列溶液中,溶液的质量会减少的是( ) A、HCl B、H2SO4 C、Na2 SO4 D、CuSO4 D5、为了测定Ag,Zn,Cu,H的化学活动性强弱,某同学利用Zn粉,Cu片,AgNO3溶液和盐酸4种物质,设计了如下实验方案,其中可行的是( )
A、?Zn+HCl Cu+HCl Zn+AgNO3
B、Zn+HCl Cu+ AgNO3 Zn+AgNO3
C、Cu+HCl Zn+AgNO3 Cu+ AgNO3
D、Zn+HCl Cu+HCl Cu+ AgNO3D6、在CuCl2和NaCl的混合溶液中加入过量的Zn粉,充分反应后过滤,留在滤纸上的固体( ) A、只有Zn B、只有Cu C、有Cu和Na D、有Cu和Zn
D7、把足量锌粉分别加入到含下列各组物质的混合溶液中,充分反应后过滤,滤液中只有一种溶质的是( )
①MgSO4 CuSO4 ②CuSO4 H2SO4
③Cu(NO3)2 AgNO3 ④HCl CuSO4
A、①② B、 ②③
C、 ①④ D、 ③④B思考题:
相同质量的Mg、Zn、Fe和足量的稀硫酸反应,产生氢气的总质量(m)随时间(t)变化的关系如下图,则下图中a、b、c表示的金属分别为:a 、 b 、c 。
MgFeZn实践与应用1.生活中很多人用钢丝球刷铝锅,这种方法妥当吗?为什么?
2.可否用铁桶盛放硫酸铜溶液?
3.下列化学变化属于置换反应的有:
(1)3CO+Fe2O3 = 2Fe+3CO2
(2)3C+2Fe2O3 = 4Fe+3CO2↑
(3)2H2O2 = 2H2O+O2↑
(4)Fe + 2AgNO3 = Fe(NO3)2+2Ag4 为了测定某铁粉中杂质的含量,取该铁粉样品20克,放到盛有200克稀盐酸的烧杯中,反应后烧杯中物质总质量变成219.4克.求
1)铁粉中纯铁的质量分数.
2)稀盐酸的质量分数.
3)反应后的溶液中溶质的质量分数. 8.小华想测定Cu-Zn合金和Cu-Ag合金中铜的质量分数,实验室只提供了一瓶稀盐酸和相关的仪器。
(1)根据现有的条件,你认为只能测出_____________合金中铜的质量分数。
(2)为了测定该合金的组成,小华称取10 g该合金粉末,在粉末中连续三次加入稀盐酸反应。每加一次盐酸,小华记录所得气体的质量,实验数据如下:
(3)从上表数据分析,小华用10 g合金粉末总共收集到氢气_______g。(4)求出该合金中铜的质量分数。 第一次 第二次 第三次
连续加入盐酸的体积(ml) 10 10 1
生成氢气的质量(g) 0.08 0.08 0.04作业:1.归纳整理、复习记忆课题2知识内容。
2.书后P14习题5.8.写在作业本上。
3.练习册P15—17。
4.记忆金属活动性顺序。
【自主合作】
1.你学过哪些金属与O2的能反应?
2.这些金属与氧气反应需要什么条件?能产生什么现象?
归纳:剧烈燃烧,火星四射,放出大量的热,黑色固体 点燃 3Fe+2O2==Fe3O4?发出耀眼的白光,放热,产生白烟,生成白色固体 点燃
2Mg+O2=2MgO由红色变为黑色 加热 2Cu+O2=2CuOFe>CuMg>Fe思 考:1.铝比铁活泼,为什么铝具有优良的抗腐蚀性能而铁却易生锈?2.分析“真金不怕火炼”蕴含的化学理。铝常温下就能与氧气反应生成一层致密的氧化膜,阻止进一步被氧化4Al+3O2==2Al2O3
铁在潮湿的空气里常温下就会生锈。说明金即使在高温条件下也不与氧气反应不活泼结 论:1、判断金属活动性的方法一:
根据金属与氧气反应的难易程度与反应现象的剧烈程度判断2、大多数金属都能与氧气发生反应金属与酸的反应:
【自主合作】
阅读教材 P10—11
Mg、Zn、Fe、Cu四种金属与稀盐酸能否反应?有什么现象?活动与探究一(1):A:金属与稀盐酸的反应大量气泡,放热,反应最快许多气泡,放热,反应快少量气泡,放热,反应较慢,溶液由无色变为浅绿色无现象Mg+2HCl=MgCl2+H2↑无Fe+2HCl=FeCl2+H2↑Zn+2HCl=
ZnCl2+H2↑讨论:哪些金属能与盐酸硫酸反应?反应的剧烈程度如何?生成了什么气体?归纳:
1.Mg、Zn、Fe三种金属能与稀盐酸反应,Cu不能。
2.Mg与稀盐酸反应剧烈,Fe与盐酸反应最不剧烈。
3.四种金属的活动性由强到弱顺序是:Mg>Zn>Fe>Cu作业:1. 预习金属的活动性。
2.书后P14习题1写在作业本上。
3.练习册P8—9第二课时结论:
四种金属活动性由强到弱的顺序:
Mg>Zn>Fe>Cu活动与探究一(2):B:金属与稀H2SO4的反应Mg+H2SO4=MgSO4+H2↑大量气泡,放热,反应最快少量气泡,放热,反应较慢,溶液由无色变为浅绿色Zn+H2SO4=ZnSO4+H2↑许多气泡,放热,反应快Fe+H2SO4=
FeSO4+H2↑无现象无结 论:
1、大多数金属能与稀盐酸或稀硫酸反应;
2、可根据金属是否与稀盐酸或稀硫酸反应或反应的剧烈程度判断金属的活动性强弱;讨论:金属与酸反应有什么特点?
Mg + 2HCl = MgCl2 + H2↑
Zn + 2HCl = ZnCl2 + H2↑
Fe + 2HCl = FeCl2 + H2↑
Mg +H2SO4 = MgSO4 + H2↑
Zn + H2SO4 = ZnSO4 + H2↑
Fe + H2SO4 = FeSO4 + H2↑单质单质化合物化合物上述反应的共同特征1、反应物和产物都只有两种;2、反应物是单质和化合物,产物也是单质和化合物;结论:置换反应:由一种单质与一种化合物反应,生成另一种单质与另一种化合物的反应特点:单质+化合物 → 单质+化合物练习:1.下列金属活动性最强的是( )
A.锌 B.铜 C.镁 D.铁
2.下列物之间的反应不属于置换反应的是( )
A.铁和稀硫酸反应 B.氢气和氧化铜反应 C.铁丝在氧气中燃烧 D.锌与稀盐酸反应3.下列化学方程式符合题意且正确的是( )
A.铁在氧气中燃烧:2Fe+3O2=2Fe2O3
B.镁条在空气中燃烧:Mg+O2=MgO
C.铁和稀盐酸反应:2Fe+6HCl=2FeCl3+3H2↑
D.锌与稀硫酸反应: Zn+H2SO4=ZnSO4+H2↑作业:1.预习课题2剩余部分.
2.教科书中P14的:1、8.
3.练习册中P10 —11.第三课时铁与硫酸铜溶液的反应:
Fe + CuSO4 = FeSO4 + Cu提出问题:铝、铜、银三种金属的活动性顺序的强弱如何证明?金属 金属的化合物的溶液 金属的化合物的溶液 金属 Fe > Cu活动与探究二: 金属与金属化合物溶液的反应
实验:
① 铝丝浸入CuSO4溶液中
② 铜丝浸入AgNO3溶液中
③ 铜丝浸入Al2(SO4)3溶液中
铝丝浸入硫酸铜溶液中 铜丝浸入硝酸银溶液中 “铜树实验”“银针实验”活动与探究二:金属与金属化合物溶液的反应铝丝表面有红色固体出现 溶液颜色由蓝色变为无色无无现象Cu+2 AgNO3 =
2Ag+ Cu(NO3)2? 铜表面有银白色固体出现溶液颜色变为蓝色2Al+3CuSO4 = 3Cu+Al2(SO4)3结论:铝、铜银三种金属的活动性由强到弱的顺序是:
Al>Cu>Ag归纳: 1、部分金属能与金属化合物的溶液反应;
2、可根据金属能不能把另一种金属从金属化合物的溶液中置换出来,判断金属活动性的强弱。作业:1.预习剩余部分。
2.书后P14习题2.3.4.写在作业本上。
3.练习册P12—14。复习总结:1.大多数金属在不同的条件下能和氧气反应。
2.活泼金属能和酸反应生成氢气。
3.有些金属还能与某些金属化合物的溶液(盐溶液)发生置换反应。K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au金属活动性顺序金属活动性由强逐渐减弱钾 钙 钠 镁 铝 锌 铁 锡 铅(氢)铜 汞 银 铂 金金属活动性顺序的应用:
1、在金属活动性顺序中,金属的位置越靠前,其活动性越强。
2、在金属活动性顺序中,排在氢前的金属能与酸反应置换出氢,氢后面的金属不能与酸发生置换反应。
3、在金属活动性顺序中,排在前面的金属(不含K、Ca、Na)可以将其后面的金属从其化合物的溶液里置换出来。小 结:
1、金属的化学性质:
(1)大多数金属能与O2反应
(2)大多数金属能与稀HCl或稀H2SO4反
(3)位于前面的金属能把位于后面的金属从它们的化合物的溶液里置换出来 2、判断常见金属活泼性的方法
(1)可根据金属是否与稀盐酸或稀硫酸反应或反应的剧烈程度判断金属的活动性强弱
(2)金属与能否与金属化合物的溶液反应
(3)根据金属与氧气反应的难易程度与反应现象的剧烈程度判断
一、金属的化学性质:
1、与氧气反应
(金属越活泼,反应越容易,越剧烈)
2、氢前金属+盐酸(稀硫酸)(置换反应)
(金属越活泼,反应越容易,越剧烈)
3、位于前面的金属把位于后面的金属从它的化合物的溶液中置换出来。学完本课题你应该知道二、置换反应(A+BC==B+AC)
三、金属活动顺序及其应用
(判断金属能否在溶液中发生置换反应,及反应的快慢)
作业:1.记忆金属活动性顺序,作业本上默写一遍。
2.练习册上P16—17.
3.复习课题2。第四课时
巩固练习1.判断下列物质能否发生反应?若能,
写出相关化学方程式。
(1)银与稀盐酸 (2)锌与硫酸铜溶液
(3)铜与硫酸锌溶液 (4)铝与硝酸银溶液
(5)银与氯化铜溶液 (6)镁与硫酸亚铁溶液
解答:可发生反应的:(2)(4)(6)化学方程式:(2)Zn + CuSO4 = Cu + ZnSO4(4)Al +3AgNO3 = Al(NO3)3 + 3Ag(6)Mg + FeSO4 = MgSO4 +Fe练习:课堂练习1、有X、Y、Z三种金属。X、Y、Z分别放入稀盐酸中,X溶解并放出氢气,Y、Z无变化;将Y放入Z的化合物溶液中无变化;Z放入Y的化合物溶液中有Y析出:则X、Y、Z的活动性顺序如何?2、实验室制氢气常选择锌与稀盐酸、稀硫酸反应,(1)选用的依据是什么?(2)不选铜的理由?(3)猜想:为什么也不选钾、钙、钠?3.“药金”又称为“愚人金”,实为铜、锌合金(在合金中各种金属仍然保持各自的化学性质不变)。
由于“药金”外观与黄金相似,常被不法商贩用来冒充黄金牟取暴利。
请你设计实验,证明“药金”戒指是假黄金戒指。
题型:探究实验 黄金和黄铜的颜色是相同的,都是黄色。实验室里有两小块放错位置的黄色金属,已知其中一块是黄铜,另一块是黄金。
化学活动小组将这两块黄色金属片分别试管中,再用滴管连续加入稀盐酸,过一会儿取出观察。
①他们探究的问题是 ;②观察到的现象是 ;③他们的实验中错误的操作是 ;应该 。2、X、Y、Z是三种金属,根据下列有关化学方程式可知,三种金属的活动性顺序是( )
① X+ H2SO4== XSO4+ H2 ↑
② X+ YSO4==XSO4+Y
③ Z+YSO4==ZSO4+Y
④ Z+ H2SO4不反应
A、Z>X>Y B、Z>Y>X
C、X>Y>Z D、X>Z>Y
D3、现有X、Y、Z三种金属,若将Z放入X的盐溶液中,Z表面覆盖有X,将Y和Z分别投入稀盐酸中,Y 溶解而Z不溶,则三种金属的活动顺序正确的是( )
A、Y>X>Z B、Y>Z>X
C、X>Y>Z D、X>Z>YA3、将铁片放入下列溶液中,铁片的质量会增加 的是( )
A、稀H2SO4 B、FeSO4溶液
C、CuSO4溶液 D、稀HCl
C下列物质不能由金属和酸反应直接生成的是 ( )
A ZnCl2 B CuSO4
C FeCl2 D Al2(SO4)3B4、将铁片放入下列溶液中,溶液的质量会减少的是( ) A、HCl B、H2SO4 C、Na2 SO4 D、CuSO4 D5、为了测定Ag,Zn,Cu,H的化学活动性强弱,某同学利用Zn粉,Cu片,AgNO3溶液和盐酸4种物质,设计了如下实验方案,其中可行的是( )
A、?Zn+HCl Cu+HCl Zn+AgNO3
B、Zn+HCl Cu+ AgNO3 Zn+AgNO3
C、Cu+HCl Zn+AgNO3 Cu+ AgNO3
D、Zn+HCl Cu+HCl Cu+ AgNO3D6、在CuCl2和NaCl的混合溶液中加入过量的Zn粉,充分反应后过滤,留在滤纸上的固体( ) A、只有Zn B、只有Cu C、有Cu和Na D、有Cu和Zn
D7、把足量锌粉分别加入到含下列各组物质的混合溶液中,充分反应后过滤,滤液中只有一种溶质的是( )
①MgSO4 CuSO4 ②CuSO4 H2SO4
③Cu(NO3)2 AgNO3 ④HCl CuSO4
A、①② B、 ②③
C、 ①④ D、 ③④B思考题:
相同质量的Mg、Zn、Fe和足量的稀硫酸反应,产生氢气的总质量(m)随时间(t)变化的关系如下图,则下图中a、b、c表示的金属分别为:a 、 b 、c 。
MgFeZn实践与应用1.生活中很多人用钢丝球刷铝锅,这种方法妥当吗?为什么?
2.可否用铁桶盛放硫酸铜溶液?
3.下列化学变化属于置换反应的有:
(1)3CO+Fe2O3 = 2Fe+3CO2
(2)3C+2Fe2O3 = 4Fe+3CO2↑
(3)2H2O2 = 2H2O+O2↑
(4)Fe + 2AgNO3 = Fe(NO3)2+2Ag4 为了测定某铁粉中杂质的含量,取该铁粉样品20克,放到盛有200克稀盐酸的烧杯中,反应后烧杯中物质总质量变成219.4克.求
1)铁粉中纯铁的质量分数.
2)稀盐酸的质量分数.
3)反应后的溶液中溶质的质量分数. 8.小华想测定Cu-Zn合金和Cu-Ag合金中铜的质量分数,实验室只提供了一瓶稀盐酸和相关的仪器。
(1)根据现有的条件,你认为只能测出_____________合金中铜的质量分数。
(2)为了测定该合金的组成,小华称取10 g该合金粉末,在粉末中连续三次加入稀盐酸反应。每加一次盐酸,小华记录所得气体的质量,实验数据如下:
(3)从上表数据分析,小华用10 g合金粉末总共收集到氢气_______g。(4)求出该合金中铜的质量分数。 第一次 第二次 第三次
连续加入盐酸的体积(ml) 10 10 1
生成氢气的质量(g) 0.08 0.08 0.04作业:1.归纳整理、复习记忆课题2知识内容。
2.书后P14习题5.8.写在作业本上。
3.练习册P15—17。
4.记忆金属活动性顺序。
同课章节目录
